884.234г бензола получено из ацетилена (в литрах, н.у.)
201,6
885.Из 26,88л ацетилена получено 23,4г бензола. Выход продукта от теоретически возможного (в %)
75
886.16,8 л, получен бензол массой 15,6г. Выход составил (в %)
80
887.Объем воздуха (н.у., 21% О2), необходимый для сжигания 10,6г 1,3-диметилбензола
112
888.Из 19,5г бензола получено 31,4г бромбензола. Выход продукта в% от теоретически возможного
80
889.При бромировании бензола в присутствии солей железа (III) был получен бромводород, который пропустили через избыток раствора нитрата серебра. При этом образовался осадок массой 18,8 грамм. Масса бромбензола (в г):
15,7
890.Масса нитробензола (г), которую получают нитрованием 390 г бензола, если выход продуктасоставляет 0,8
492
891.Масса нитробензола (в г), образующегося при нитрировании 156 г бензола 94,5 г азотной кислоты
184,5
892.Масса бензола, необходимая для получения 147,6г (выход %) нитробензола
117
893.Реакция, протекающая с выделением теплоты:
экзотермическая
894.Реакция, протекающая с поглощением энергии:
эндотермическая
895.Количество энергии, которое выделяется или поглощается в химических реакциях, может быть измерено:
калориметром
896.Количество теплоты, которое выделяется или поглощается при химических реакциях, называется:
тепловым эффектом
897.Химическое уравнение, в котором указывается тепловой эффект называется:
термохимическим
898.Реакция, протекающая самопроизвольно, если нагреть их до температуры воспламенения:
горение бензина
899.Пример эндотермической реакций:
взаимодействие азота и кислорода
900.Пример экзотермической реакций:
горение угля
901.Реакции, протекающие только при постоянном нагревании:
разложение известняка
902.Термохимическое уравнение 2H2O↔2H2↑+O2↑-572 кДж означает:
полученные O2 и H2 богаче энергией
903.Единица измерения теплового эффекта:
килоджоуль со знаком + и -
904.Эндотермическая реакция:
N2+O2→
905.При взаимодействии7 г. железа с серой выделилось 12,15 кДж. Термохимическое уравнение реакций:
Fe+S→FeS+97,2 кДж
906.Сколько теплоты выделится при сжигании серы массой 1 г. зная, что теплота образования оксида серы (IV) из кислорода и серы равна 297 кДж/моль:
9,3 кДж
907.При взаимодействии железа массой 2,1 г с серой выделилось 3,58 кДж теплоты. Теплота образования сульфида железа (II)равна:
95,46 кДж
908.Термохимическое уравнение 2HgO=2Hg+O2-180 кДж означает:
полученные O2 и Hg богаче энергией
909.Эндотермическая реакция:
N2+O2→
910.Термохимическое уравнение:
Fe+S→FeS+97, 2 кДж
911.Термохимическое уравнение реакции горения углерода C+O2=CO2+402,24 кДж. Масса сгоревшего углерода в граммах, если при реакций выделилось 167600 кДж теплоты:
5000
912.При горении угля выделилось 3352 кДж энергии. Масса сгоревшего угля:
100
913.Термохимическое уравнение 2H2O↔2H2↑+O2↑-572 кДж. Количество теплоты, которое выделится при сгорании10 моль водорода:
2860
914.Термохимическое уравнение разложения воды 2H2O↔2H2↑+O2↑-572 кДж. Энергия, необходимая для разложения 360 г. воды:
5720
915.Для образования 22,4 л. оксида азота (II) требуется 21,5 кДж энергии. Количество теплоты для образования 500 л. оксида азота (II):
479,91
916.По термохимическому уравнению реакций 3Fe3O4+8Al=4Al2O3+9Fe+3300 кДж рассчитать количество теплоты, выделившейся при получении 2,12 кг железа:
13880,95
917.При взаимодействии алюминия массой 9 г. с кислородом выделилось 274,44 кДж теплоты. Теплота образования оксида алюминия:
1646,67
918.Гомогенная система
чистый воздух
919.Скорость гетерогенной реакции:
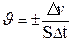
920.Явление увеличения скорости реакции в присутствии катализатора
катализ
921.Крупнейший ученый, академик АН Каз. ССР в области гетерогенного катализа:
Сокольский Д.В.
922.Вещества, усиливающие действие катализаторов
промоторы
923.Гетерогенная реакция
2KCIO3  2KCI+3O2
2KCI+3O2
924.Гетерогенная реакция
CO2+C→2CO
925.Гомогенная реакция
N2+O2  2NO
2NO
926.Кинетическое уравнение реакции А(г)+2В(г)=Д:
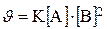
927.Кинетическое уравнение реакции 2Fe+3CI2=2FeCI3:
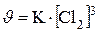
928.При увеличении концентрации А в реакции 2 раза и снижении концентрации В в 2 раза, скорость снижается в 2 раза:
А+2В→АВ2
929.Для увеличения скорости неоратимой реакцииCO(г)+2H2(г)→CH3OH(г)+Q необходимо
повысить температуру
930.С наибольшей скоростью при комнатной температуре протекает взаимодействие между
Mg и HCI
931.При повышении температуры от 10º до 50º С, (температурный коэффициент равнен 3), скорость реакции
увеличится в 81 раз
932.При понижении температуры от 10º до 0º С, (температурный коэффициент равнен 3) , скорость реакции
уменьшится в 3 раза
933.Если концентрацию вещества А увеличить в 3 раза в реакции с кинетическим уравнением 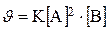 , то скорость реакции:
, то скорость реакции:
увеличится в 9 раз
934.Если концентрацию вещества В увеличить в 3 раза в реакции с кинетическим уравнением 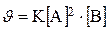 , то скорость реакции:
, то скорость реакции:
увеличится в 3 раза
935.Если концентрацию вещества А увеличить в 3 раза , концентрацию В уменьшить в 3 раза в реакции с кинетическим уравнением 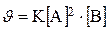 , то скорость реакции:
, то скорость реакции:
увеличится в 3 раза
936.Скорость реакции между газами А и В при уменьшении давления в 2 раза, если кинетическое уравнение 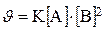 :
:
уменьшится в 8 раз
937.Химические реакции, в результате которых вещества полностью превращаются в продукты реакции:
необратимые
938.Общий вид уравнения системы в состоянии равновесия:
А+В↔С+Д
939.Необратимая реакция:
2KCIO3=2KCI+3O2 ↑
940.Обратимая реакция:
2SO2+O2=2SO3
941.Константа равновесия не показывает:
во сколько раз обратная реакция протекает быстрее, чем прямая
942.Фактор, не влияющий на смещение равновесия:
катализатор
943.Закон, выражающий зависимость скорости от концентрации реагирующих веществ:
Закон действующих масс
944.Формула, которая соответствует математическому выражению закона действующих масс:
U=k [A]m [B]n
945.Необратимые реакции:
все перечисленное
946.Равновесие реакций SO2+O2↔2SO3+Q сместится влево (←) при:
понижении давления
947.Равновесие реакции 3Fe2O3(т)+CO(г)↔2Fe3O4(т)+CO2(г)-Q сместится вправо(→) при:
повышении температуры
948.Реакция, в которой повышение давления не вызовет смещения равновесия:
H2 (г) +CI2 (г) ↔2HCI (г)
949.Химическое равновесие реакции CH4(г)+CO2(г)↔2CO(г)+2H2(г)-Q сместится в сторону продуктов реакции при:
повышении температуры
950.Реакция, при которой повышение давления смещает равновесие вправо(→):
4FeS2(т)+11O2↔2Fe2O3(т)+8SO2(г)
951.Равновесие реакции CO(г)+H2O(г)↔CO2(г)+H2(г)+Q сместится вправо (→) при:
понижении температуры
952.В уравнении реакции N2+3H2↔2NH3 равновесие установилось при [N2]=1,3 моль/л,[H2]=1,4 моль/л,[NH3]=1,8 моль/л. Константа равновесия этой реакции:
0, 9
953.В уравнении реакции N2+3H2↔2NH3 равновесие установилось при [N2]=3,1 моль/л,[H2]=2,5 моль/л,[NH3]=4,6 моль/л. Исходные концентрации [N2] и [H2]:
5,4 и 9,4
954.В уравнении реакции 2SO2+O2↔2SO3 равновесие установилось при [SO2]=2,2 моль/л,[O2]=1,8 моль/л,[SO3]=3,2 моль/л. Исходные концентрации [SO2] и [O2]:
5, 4 и 3, 4
955.В уравнении реакции H2+J2=2HJ равновесие установилось при следующих концентрациях [H2]=3,8;[J2]=2,1;[HJ]=4,0. Константа равновесия этой реакций:
2
956.В реакции CO+H2=CO+H2O установилось равновесие с концентрациями веществ [CO2]=0,5моль/л;[H2]=0,3 моль/л;[CО]=0,6моль/л [H2O]=0,4 моль/л. Установите К равновесия до и после добавления водорода в количестве 1 моль/л.:
1, 6; 0,275
957.В уравнении реакции C2H4+H2=C2H6 равновесие установилось при концентрациях[C2H4]=1,8 моль/л; [H2]=0,75 моль/л; [C2H6]=3,5 моль/л. Константа равновесия и исходные концентрации [C2H4] и [H2]:
2, 6; 5, 3; 4, 25
958.В уравнении реакции 2NO+O2=2NO2 равновесие установилось при концентрациях[NO]=3,6 моль/л; [O2]=2,5 моль/л; [NO2]=4,8 моль/л. Константа равновесия и исходные концентрации [NO] и [O2]:
0,71; 8,4; 4,9
959.При синтезе аммиака равновесие установилось при концентрации [N2]=1,1 моль/л,[H2]=2,3 моль/л,[NH3]=4,5 моль/л. Константа равновесия и исходные концентрации азота и водорода:
1,51;3,35; 9,05
960.Реакция протекает в растворе по уравнению А+В=3С, исходная концентрация [А]=0,6 моль/л, [В]=1,2 моль/л, Кравн.=10. Равновесные концентрации [А], [В], [С] равны:
0,19; 0,79; 1,23
961.Реакция протекает в растворе по уравнению А+В=2С, исходная концентрация [А]=0,5 моль/л, [В]=0,7 моль/л, Кравн.=50. Равновесные концентрации [А], [В], [С] равны:
0,06; 0,26; 0,88
962.Неэлектролитами являются пара веществ
метанол и этиленгликоль
963.Электролит
ацетат натрия
964.Электролиты в паре
хлорид натрия (р-р) и бромид калия
965.Электролиты в паре
уксусной кислоты и хлорида натрия
966.Неэлектролиты
водный раствор сахарозы
967.Слабый электролит
угольная кислота
968.Все электролиты в группе
растворы гидроксида натрия, ацетата натрия и соляная кислота
969.Два иона образуется при диссоциации
NaOH→Na++OH‾
970.Все неэлектролиты в группе
сахароза, глицерин, оксид серы (IV)
971.В уравнении реакции оксида алюминия с серной кислотой сумма коэффициентов перед формулами сильных электролитов
4
973.Щелочная среда в растворе
Na2CO3
974.Вещества, необходимые для осуществления процесса Cr3++3OH‾→Cr(OH)3:
CrCI3 ;NaOH
975.При сливании растворов нитрата серебра и хлорида калия в реакции взаимодействуют ионы AgNO3 к раствору KCI:
Ag+ и CI‾
976.Диссоцирует только по типу основания:
Ca(OH)2
977.В уравнении реакции Na2SiO3 с HCI сумма коэффициентов перед формулами сильных электролитов
5
978.Кислая среда в растворе
AI2(SO4)3
979.Число анионов, полученных при диссоциации 50 молекул сульфата алюминия, если степень диссоциации соли 80%:
120
980.Может диссоцировать по типу кислоты
AI(OH)3
981.Число всех ионов, полученных при полной диссоциации 100 молекул гидросульфата калия, если степень диссоциации 70%:
210
982.Число всех ионов, полученных при диссоциации 100 молекул серной кислоты, если степень диссоциации кислоты 98%:
294
983.Число всех катионов, полученных при диссоциации 100 молекул сульфата натрия, если степень диссоциации соли 90%:
180
984.В растворе объемом 1 л, содержащем 0,1 моль хлорида железа (III), суммарное число молей ионов Fe3+ и CI‾:
0,4
985.В растворе объемом 1 л, содержащем 0,15 моль нитрата магния, суммарное число молей ионов Mg2+ и NO3‾:
0,45
986.Число молей ионов натрия, образующегося при полной диссоциации одного моля фосфата натрия:
3
987.Качественная реакция на сульфат-анион взаимодействует с
хлоридом бария
988.Протекает до конца рекция
MgSO4+Ba(NO3)2 →
989.С выделением газа реагируют между собой вещества
Na2CO3 +HCI→
990.Цвет лакмуса в растворе хлорида алюминия
красный
991.Реагируют между собой с образованием осадка вещества
FeCI3 и AgNO3
992.Реакции в растворах электролитов не протекают до конца, если
образуются растворимые вещества
993.Реактив на хлорид-ионы
катионы серебра
994.Сумма всех коэффициентов в полном и сокращенном ионных уравнениях реакции между уксусной кислотой и гидроксидом бария
12 и 6
995.Сумма всех коэффициентов в полном и сокращенном ионных уравнениях реакции между уксусной кислотой и гидроксидом лития
7 и 3
996.Сумма всех коэффициентов в полном ионном уравнении реакции между растворами гидроксида бария и сульфата меди(II):
7
997.Сумма всех коэффициентов в сокращенном ионном уравнении реакции между растворами гидроксида бария и сульфата натрия
3
998.Сокращенное ионное уравнение реакции Cu2++2OH‾=Cu(OH)2 ↓ соответствует взаимодействию
CuCI2 (р-р) и NaOH (р-р)
999.По схеме Rn-+HOH↔ HR(n-1)‾+OH‾ идет гидролиз вещества
Na2S
1000.По схеме Rn++HOH↔ ROH(n-1)++H+ идет гидролиз вещества
AlCI3
1001.Не протекает реакция между ионами
3K+ и PO43‾
1002.Протекает реакция между ионами
Fe3+ и 3OH‾
1003.Сокращенное ионное уравнение Al3++3OH‾=Al(OH)3↓ соответствует взаимодействию
Al(NO3)3 и 3NaOH
1004.При взаимодействии 80 г гидроксида натрия и 21 г азотной кислоты образуется вода массой
6
1005.При сливании растворов, содержащих 159 г карбоната натрия и 73 г соляной кислоты, образуется углекислый газ объемом (в л) (н.у.):
22,4
1006.При сливании растворов, содержащих 276 г карбоната калия и 73 г соляной кислоты, образуется углекислый газ объемом (в л) (н.у.):
22,4
1007.При взаимодействии 40 г гидроксида натрия и 75 г азотной кислоты образуется вода массой (в г):
18
1008.При сливании растворов, содержащих 1,6 г сульфата меди (II) и 30 г гидроксида калия, образуется осадок массой (в г):
0,98
1009.При сливании растворов, содержащих 14,2 г сульфата натрия и 50 г нитрата бария, образуется осадок массой (в г):
23,3
1010.Соль хлорноватой кислоты HCIO3:
хлорат
1011.Соль хлорноватистой кислоты:
NaCIO
1012.Электронная формула атома брома
4s²4p5
1013.Реактив для обнаружения иона хлора CI‾:
AgNO3
1014.Жидкий галоген:
Br2
1015.Наиболее сильный окислитель:
F2
1016.Степень окисления хлора в бертолетовой соли:
+5
1017.Галоген, проявляющий наибольшее значение элекроотрицательности:
F
1018.Черно-синий кристаллический галоген:
I2
1019.Степень окисления хлора в хлорной кислоте HCIO4:
+7
1020.Образование бертолетовой соли:
3CI2+6KOH=KCIO3+5KCI+3H2O
1021.Усиление кислотных свойств в ряду:
HCIO; HCIO2; HCIO3; HCIO4;
1022.Усиление окислительных свойств в ряду:
HCIO4; HCIO3; HCIO2; HCIO;
1023.Сумма коэффициентов в уравнении реакции KBr+CI2→KCI+Br2:
6
1024.Галоген, способный возгоняться:
I2
1025.Коэффициент перед MnCI2 в уравнении MnO2+HCI→CI2+MnCI2+H2O:
1
1026.Бром и хлор отличаются друг от друга:
химической активностью
1027.В лаборатории хлор обычно получают окислением:
HCI
1028.Объем хлора и водорода (н.у.), (м3), необходимые для получения 30 м³ хлороводорода:
15; 15
1029.Объем кислорода и воздуха (объемная доля кислорода 21%), необходимый для сжигания 134,4 л оксида углерода (II):
67,2; 320
1030.Объем хлороводорода, образовавшегося при взаимодействии 3л. водорода с хлором (н.у.):
6л.








