410.Электронная формула иона хлора
1s2 2s2 2p6 3s2 3p6
411.Наибольший атомный радиус у элемента с электронной формулой
1s2 2s1
412.Наименьший атомный радиус у элемента с электронной формулой
1s2 2s2 2p5
413.Гидроксиды металлов, которым соответствуют электронные формулы: а) 1s2 2s2 2p6 3s2 , б) 1s2 2s2 2p6 3s2 3p6 3d6 4s2
Mg (OH)2, Fe (OH)2
414.Электронная формула, соответствующая строению иона алюминия Al3+-:
1s2 2s2 2p6
415.Свойства, которые Д. И. Менделеев положил в основу классификации химических элементов:
атомную массу и валентность
416.В ряду элементов Na, Mg, Al, Si, P, S, Cl возрастают:
неметаллические свойства
417.Если формула высшего оксида RO3, то формула летучего водородного соединения:
H2R
418.Порядковый номер элемента, находящегося в четвертом периоде, в пятой группе, главной подгруппе:
33
419.Большие периоды от малых отличает:
наличие d- и f- элементов
420.Наиболее выраженными кислотными свойствами обладает оксид:
СO2
421.Свойства элементов в периоде изменяются с увеличением порядкового номера:
металлические уменьшаются, неметаллические усиливаются
422.Элемент подгруппы алюминия:
In
423.Высшие оксиды элементов с конфигурациями …2s2 2p2 и …3s1 различаются по молекулярной массе на:
18
424.Радиусы атомов в ряду O-S-Se-Te:
возрастают
425.В формуле высшего оксида азота сумма индексов элементов:
7
426.Неметаллические свойства усиливаются в ряду:
Si – P – S – Cl
427.Основные свойства гидроксидов в ряду
Be(OH)2 – Mg(OH)2 – Ca(OH)2 – Sr(OH)2 – Ba(OH)2
усиливаются
428.Группы амфотерных гидроксидов:
Al(OH)3, Zn(OH)2, Pb(OH)2
429.Радиусы атомов элементов в малых периодах слева направо:
уменьшаются
430.Порядковый номер элемента в периодической системе, если электронная формула его атома 1s22s22p63s23p5:
17
431.Общая формула электронной конфигурации атомов элементов VI группы главной подгруппы периодической системы:
ns2 np4
432.В ряду N – P – As – Sb – Bi :
электроотрицательность уменьшается
433.Гидроксиды элементов Na, Al, Si проявляют свойства:
щелочей, амфотерных гидроксидов, кислот
434.Степень окисления в высших оксидах p-элементов в пределах периода:
возрастает
435.Степень окисления p-элементов в летучих водородных соединениях в пределах периода:
уменьшается
436.Важнейшие характеристики химической связи:
длина, энергия, направленность
437.Низшая степень окисления «-4» характерна для
углерода
438.Наиболее полярная связь в молекуле
HF
439.Возможные степени окисления фтора:
0; -1
440.Ионную связь образуют
сера и магний
441.В молекуле NaCl химическая связь
ионная
442.Соединения с ковалентной полярной связью в группе:
H2S, HCl
443.Тип химической связи в молекуле хлора Cl2
ковалентная неполярная
444.Электроотрицательность возрастает (слева направо) в ряду
N, O, F
445.Степень окисления серы в серной кислоте
+6
446.Химическая связь в молекуле озона
ковалентная неполярная
447.Химическая связь в NaClO4
ковалентная полярная и ионная
448.Тип кристаллической решетки ромбической серы
молекулярная
449.Соединение брома с наименьшей степенью окисления
HBr
450.В образовании металлической связи не принимают участие
анионы
451.Наиболее полярная связь в молекуле
HF
452.Число электронов, участвующих в образовании химической связи в молекуле N2
6
453.Ковалентная полярная связь образован по донорно-акцепторному механизму в молекуле
NH4Cl
454.Электронная конфигурация наружного слоя элемента ns2np5. Тип химической связи в простом веществе, образуемом этим элементом:
ковалентная неполярная
455.Тип гибридизации электронных орбиталей атома берилия в молекуле BeCl2:
sp
456.Вещества с водородной связью
HF, H2O
457.Угловую форму имеет молекула
H2O
458.Коэффициент перед формулой окислителя в уравнении реакции образования сернистого газа при горении серы:
1
459.Сера восстановитель в реакции
 S + O2
S + O2
460.Степень окисления серы в Са(HSO4)2:
+6
461.Процессу окисления соответствует превращение
 Fe2+ Fe3+
Fe2+ Fe3+
462.Не может быть восстановителем
F
463.Сумма всех коэффициентов в уравнении реакции H2S + O2 = S + H2O
7
464.Коэффициент перед формулой востановителя в уравнении реакции
Cr(OH)2 + O2 + H2O = Cr(OH)3
4
465.В переходе S  Na2SO4 степень окисления серы и её изменение
Na2SO4 степень окисления серы и её изменение
0, повышение
466.Число принятых окислителем электронов в схеме KClO3  KCl
KCl
6
467.Число отданных восстановителем электронов в схеме FeO+Mg  MgO+Fe
MgO+Fe
2
468.Окислительно-восстановительную двойственность проявляют вещества группы
H2SO3, HNO2
469.Сумма всех коэффициентов в реакции
Cr(OH)2 + O2 + H2O 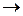 Cr(OH)3:
Cr(OH)3:
11
470.Только восстановительные свойства проявляет
HJ
471.Только окислительные свойства проявляет
CrO3
472.Коэффициент перед формулой оксида серы (IV) в схеме реакции KMnO4 + H2O + SO2 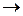 MnSO4 + H2SO4 + K2SO4
MnSO4 + H2SO4 + K2SO4
5
473.Если в рекцию C + HNO3 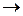 CO2 + NO + H2O вступают 6 моль восстановителя, то масса окислителя (в г)
CO2 + NO + H2O вступают 6 моль восстановителя, то масса окислителя (в г)
504
474.Количество моль окислителя, необходимого для получения 8 г серы по схеме FeCl3 + H2S 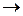 FeCl2 + HCl + S
FeCl2 + HCl + S
0,5 моль
475.Масса окислителя, взаимодействующего с 2 моль восстановителя по схеме
HCl + O2 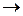 H2O + Cl2
H2O + Cl2
16 г
476.Схема реакции: CuS + HNO3 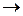 Cu(NO3)2 + H2SO4 + NO + H2O, число молей восстановителя
Cu(NO3)2 + H2SO4 + NO + H2O, число молей восстановителя
3
477.Схема реакции: CuS + HNO3 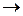 Cu(NO3)2 + H2SO4 + NO + H2O, число молей окислителя
Cu(NO3)2 + H2SO4 + NO + H2O, число молей окислителя
14
478.Сумма всех коэффициентов в окислительно-восстановительном процессе
Al + NaOH + H2O 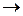 NaAlO2 + H2
NaAlO2 + H2
11
479.Кислороду не соответствует свойство:
легче воздуха
480.Тлеющей лучинкой можно отличить от других газов
кислород
481.Два разных оксида образует с кислородом элемент:
углерод
482.Формула аллотропного видоизменения кислорода:
О3
483.Кислород выделяется при термическом разложении соли:
KClO3
484.Масса кислорода объемом 22,4 л (н.у.):
32 г
485.В промышленности кислород получают:
перегонкой воздуха
486.Роль озонового слоя Земли заключается в:
защите всего живого на Земле от губительного излучения Солнца
487.Превращение кислорода в озон выражается уравнением:
 3О2 электрический разряд 2О3
3О2 электрический разряд 2О3
488.Кислороду не соответствует свойство:
электропроводен
489.Три атома кислорода содержит в своем составе:
азотная кислота
490.Взаимодействие металла с кислородом приводит к образованию
основного оксида
491.Самым распространенным элементом на Земле является
сера
492.Массовая доля кислорода в молекуле воды:
88,89%
493.Массовая доля кислорода наименьшая:
PbO
494.В природе кислород образуется в результате реакции:
фотосинтеза
495.Кислород не используется
для заполнения воздушных шаров
496.Сумма всех коэффициентов в уравнении горения пропана С3Н8:
13
497.Для сжигания кремния количеством вещества 0,5 моль потребуется кислород объемом (н.у.):
11,2 л
498.Массовые доли железа и кислорода в минерале Fe3O4:
72,4% и 27,6%
490.Относительная плотность кислорода по азоту:
1,14
499.Количество моль озона, составляющих 24 г данного вещества:
0,5








