327.Веществом X4 в схеме превращений является
+Br2 +H2O +[O] +Ag2O
C2H6 ¾¾®X1 ¾¾® X2 ¾¾® X3 ¾¾® X4 является:
(NaOH)
Уксусная кислота.
328.В схеме превращений вещества X и Y
O

 +X +Y
+X +Y
CH3 – C ¾¾® CH3COOH ¾¾® CH2Cl – COOH

H
X – [O]; Y – Cl2.
329.В схеме превращений вещества X и Y
O

 +X +Y
+X +Y
CH3 – C ¾¾® CH3COOH ¾¾® CH3COOCH2CH3
 |
H
X – [O]; Y – C2H5OH.
330.Молекулярная формула органического вещества, содержащего 52,17% углерода, 13,04% водорода, 34,78% кислорода, имеющего плотность паров по водороду 23
C2H6O.

A – этилен; хлорэтан.
332.Вещество X в схеме превращений этан ¾® хлорэтан ¾® этанол ¾® X
¾® уксусная кислота
Уксусный альдегид.
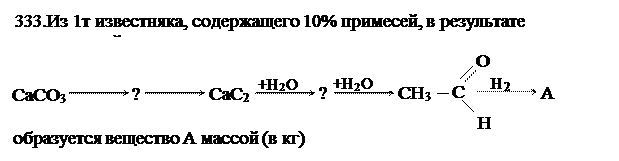
C2H5OH, 414 кг.
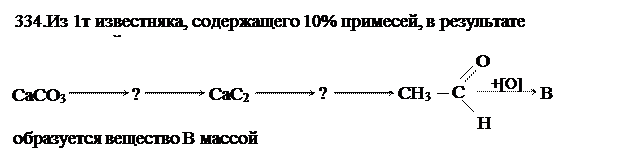
CH3COOH, 540 кг.
335.Карбоновые кислоты вступают в реакцию с веществами: 1) CH3OH; 2) Mg;
3) NaOH; 4) Ag; 5) Cu(OH)2:
1, 2, 3, 5
336.Вещество A, в результате превращений
брожение +HCl
(C6H10O5)n ¾¾® C6H12O6 ¾¾® X1 ¾¾® A.
Хлорэтан.
337.Вещество A, в результате превращений
+O2,
фотосинтез брожение катализатор +Cl2
CO2 + H2O ¾¾® X1 ¾¾® X2 ¾¾® X3 ¾¾®A
Монохлоруксусная кислота.
338.Вещество A в процессе превращений
+Br2 +H2O +O +Ag2O
CH3 – CH3 ¾¾® X1 ¾¾® X2 ¾¾® X3 ¾¾® A.
Карбоновая кислота
339.Если при взаимодействии 120г 20%- ного раствора уксусной кислоты с
метанолом образовался сложный эфир, то масса спирта, вступившего в
реакцию
12,8 г.
340.Фенол полученный 39г бензола, вступил в реакцию с 40% - ным раствором
гидроксида натрия, массой
50 г.
341.Для образования 9,2 г муравьиной кислоты необходим природный газ (80%
метана) объемом (в литрах, н.у.):
5,6 л.
342. Масса продукта, полученная в результате взаимодействия на свету 117г бензола и
112 (н.у.) хлора.
436,5 г.
343.Масса продукта, полученная взаимодействием 0,2 моль толуола и 50г 94,6% -ной
азотной кислоты.
45,4 г.
344.При реакции разложения:
из одного вещества образуется несколько других веществ
345.Тип реакции Fe + CuCl2 = FeCl2 + Cu:
замещения
346.В реакции обмена не могут участвовать вещества
простые
347.Тип реакции HNO3 + KOH = KNO3 + H2O
обмена
348.Реакция нейтрализации
HCl + NaOH =
349.Тип реакции, протекающей между железными опилками и раствором сульфата меди (II)
замещение
350.Реакция замещения произойдет между
Mg, Pb(NO3)2
351.К реакции обмена относится взаимодействие
оксида кальция и соляной кислоты
352.Тип реакции взаимодействия Fe3O4 с Al
замещением
353.Реакция замещения обязательно будет
окислительно-восстановительной
354.Взаимодействие Н2О с К2О относится к реакции
соединения
355.Тип реакции взаимодействия аммиака с кислотой
соединения
356.Химическая реакция
горение полиэтилена
 357.Тип реакции CO2
357.Тип реакции CO2
K2CO3 +2HCl = 2KCl + H2CO3
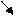 H2O
H2O
обмена
358.В раствор хлорида ртути (II) помещают медную монету. Тип реакции
замещения
359.Тип реакции взаимодействия соляной кислоты с сульфидом железа (II)
обмена
360.Реакция замещения
Zn + H2SO4 +
361.Для полной нейтрализации раствора, содержащего 14 г гидроксида калия, необходим оксид серы ( IV ) объемом (н.у.) :
2,8 л
362.Сумма всех коэффициентов в уравнении реакции разложения малахита (CuOH)2CO3:
5
363.Сумма коэффициентов продуктов реакции обмена между фосфорной кислотой и гидроксидом магния:
7
364.Масса оксида кальция, необходимая для получения 62 г фосфата кальция, путем реакции обмена с фосфорной кислотой
33,6 г
 365.По схеме реакции C + HNO3(разб.) CO2 + NO + H2O масса углерода, реагирующего с 8 моль азотной кислоты
365.По схеме реакции C + HNO3(разб.) CO2 + NO + H2O масса углерода, реагирующего с 8 моль азотной кислоты
72 г
366.Относительная молекулярная масса продукта реакции соединения оксида фосфора ( V ) с избытком оксида натрия:
164
367.Массовая доля кислорода в карбонате кальция CaCO3 :
48%
368.Наибольшая относительная атомная масса у:
железа
369.Реакция соединения:
Fe + S = FeS
370.Не является химической реакции:
изменение агрегатного состояния
371.Валентность алюминия в соединении Al2O3:
3
372.Чистое вещество:
дистиллированная вода
373.Сложное вещество:
вода
374.Закон, на основе которого составляют уравнения химической реакции
(Ломоносов М., 1748г.):
закон сохранения массы вещества
375.Массовые доли железа и кислорода в минерале Fe3 O4:
72,4% и 27,6%
376.Количество вещества хлорида алюминия AlCl3, получающееся из 10,2 г оксида алюминия при взаимодействии с соляной кислотой НCl:
0,2 моль
377.Масса 8 моль хлорида алюминия:
1068
378.Масса водорода, которая выделяется при взаимодействии 0,8г кальция с водой
0,04 г
379.Формула оксида серы, если относительная плотность его по водороду 32
SO2
380.Количество вещества кислорода, необходимого для взаимодействия с 6 г магния
0,125 моль








