47. При растворении 30г соли в 170г воды получили раствор с массовой долей соли
1. Реакция замещения:
Zn + 2HCl 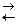 ZnCl2 + H2 ↑
ZnCl2 + H2 ↑
2. В уравнении реакции, схема которой P + O2 → P2O5, коэффициент перед формулой восстановителя
4
3. В уравнении реакции, схема которой Fe + Cl2 → FeCl3, коэффициент перед формулой окислителя
3
4. Тип реакции взаимодействия оксида магния с соляной кислотой
Обмена
5. Тип реакции взаимодействия оксида железа (II) с соляной кислотой
Обмена
6. Реакция разложения
2KClO3 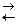 2KCl + 3O2↑
2KCl + 3O2↑
7. Реакция соединения:
2Mg + Si → Mg2Si
8. Реакция обмена:
Na2CO3 + 2 HCl 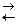 2NaCl + H2O + CO2↑
2NaCl + H2O + CO2↑
9. Сумма коэффициентов в схеме реакции
CuO + Al → Al2O3 + Cu
9
10. В реакциях соединения образуется:
Одно сложное вещество
11. При сгорании 6г магния образуется оксид магния массой
10 г
12. Масса железа, необходимая для получения 32,5 г. хлорида железа (III)
11,2 г
13. Сумма коэффициентов в схеме реакции
(NH4)2Cr2O7 → N2 + H2O + Cr2O3
7
14. Сумма коэффициентов в окислительно – восстановительной реакции
KI + KIO3 +H2SO4 → I2 + K2SO4 + H2O
18
15. При взаимодействии 32 г меди с кислородом выделилось 155 кДж теплоты. Тепловой эффект реакции
620 кДж
16. Сумма коэффициентов в окислительно – восстановительной реакции
H2S + H2SO4 → S + H2O
12
17. Для получения 20 г оксида меди (II) потребуется медь количеством вещества
0,25 моль
18. Необратимо протекает реакция в водном растворе
Сульфата алюминия и хлорида бария
19. Реакция протекает в растворе до конца с выделением газа при смешивании
Карбоната кальция и соляной кислоты
20. Коэффициент перед формулой восстановителя в уравнении, схема которого
Cu + HNO3 → NO + Cu(NO3)2 + H2О
3
21. Масса железа,полученного при взаимодействии Fe3O4 с 5,6 л (н.у.) водорода
10,5 г
22. При разложении 31,6 г перманганата калия получили кислород объемом (н.у.)
2,24 л
23. К раствору, содержащему 18,8 г нитрат меди (II) добавили 30 г железных опилок. Масса полученной меди
6,4 г
24. Масса осадка, полученного взаимодействием 40г 10% раствора серной кислоты с 2,61г нитрата бария
2,33 г
25. К раствору содержащему 16 г сульфата меди (II), прибавили 12 г железных опилок. Масса полученной меди
6,4 г
26. При полном сгорании неизвестного вещества массой 0,34г образовалось 0,64г оксида серы (IV) и 0,18г воды. Формула этого соединения:
H2S
27. Масса 9,03·1023 атомов магния
36г.
28. Количество вещества 9,03·1023 атомов магния
1,5 моль.
29. Масса 1,5 моль оксида ртути (I)
627г.
30. Число молекул в 3 молях хлороводорода
18,06·1023
31. Химическое явление:
Скисание молока.
32. Признак протекания химической реакции
Образование осадка.
33. Вещество:
Медь
34. Физическое явление
Таяние льда
35. Простое вещество:
Кислород.
36. Сложное вещество:
Вода
37. Наибольшая относительная атомная масса у:
Хлора.
38. Наибольшая относительная молекулярная масса у:
HCl
39. Валентность фосфора в P2O5:
V.
40. Масса 0,2 моль сульфата железа (III):
80г.
41. Наивысшая валентность хлора в:
HClO4.
42. Количество вещества в 40г карбоната кальция
0,4 моль.
43. Массовая доля кислорода в оксиде ЭО2 равна 53,3%. Этот элемент
Si
44. Число молекул в 4г газа кислорода
0,75·1023
45. Относительная молекулярная масса сахарозы 342, а массовая доля углерода 42,1 % . Число атомов углерода в молекуле
12.
46. Массы воды и соли, которые потребуются для приготовления 200г 5%-ного раствора соли
190г и 10г
47. При растворении 30г соли в 170г воды получили раствор с массовой долей соли
15%
48. В 327г воды растворили 44,8л (н.у.) хлороводорода, массовая доля хлороводорода в полученном растворе соляной кислоты
18,25%
49. Кристаллические вещества, содержащие молекулы воды, называют:
Кристаллогидратами
50. В результате электролиза водного раствора хлорида меди получают
Хлор, медь
51. При электролизе водного раствора сульфата натрия получают
Водород, кислород
52. Чтобы получить 5%-ный раствор нужно растворить соль в 190г воды массой:
10г
53. Чтобы получить 20%-ный раствор, нужно добавить к 5г 50%-ного
раствора воду массой
7,5г
54. При реакции нейтрализации 200г 9,8%-ного раствора серной кислоты и 400г 7%-ного раствора гидроксида калия получили соль массой
34,85г
55. К 40г 5% раствора соли добавили 5г соли. Массовая доля соли в полученном растворе
15,5%
56. Массовая доля соли в растворе, полученном при сливании 100г 5% раствора с 300г 15% раствора
12,5%
57. К 300г 5 % раствора гидроксида калия добавили 20г гидроксида калия. Массовая доля щелочи в полученном растворе
10,9%
58. Массовая доля вещества в растворе, полученном сливанием 100мл 20%-ного раствора гидроксида натрия (p=1,2г/мл) и 100мл 40%-ного раствора гидроксида натрия (р=1,5г/мл)
31,1%
59. Массовые отношения элементов в молекуле воды
1:8
60. С водой при комнатной температуре реагируют
Барий и оксид кальция
61. При комнатной температуре с водой не реагируют
Медь и оксид меди.
62. При комнатной температуре вода реагирует с
Натрием.
63. Гидриды щелочных металлов взаимодействуют с водой с образованием
Щелочи и водорода.
64. При сгорании 80 г водорода образуется вода массой:
720 г
65. Масса воды, полученной при сжигании 10г водорода в кислороде
90 г.
66. Гидролиз-это
реакция взаимодействия ионов соли с водой
67. Метиловый, оранжевый в растворе карбоната натрия окрасится в
Желтый цвет.
68. Лакмус в растворе сульфата аммония окрасится в
Красный цвет.
69. Фенолфталеин в растворе нитрата калия будет
Бесцветным.
70. Вода может вступать в реакцию замещения с
Кальцием.
71. 2 г водорода из воды вытеснит кальций массой
40 г.
72. При взаимодействии с водой 2,1 г гидрида кальция выделится водород объемом (н.у.)
2,24 л.
73. Только при повышенной температуре с водой взаимодействует металл:
Железо.
74. При комнатной температуре с водой взаимодействует металл
Натрий.
75. Не взаимодействует с водой металл
Платина.
76. Массовая доля серной кислоты в растворе, полученном при сливании 400мл (ρ= 1,1г/мл) 15% раствора с 60г серной кислоты
13,2%.
77. При действии воды на гидрид металла со степенью окисления +2 и массой 0,84 г выделился водород объемом 896 мл (при н.у.). Этотм металл
Кальций.
78. При взаимодействии 3,425 г щелочноземельного металла с водой выделился водород объемом 560 мл (н.у.). Этот металл
Барий.
79. Массовая доля воды в кристаллогидрате Na2Co3 ∙ nН2O составляет 62,94%. Число n равно
10.
80. Массовая доля H2CrO4, полученная растворением 50г оксида хрома (VI) в 186г воды.
25%
81. При реакции с водой 15,6 г одновалентного металла, выделяется 4,48 г газа (н.у.). Этот металл
Калий.
82. Формула соли:
KCl
83. Формула средней соли:
Na2SeO4
84. Формула кислой соляи:
KHCO3
85. Формула основной соли:
BaOHCl
86. Формула двойной соли:
KNaSO4
87. Возможна реакция:
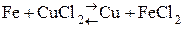
88. Практически осуществима реакция
CaCl2+Na2CO3 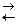 CaCO3↓+2NaCl
CaCO3↓+2NaCl
89. Качественный состав хлорида алюминия можно установить, используя растворы, содержащие ионы:
OH- и Ag+
90. Качественный состав хлорида бария можно установить, используя растворы, содержащие ионы
SO24- и Ag+
91. Сульфат- и хлорид- ионы можно распознать соответственно:
Ba2+ и Ag+
92. Сульфат - ионы можно обнаружить при помощи катиона
Ba2+
93. Фосфат - ионы можно обнаружить при помощи катиона:
Ag+
94. Йодид - ионы можно обнаружить при помощи катиона
Ag+
95. Сульфат бария можно получить при взаимодействии
Серной кислоты с хлоридом бария
96. Карбонат – ионы можно обнаружить водным раствором
Хлороводорода
97. При взаимодействии растворов, содержащих 31,7г CrCl3 и 16,8 KOH образуется осадок массой
10,3г.
98. Масса кислой соли, полученной взаимодействием 200г 9,8% - ного раствора серной кислоты с 50г 12% раствора гидроксида натрия
18г.
99. Масса соли (выход 90%), которая получается взаимодействием гидроксида натрия с 252г азотной кислоты
306г.
100. При разложении 107г хлорида аммония получено 33,6л аммиака (н.у.). Объемная доля выхода аммиака
75%
101. При нагревании 21,4г. хлорида аммония с 8 г гидроксида натрия выделился аммиак объемом (н.у.):
4,48л
102. Масса карбида кальция (выход 50%), если при взаимодействии 11,2г оксида кальция с 36г углерода образуется карбид кальция и угарный газ.
6,4 г
103. Масса сульфата меди (II), которую необходимо добавить к 270г воды для получения 10% раствора
30г.
104. Валентность кислотного остатка равна I в кислоте
HNO3
105. Водород из соляной кислоты не вытеснит металл:
Cu
106. Невозможна химическая реакция
Cu + H2SO4 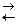 CuSO4 + H2 ↑
CuSO4 + H2 ↑
107. Серная кислота взаимодействует с оксидом
CaO
108. Кислоту получают
SO3 + H2O →
109. Серную кислоту получают
Кислотный оксид + вода
110. Сероводородная кислота образуется в реакции:
Na2S + HCl →
111. Разбавленная серная кислота не может реагировать ни с одним веществом группы
Серебро, медь, оксид кремния (IV)
112. Концентрированную H2SO4 перевозят в стальных цистернах, так как:
Чистая кислота с железом не реагирует
113. При взаимодействии разбавленной HNO3 с двумя различными металлами получены соответственно оксид азота (II) и нитрат аммония. Это металлы
Cu и Ca
114. Сила кислот в ряду HNO3 → HPO3 → HAsO3:
Убывает
115. Сила кислот увеличивается в ряду:
HF, HCl, HBr, HI
116. Даны формулы кислот: HCl, H2SO4, HNO3, HPO3, H3PO4, HClO4. Среди них:
Одна трехосновная, одна двухосновная, четыре одноосновных
117. Индикаторы лакмус фиолетовый, метиловый, оранжевый, фенолфталеин изменяют окраску в растворе соответственно на
Красный, розовый, бесцветный
118. Стакан с раствором серной кислоты имеет массу 273 г. Масса стакана с раствором после реакции, если в него поместили 27г алюминия.
297 г
119. Для получения 287 г хлорида серебра требуется нитрат серебра и соляная кислота количеством вещества:
2 моль AgNO3, 2 моль HCl
120. Наибольшая массовая доля водорода в кислоте
H2S
121. В реакции между 4 г оксида магния и 4,9 г серной кислоты останется в избытке вещество массой
2 г MgO
122. Относительная плотность йодоводорода по водороду
64
123. Для растворения 300 г известняка (содержание CaCO3 50%) в растворе с массовой долей HCl 20% (p=1.5 г/мл) потребуется соляная кислота объемом (мл, н.у.):
365 мл
124. При обработке 10 г смеси алюминия и меди избытком соляной кислоты выделился 5,6 л водорода (н. у.). Массовая доля Al в смеси:
45 %
125. Оксидом металла является:
Cr2O3
126. Оксид неметалла
SO2
127. Основной оксид
CrO
128. Кислотный оксид
SO2
129. Амфотерный оксид
Al2O3
130. Кислотный оксид
CrO3
131. Формула оксида
CaO
132. Оксид Na2O реагирует с
P2 O5
133. Оксид CO2 реагирует с
NaOH
134. Взаимодействует с раствором щелочи
CO2
135. Основные свойства проявляет оксид
MgO
136. Проявляем амфотерные свойства:
Cr2O3
137. Реакция получения оксида лития:
Li + O2→
138. Оксид железа (II) реагирует с веществами ряда
серной кислотой и водородом
139. Оксид углерода (IV) реагирует с веществами ряда
водой и оксидом кальция
140. При взаимодействии 126г СаО и 126 г HNO3 образуется соль количеством вещества
1 моль
141. При взаимодействии 56г CaO и 189г HNO3 образуется соль массой:
164г








