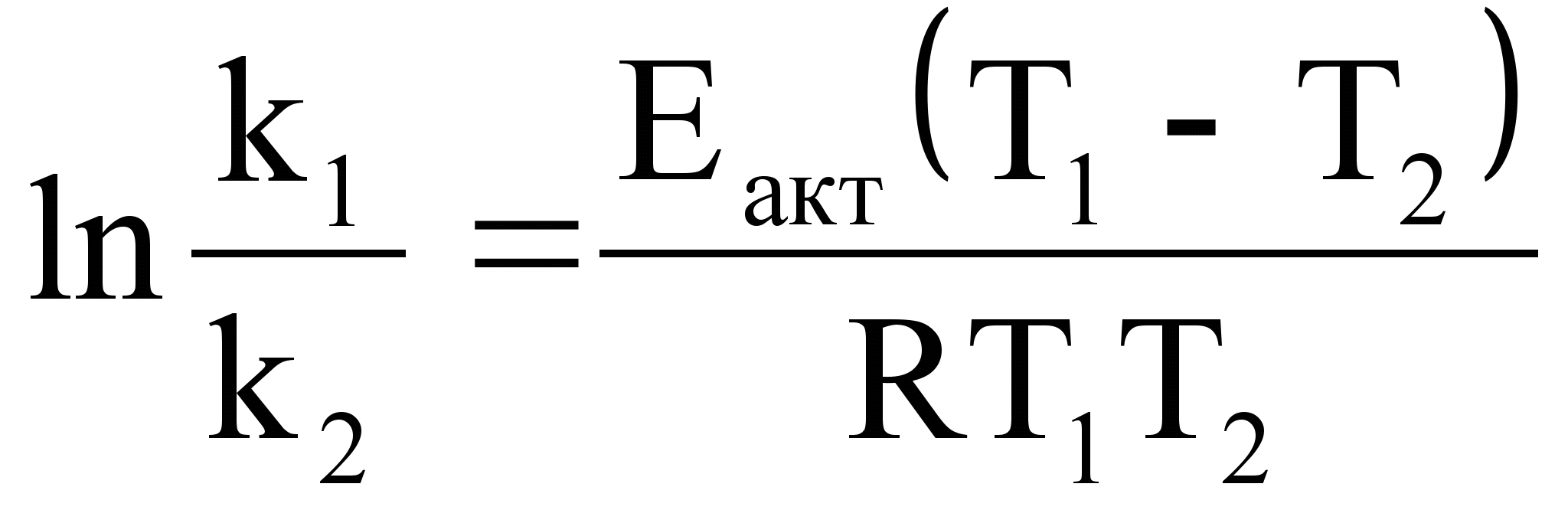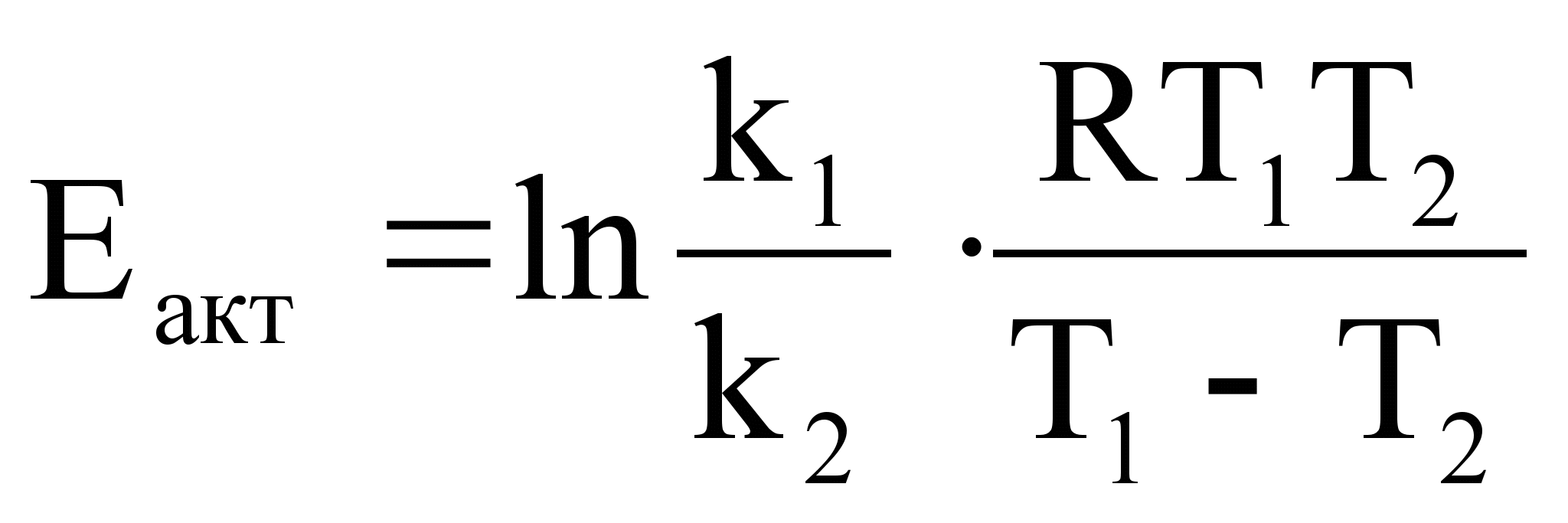21.Зависимость F и G от температуры (уравнения Гиббса-Гельмгольца).
1.Волновые свойства электрона. Квантовые числа, s-,p-,d-,f-состояния электрона. Электронные орбитали. Согласно гипотезе де Бройля (1924), электрон (как и все другие материальные микрообъекты) обладает не только корпускулярными, но и волновыми свойствами. Де-бройлевская длина волны нерелятивистского электрона равна 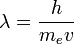 , где v — скорость движения электрона. В соответствии с этим электроны, подобно свету, могут испытывать интерференцию и дифракцию. дифракция - явления, наблюдаемые при прохождении волн мимо края препятствия, связанные с отклонением волн от прямолинейного распространения при взаимодействии с препятствием интерференция - сложение в пространстве двух (или нескольких) волн, при котором в разных точках получается усиление или ослабление амплитуды результирующей волны Сост.любого электрона в атоме может быть охарактеризовано набором 4 квантовых чисел: n, l, m, s. Главное кв.ч. n характеризует общий уровень энергии электрона. Принимает знач. от 1 до 7 (соотв.буквенным обозначениям: k,l,m,n,o,p,q). Чем больше n, тем больше энергия. Переход с одного уровня на другой сопровождается выделением энергии (квантов). Побочное (орбитальное) кв.число хар-ет энергетич.составляющую электрона на подуровне (l=n-1) и определяет форму атомной орбитали. Принимают целочисленные значения от 0 до (n-1), обозначаются буквами s (кв.ч. 0, сферическая форма), p (кв.ч. 1, типа гантелька), d (кв.ч.2, еще более сложная форма), f (кв.ч3, охуительно сложная форма). Магн.к.ч. опр. ориентацию эл-го облака в пространстве (+3,+2,+1,0, -1, -2, -3). Спиновое к.ч. характеризует напр. вр-я электрона. (+1/2 и -1/2).
, где v — скорость движения электрона. В соответствии с этим электроны, подобно свету, могут испытывать интерференцию и дифракцию. дифракция - явления, наблюдаемые при прохождении волн мимо края препятствия, связанные с отклонением волн от прямолинейного распространения при взаимодействии с препятствием интерференция - сложение в пространстве двух (или нескольких) волн, при котором в разных точках получается усиление или ослабление амплитуды результирующей волны Сост.любого электрона в атоме может быть охарактеризовано набором 4 квантовых чисел: n, l, m, s. Главное кв.ч. n характеризует общий уровень энергии электрона. Принимает знач. от 1 до 7 (соотв.буквенным обозначениям: k,l,m,n,o,p,q). Чем больше n, тем больше энергия. Переход с одного уровня на другой сопровождается выделением энергии (квантов). Побочное (орбитальное) кв.число хар-ет энергетич.составляющую электрона на подуровне (l=n-1) и определяет форму атомной орбитали. Принимают целочисленные значения от 0 до (n-1), обозначаются буквами s (кв.ч. 0, сферическая форма), p (кв.ч. 1, типа гантелька), d (кв.ч.2, еще более сложная форма), f (кв.ч3, охуительно сложная форма). Магн.к.ч. опр. ориентацию эл-го облака в пространстве (+3,+2,+1,0, -1, -2, -3). Спиновое к.ч. характеризует напр. вр-я электрона. (+1/2 и -1/2).
Наиб.ч. эл-ов на подуровне вычисл.по формуле 2n2.макс.число – 32. Распр.эл-ов по уровням и подуровням изобр. с помощью электронных формул или ячеек. Пример: Mg-1s22s22p63s2
2.Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов. Принцип Паули: в атоме не может быть двух электронов с одинаковым набором всех 4 кв.ч. У двух электронов могут быть попарно одинаковыми 3 числа, но они обязаны различаться по четвертому.
Наибольшее число электронов Z в оболочке с главным квантовым числом. 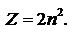 Максимальное число электронов на одном уровне известных ныне электронов – 32. Ограничение принципа Паули: внешний электронный уровень атомов (кроме элемента №46 – палладий) может состоять максимум из двух подуровней – S и P. То есть максимально возможное число электронов на внешнем уровне отвечает конфигурации
Максимальное число электронов на одном уровне известных ныне электронов – 32. Ограничение принципа Паули: внешний электронный уровень атомов (кроме элемента №46 – палладий) может состоять максимум из двух подуровней – S и P. То есть максимально возможное число электронов на внешнем уровне отвечает конфигурации 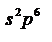 (8 электронов). На s-2(1 орбита), на p(3орбиты)-6, на d(5орбит)-10, на f(7орбит)-14эл-ов.
(8 электронов). На s-2(1 орбита), на p(3орбиты)-6, на d(5орбит)-10, на f(7орбит)-14эл-ов.
3. Связь периодич. закона со строением эл-ных оболочек атомов. Пр. Клечковского. Энергетич. ячейки. Правило Хунда.
Д. Менделеев открыл закон в 1869 году, сформулировав его: «Св-ва простых тел, а также формы и св-ва соединений элементов находятся в периодической зависимости от величины атомных весов эл-ов.» Периодич.сист.– классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона. 1-ое правило Клечковского: последовательное заполнение электрон.орбиталей происходит от орбиталей с меньшим знач.суммы n+1 к большим знач.этой суммы.
2-ое правило Клечковского: при одинаковом знач.суммы заполнение происх.в напр.увелич. « n ».Порядок заполнения атомных орбиталей: 1s2-2s2-2p6-3s2-3p6-4s2-3d10-4p6-5s2-4d10-5p6-6s2-5d1-4f14-5d2-10-6p6-7s2-6d1-5f14-6d2-10-7p6. Периодич.сист.полностью отражает порядок заполнения эл-ми эн.уровней атомов любых эл-ов.
Правило Гунда (или Хунда): суммарный спин(собственный момент импульса элементарных частиц) данного подуровня должен быть макс., т.е. электроны стремятся занять макс.число своих.квант.составл.
4. Периодический закон Д.И.Менделеева и периодическая система: ряды, периоды, группы, подгруппы и порядковый номер.
Д. Менделеев открыл закон в 1869 году, сформулировав его: «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.»
Периодическая система – классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона.
Период – последовательность атомов с одинаковым числом электронных слоев.
Большие периоды содержать 2 ряда (четный и нечетный). Периоды начинаются с активного металла, по мере продвижения усиливаются неметаллические свойства, а завершаются галогеном и инертным газом. Элементы, которые как бы осуществляют переход от металлов к неметаллам, носят название переходных. Элементы группы проявляют одинаковую максимальную валентность по кислороду, равную номеру группы. Элементы главных подгрупп проявляют определенную валентность по водороду. В главных подгруппах по мере движения вниз металлические свойства усиливаются, побочных – ослабевают. Порядковый номер соответствует заряду ядра атома элемента. Современная формулировка закона: свойства элементов и их соединений находятся в периодической зависимости от величины зарядов ядер атомов элементов.
5. Периодическое изменение свойств химических элементов. Радиус атомов, сродство электрону, энергия ионизации, электроотрицательность. Период – последовательность атомов с одинаковым числом электронных слоев. Большие периоды содержать 2 ряда (четный и нечетный). Периоды начинаются с активного металла, по мере продвижения усиливаются неметаллические свойства, а завершаются галогеном и инертным газом. Элементы, которые как бы осуществляют переход от металлов к неметаллам, носят название переходных. Радиус атома - расстояние между атомным ядром и самой дальней из стабильных орбит электронов в электронной оболочке этого атома. Увеличивается с увеличением порядкового номера элемента. Энергия ионизации – энергия, которую необходимо затратить на отрыв электрона с нормального уровня и удаление его на бесконечно далекий уровень. Атом при этом превращается в положительный ион. Ее можно считать мерой металличности: чем меньше энергия, тем ярче проявляются металлические свойства, и наоборот. Энергия сродства к электрону – энергия, которая выделяется при присоединении электрона к нейтральному атому. Она очень мала и становится более-менее заметной с элементов 5-й группы. Электроотрицательность – сумма энергии ионизации и энергии сродства. Чем она больше, тем вероятнее превращение атомов в отрицательные ионы.
6. Образование химической связи. Энергия и длина связи.
При взаимодействии атомов между ними может возникнуть химическая связь, приводящая к образованию молекулы/иона/кристалла. Чем прочнее связь, тем больше требуется затратить энергии на ее разрыв.
При возникновении связи энергия выделяется, следовательно, уменьшается потенциальная энергия системы электронов и ядер.
Потенциальная эн. образующейся молекулы меньше суммарной потенциальной энергии исходных свободных атомов. Для характеристики химической связи используются следующие термины: Длина связи - межъядерное расстояние в невозбуждённой молекуле (обычно 1-2 Ангстрема, 1А=10-8 см).Эн. связи – энергия, выделяющаяся при образовании данного вида связи (150-1000 кДж/моль).
7. Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов. Валентность.
Ков. связь – Это связь между атомами за счет образования общих электронных пар. Возникает между элементами с одинаковым или близким значением энергии сродства к электрону. Механизм возникновения ковалентной связи: 2 метода объяснения: 1 – метод валентных связей, 2 – метод молекулярных орбиталей. М.В.С. - приближённый расчётный метод, основанный на представлении о том, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар. Валентными являются неспаренные электроны.
Валентность - способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов. Например, Валентность хлора в основном состоянии равна единице, поскольку атом имеет один неспаренный электрон. Возбужденное состояние атома – это его новое энергетическое состояние с новым распределением электронов в пределах валентного уровня.
8. Направленность ковалентной связи. Сигма и пи-связи. Гибридизация атомных орбиталей.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы, определенным пространственным расположением электронных орбиталей взаимодействующих атомов. Так, угол между связями, образованными p-орбиталями атома, должен быть равен примерно 90°. При образовании ковалентной связи в молекулах органических соединений общая электронная пара заселяет связывающие молекулярные орбитали, имеющие более низкую энергию. В зависимости от формы МО – σ-МО или π-МО – образующиеся связи относят к σ- или p-типу. σ-Связь – ковалентная связь, образованная при перекрывании s-, p- и гибридных АО вдоль оси, соединяющей ядра связываемых атомов (т.е. при осевом перекрывании АО). π-Связь – ковалентная связь, возникающая при боковом перекрывании негибридных р-АО. Такое перекрывание происходит вне прямой, соединяющей ядра атомов. π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи). π-Связь слабее σ-связи из-за менее полного перекрывания р-АО. Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам. (короч если у атома есть разные орбитали, то в итоге из них образуются одинаковые)
9. Ионная (электронная) связь. Ионная связь – очень прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью. Это притяжение ионов как разноименно заряженных тел. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы. Катионы – положительно заряженные ионы. Анионы – отрицательно заряженные ионы. По составу выделяют простые (К+, Сl-. H+,Na+) и сложные (SO42-,OH-, NO3-NH4+) ионы. Соединений с чисто ионной связью не существует (имеет место определённая ковалентность). Электростатическое взаимодействие очень мощное. Это объясняет высокую прочность соединений с ионной связью, высокую температуру плавления и кипения. Соединения с ионной связью – проводники второго рода.
10.Представление о методе молекулярных орбиталей. Согласно ММО электроны в молекулах распределены по молекулярным орбиталям, которые подобно атомным орбиталям характеризуются определенной энергией (эн. уровнем) и формой. В отличие от АО, МО схватывают не один атом, а всю молекулу т.е. являются двух- или многоцентровыми. Молекула рассматривается как единая система. Наиболее широко в ММО используется линейная комбинация атомных орбиталей. При этом соблюдаются несколько правил: 1) Число МО равно общему число АО, из которых комбинируется МО. 2) Энергии МО обычно не совпадают с энергиями АО. Средние энергии МО и АО примерно совпадают. 3) Электроны заполняют МО в порядке возрастания энергии. 4) Прочность связи пропорциональна степени перекрывания АО.
11.Полярность связи. Полярность молекул и дипольный момент.
Полярность химических связей — характеристика химической связи, показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах. В качестве количественной меры полярности связи используются так называемые эффективные заряды на атомах. Эффективный заряд определяется как разность между зарядом электронов, находящимся в некоторой области пространства вблизи ядра, и зарядом ядра. Однако эта мера имеет лишь условный и приблизительный смысл, поскольку невозможно однозначно выделить в молекуле область, относящуюся исключительно к отдельному атому, а при нескольких связях — к конкретной связи. Наличие эффективного заряда может быть указано символами зарядов у атомов (например, Н+δ — Cl−δ, где δ — некоторая доля элементарного заряда). Практически все химические связи, за исключениям связей в двухатомных гомоядерных молекулах — в той или иной степени полярны. Ковалентные связи обычно слабо полярны. Ионные связи — сильно полярны. Полярность молекулы определяется разностью электроотрицательностей атомов, образующих двухцентровую связь, геометрией молекулы, а так же наличием неподеленных электронных пар, так как часть электронной плотности в молекуле может быть локализована не в направлении связей. Полярность связи выражается через ее ионную составляющую, то есть через смещение электронной пары к более электроотрицательному атому. Полярность связи может быть выражена через ее дипольный момент μ, равный произведению элементарного заряда на длину диполя μ = e ∙ l. Полярность молекулы выражается через ее дипольный момент, который равен векторной сумме всех дипольных моментов связей молекулы. Диполь – система из двух равных, но противоположных по знаку зарядов, находящихся на единичном расстоянии друг от друга. Дипольный момент измеряется в кулон-метрах (Кл∙м) или в дебаях (D); 1D = 0,333∙10–29 Кл∙м.
12. Донорно-акцепторный механизм ков.св.. Комплексные соединения.
Донорно-акцепторный механизм (иначе координационный механизм) — способ образования ковалентной химической связи между двумя атомами или группой атомов, осуществляемый за счет неподеленной пары электронов атома-донора и свободной орбитали атома-акцептора. Если одна из двух молекул имеет атом со свободными орбиталями, а другая атом с прой неопределенных электронов, то мнежду ними возникает Д-А взаимодействие.
Комплексное соединение – сложные соединения, у которых имеются ковалентные связи, образованные по ДАМ . Рассмотрим пример [Cu(NH3)4]SO4. Cu-комплексообразователь, 4-координационное число. ( )- внутренняя сфера, [ ]-внешняя сфера, NH3-лиганды.
Координационное число для комплексного соединения имеет тот же смысл, что валентность в обычных соединениях. Принимает значения от 1-12 (кроме 10 и 11).
13. Межмолекулярное взаимодействие. Водородная связь.
Водородная связь — вид химической связи между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом (в составе той же молекулы или в другой молекуле). Обычно изображается точками или пунктиром на структурных схемах. Водородная связь по прочности превосходит вандерваальсово взаимодействие, и ее энергия составляет 8—40 кДж/моль. Однако она обычно на порядок слабее ковалентной связи. Водородная связь характерна для соединений водорода с наиболее электроотрицательными элементами: фтора, кислорода, азота, хлора и серы. Водородная связь весьма распространена и играет важную роль при ассоциации молекул, в процессах кристаллизации, растворения, образования кристаллогидратов, электролитической диссоциации и других важных физико-химических процессах. Молекула воды образует четыре водородные связи, чем объясняются особенности строения воды и льда, а также многие аномальные свойства воды: 1) макс. плотность при температуре +4 2) вода обладает наибольшей теплоемкостью из известных жидкостей. При нагреве воды значительная часть энергии затрачивается на разрыв связей, отсюда и повышенная теплоемкость. Межмолекулярное взаимодействие - взаимодействие молекул между собой, не приводящее к разрыву или образованию новых химических связей. В их основе, как и в основе химической связи, лежат электрические взаимодействия. Различают ориентационное, индукционное и дисперсионное взаимодействия. Ориентационные силы, диполь-дипольное притяжение. Осуществляется между молекулами, являющимися постоянными диполями. В результате беспорядочного теплового движения молекул при их сближении друг с другом одноименно заряженные концы диполей взаимно отталкиваются, а противоположно заряженные притягиваются. Чем более полярны молекулы, тем сильнее они притягиваются и тем самым больше ориентационное взаимодействие. Энергия такого взаимодействия обратно пропорциональна кубу расстояния между диполями. Дисперсионное притяжение (лондоновские силы). Взаимодействие между мгновенным и наведенным диполем. При сближении молекул ориентация микродиполей перестает быть независимой и их появление и исчезновение в разных молекулах происходит в такт друг другу. Синхронное появление и исчезновение микродиполей разных молекул сопровождается их притяжением. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями. Индукционное притяжение. Взаимодействие между постоянным диполем и наведенным (индуцированным). Встречаются полярная и неполярная молекулы. Под действием полярной молекулы неполярная молекула деформируется и в ней возникает (индуцируется) диполь. Индуцированный диполь притягивается к постоянному диполю полярной молекулы и в свою очередь усиливает электрический момент диполя полярной молекулы. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
14. Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия.
Система - это тело или группа тел, находящиеся во взаимодействии, которые мысленно выделены из окружающей среды. Бывают гомогенными (однородные) и гетерогенными (неоднородные).Изолированная система не имеет обмена веществ и энергий с окружающей средой. Закрытая – не имеет только массообмена (необратимый перенос массы компонента смеси в пределах одной или неск. фаз). Открытая – имеет и энерго- и массообмен.Фаза - совокупность всех гомогенных частей системы, одинаковых по составу и всем физ. и хим. свойствам, не зависящим от количества вещества. Фазы отделены друг от друга поверхностями раздела, на которых все свойства фазы резко скачком меняются. Компоненты – составные части системы, химически индивидуальные вещества, составляющие данную систему и способные к самостоятельному существованию, будучи изолированными от других частей системы. Состояние системы определяется набором переменных величин - параметров. Различают параметры интенсивные и экстенсивные. Интенсивные - не зависят от массы или числа частиц в-ва. (P,T), а экстенсивные - зависят (V, E). Функции состояния - это термодинамические функции, значения которых зависят только от состояния системы и не зависят от пути, по которому система пришла в данное состояние. Изменение функции состояния 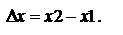 Наиболее важными функциями являются внутренняя энергия системы U и энтальпия H (теплосодержание)
Наиболее важными функциями являются внутренняя энергия системы U и энтальпия H (теплосодержание) 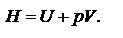 Внутр. энергия – общий запас энергии: энергия поступательного и вращательного движения, энергия колебаний, внутриядерная энергия, за исключением кинетической энергии системы в целом и потенциальной энергии положения системы. Энтальпия — это свойство вещества, указывающее количество энергии, которую можно преобразовать в теплоту.
Внутр. энергия – общий запас энергии: энергия поступательного и вращательного движения, энергия колебаний, внутриядерная энергия, за исключением кинетической энергии системы в целом и потенциальной энергии положения системы. Энтальпия — это свойство вещества, указывающее количество энергии, которую можно преобразовать в теплоту.
Энтальпия — это термодинамическое свойство вещества, которое указывает уровень энергии, сохраненной в его молекулярной структуре. Это значит, что, хотя вещество может обладать энергией на основании температуры и давления, не всю ее можно преобразовать в теплоту. Часть внутренней энергии всегда остается в веществе и поддерживает его молекулярную структуру. стандартное давление для газов, жидкостей, и твёрдых тел, равное 105 Па (750 мм рт. ст.); стандартная температура для газов, равная 273,15 К (0° С); стандартная молярность для растворов, равная 1 моль•л−1. При этих условиях константа диссоциации дистиллированной воды составляет 1,0×10−14.
15. Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты.
Существует множество формулировок первого закона: В изолированной системе общий запас энергии сохраняется постоянным. Поскольку работа является одной из форм перехода энергии, то, следовательно, невозможно создание вечного двигателя первого рода (машины, совершающей работу без затраты энергии). Математическая формулировка: 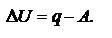 При протекании изобарического процесса:
При протекании изобарического процесса: 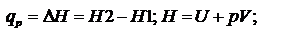
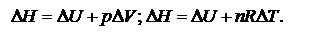 При протекании изохорического процесса:
При протекании изохорического процесса: 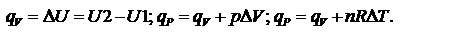 При протекании изотермического процесса:
При протекании изотермического процесса: 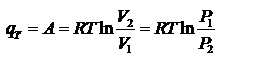 При протекании кругового процесса:
При протекании кругового процесса: 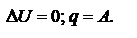
Термохимия – область физ. химии, занимающаяся изучением энергет. эффектов реакций. Если в уравнении указан ее энергетический эффект – это термохимическое ур-е. V=const, 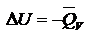 p=const,
p=const, 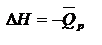 Русский ученый Гесс (1840) дал формулировку основному закону термохимии: тепловой эффект реакции, протекающей при постоянном объеме или при постоянном давлении, не зависит от пути реакции (от ее промежуточных стадий), а определяется только природой и состоянием исходных веществ и продуктов реакции. Этот закон – прямое следствие первого закона термодинамики. С помощью закона Гесса можно вычислять теплоты различных реакций, не проводя самих реакций.
Русский ученый Гесс (1840) дал формулировку основному закону термохимии: тепловой эффект реакции, протекающей при постоянном объеме или при постоянном давлении, не зависит от пути реакции (от ее промежуточных стадий), а определяется только природой и состоянием исходных веществ и продуктов реакции. Этот закон – прямое следствие первого закона термодинамики. С помощью закона Гесса можно вычислять теплоты различных реакций, не проводя самих реакций.
Например: 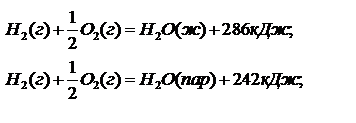
Вывод: теплота испарения одного моля воды равна 44 Дж.
16. Стандартная энтальпия образования. Следствия из закона Гесса.
Под стандартной теплотой (энтальпией) образования понимают тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях. Стандартная энтальпия образования обозначается ΔHfO.
Русский ученый Гесс (1840) дал формулировку основному закону термохимии: тепловой эффект реакции, протекающей при постоянном объеме или при постоянном давлении, не зависит от пути реакции (от ее промежуточных стадий), а определяется только природой и состоянием исходных веществ и продуктов реакции. Следствия из закона Гесса:
1. Тепловой эффект реакции равен разности между суммой теплот горения исходных веществ и суммой теплот горения продуктов реакции. Теплота горения – тепловой эффект реакции окисления данного соединения кислородом с образованием высших оксидов. Теплота образования – тепловой эффект реакции образования данного соединения из простых веществ, отвечающих наиболее устойчивому состоянию элементов при данных температуре и давлении.
2. Тепловой эффект реакции равен разности между теплотами образования всех веществ, указанных в правой части уравнения, и теплотами образования веществ в левой части уравнения, взятых с коэффициентами перед формулами этих веществ в уравнении самой реакции. В настоящее время известны теплоты образования свыше 6000 веществ. Стандартные теплоты образования – величины теплот образования к температуре 298К и давлению 1атм.
17. Зависимость теплового эффекта химической реакции от температуры (закон Кирхгофа). Продифференцируем уравнения 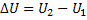 и
и 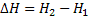 по Т, причем в первом случае возьмем постоянный V, а во втором – Р.
по Т, причем в первом случае возьмем постоянный V, а во втором – Р.
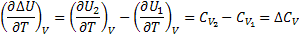
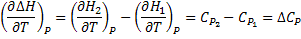
Температурный коэффициент теплового эффекта процесса равен изменению теплоемкости системы, происходящему в результате процесса (правило Кирхгоффа). Интегрируя полученные выше дифф уравнения, получаем:
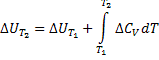
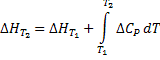 В небольшом диапазоне температур можно ограничиться первым членом степенного ряда для С, и тогда она будет постоянной.
В небольшом диапазоне температур можно ограничиться первым членом степенного ряда для С, и тогда она будет постоянной.
18. Второе начало термодинамики. Понятие об энтропии. Термодинамическая вероятность. Приведённое тепло. Неравенство и тождество Клаузиуса.
Невозможен самопроизвольный переход тепла от менее нагретого тела более нагретому. Невозможно создание вечного двигателя 2го рода(машины, которая периодически превращает тепло среды при пост. температуре в работу. Термодинамический КПД: 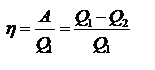 Для изолированных систем критерием, позволяющим судить о направлении процессов и об условиях равновесия, является функция-S -энтропия. Процессы протекают в сторону увеличения энтропии. При равновесии энтропия достигает максимума. Обратное протекание процессов не может быть самопроизвольным – требуется затрата работы извне. Физ. смысл функции состояния энтропии легче всего проиллюстрировать на примере кипения жидкости. При нагреве: Т и U увеличиваются до тех пор, пока жидкость не закипит. При этом поглощается теплота испарения, затрачиваемая на увеличение беспорядка в системе. Таким образом, энтропия – мера упорядоченности состояния системы.
Для изолированных систем критерием, позволяющим судить о направлении процессов и об условиях равновесия, является функция-S -энтропия. Процессы протекают в сторону увеличения энтропии. При равновесии энтропия достигает максимума. Обратное протекание процессов не может быть самопроизвольным – требуется затрата работы извне. Физ. смысл функции состояния энтропии легче всего проиллюстрировать на примере кипения жидкости. При нагреве: Т и U увеличиваются до тех пор, пока жидкость не закипит. При этом поглощается теплота испарения, затрачиваемая на увеличение беспорядка в системе. Таким образом, энтропия – мера упорядоченности состояния системы. 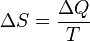 -2е начало термодинамики для обратимых процессов. В изолированной системе процессы самопроизвольные, протекают в сторону увеличения энтропии
-2е начало термодинамики для обратимых процессов. В изолированной системе процессы самопроизвольные, протекают в сторону увеличения энтропии 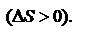 В неизолированных–возможно
В неизолированных–возможно 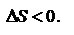 Термодинамическая вероятность (или статический вес) — число способов, которыми может быть реализовано состояние физической системы.Неравенство Клаузиуса (1854): Количество теплоты, полученное системой при любом круговом процессе, делённое на абсолютную температуру, при которой оно было получено (приведённое количество теплоты), неположительно.
Термодинамическая вероятность (или статический вес) — число способов, которыми может быть реализовано состояние физической системы.Неравенство Клаузиуса (1854): Количество теплоты, полученное системой при любом круговом процессе, делённое на абсолютную температуру, при которой оно было получено (приведённое количество теплоты), неположительно. 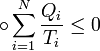
19.Тепловая теорема Нернста. Постулат Планка. Расчёт абсолютного значения энтропии. Понятие вырождения идеального газа. Теорема Нернста утверждает, что изменение энтропии в обратимой хим. р-ции между в-вами в конденсир. состоянии, стремится к нулю при T 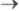 0:
0: 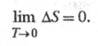 Основываясь на этом, Планк в 1911 году постулировал: “При абсолютном нуле температуры энтропия не только имеет наименьшее значение, но просто равна нулю”. Постулат Планка формулируется следующим образом: «Энтропия правильно сформированного кристалла чистого вещества при абсолютном нуле температуры равна нулю» Абсолютное значение энтропии позволяет установить третье начало термодинамики, или Нернста теорему: при стремлении абсолютной температуры к нулю разность DS для любого вещества стремится к нулю независимо от внешних параметров. Поэтому: энтропию всех веществ при абсолютном нуле температуры можно принять равной нулю (эту формулировку теоремы Нернста предложил в 1911 М. Планк). Основываясь на ней, за начальную точку отсчёта энтропии принимают So = 0 при Т = 0. Вырожденный газ - газ, свойства которого существенно отличаются от свойств классического идеального газа вследствие квантовомеханического влияния одинаковых частиц друг на друга. Это взаимное влияние частиц обусловлено не силовыми взаимодействиями, отсутствующими у идеального газа, а тождественностью (неразличимостью) одинаковых частиц в квантовой механике. В результате такого влияния заполнение частицами возможных уровней энергии даже в идеальном газе зависит от наличия на данном уровне других частиц. Поэтому теплоёмкость и давление такого газа иначе зависят от температуры, чем у идеального классического газа; по-другому выражается Энтропия, Свободная энергия и т. д. Вырождение газа наступает при понижении его температуры до некоторого значения, называемого температурой вырождения. Полное вырождение соответствует абсолютному нулю температуры. Влияние тождественности частиц сказывается тем существеннее, чем меньше среднее расстояние между частицами r по сравнению с длиной Волны де Бройля частиц λ = h/mv (m — масса частицы, v — её скорость, h — Планка постоянная)
Основываясь на этом, Планк в 1911 году постулировал: “При абсолютном нуле температуры энтропия не только имеет наименьшее значение, но просто равна нулю”. Постулат Планка формулируется следующим образом: «Энтропия правильно сформированного кристалла чистого вещества при абсолютном нуле температуры равна нулю» Абсолютное значение энтропии позволяет установить третье начало термодинамики, или Нернста теорему: при стремлении абсолютной температуры к нулю разность DS для любого вещества стремится к нулю независимо от внешних параметров. Поэтому: энтропию всех веществ при абсолютном нуле температуры можно принять равной нулю (эту формулировку теоремы Нернста предложил в 1911 М. Планк). Основываясь на ней, за начальную точку отсчёта энтропии принимают So = 0 при Т = 0. Вырожденный газ - газ, свойства которого существенно отличаются от свойств классического идеального газа вследствие квантовомеханического влияния одинаковых частиц друг на друга. Это взаимное влияние частиц обусловлено не силовыми взаимодействиями, отсутствующими у идеального газа, а тождественностью (неразличимостью) одинаковых частиц в квантовой механике. В результате такого влияния заполнение частицами возможных уровней энергии даже в идеальном газе зависит от наличия на данном уровне других частиц. Поэтому теплоёмкость и давление такого газа иначе зависят от температуры, чем у идеального классического газа; по-другому выражается Энтропия, Свободная энергия и т. д. Вырождение газа наступает при понижении его температуры до некоторого значения, называемого температурой вырождения. Полное вырождение соответствует абсолютному нулю температуры. Влияние тождественности частиц сказывается тем существеннее, чем меньше среднее расстояние между частицами r по сравнению с длиной Волны де Бройля частиц λ = h/mv (m — масса частицы, v — её скорость, h — Планка постоянная)
20.Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца. Условия самопроизвольного протекания химических реакций. Первый закон. Теплота, подведенная к системе, расходуется на приращение внутренней энергии системы и на работу системы над окружающей средой. 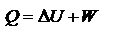 Второй закон. (Несколько формулировок): в изолированных системах самопроизвольно идут процессы, которые сопровождаются возрастанием энтропии:
Второй закон. (Несколько формулировок): в изолированных системах самопроизвольно идут процессы, которые сопровождаются возрастанием энтропии: 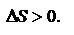 Энтропия – термодинамическая функция, характеризующая меру неупорядоченности состояния системы. Она используется для суждения о направлении самопроизвольно протекающих процессах. Обобщенный закон. Для каждой изолированной термодинамической системы существует состояние термодинамического равновесия, которого она при фиксированных внешних условиях с течением времени самопроизвольно достигает. TdS>dU+pd Энергия Гельмгольца. Максимальная работа, которую может совершить система при равновесном проведении процесса, равна изменению энергии Гельмгольца реакции
Энтропия – термодинамическая функция, характеризующая меру неупорядоченности состояния системы. Она используется для суждения о направлении самопроизвольно протекающих процессах. Обобщенный закон. Для каждой изолированной термодинамической системы существует состояние термодинамического равновесия, которого она при фиксированных внешних условиях с течением времени самопроизвольно достигает. TdS>dU+pd Энергия Гельмгольца. Максимальная работа, которую может совершить система при равновесном проведении процесса, равна изменению энергии Гельмгольца реакции 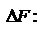
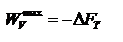 Энергия Гельмгольца равна
Энергия Гельмгольца равна 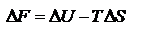
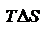 называют связанной энергией. Она характеризует предел самопроизвольного течения реакции, которое возможно при
называют связанной энергией. Она характеризует предел самопроизвольного течения реакции, которое возможно при 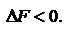 Энергия Гиббса. Энтальпийный и энтропийный факторы, характеризующие процессы, объединены функцией - энергия Гиббса.
Энергия Гиббса. Энтальпийный и энтропийный факторы, характеризующие процессы, объединены функцией - энергия Гиббса. 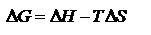 Поскольку энергию Гиббса можно превратить в работу, то ее называют свободной энергией.
Поскольку энергию Гиббса можно превратить в работу, то ее называют свободной энергией. 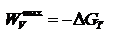 Химическая реакция возможна, если энергия Гиббса уменьшается (<0).Энергия Гиббса образования вещества – изменение энергии Гиббса системы при образовании 1 моль вещества из простых веществ, устойчивых при 298 К.
Химическая реакция возможна, если энергия Гиббса уменьшается (<0).Энергия Гиббса образования вещества – изменение энергии Гиббса системы при образовании 1 моль вещества из простых веществ, устойчивых при 298 К.
21.Зависимость F и G от температуры (уравнения Гиббса-Гельмгольца).
∆G – Энергия Гиббса(T и p – const), ∆F – Энергия Гельмгольца(V и T – const) Две противоположные тенденции процессов - ∆H – изменение энтальпии и ∆S – изменение энтропии - не могут быть критериями самопроизвольного протекания процесса. Для изобарно-изотермических процессов их объединяет функция, называемая Энергией Гиббса: ∆G=∆H−T∆S; ∆G=−A
∆G<0, процесс самопроизвольный ∆G=0, динамическое равновесие
∆G>0, прямой процесс невозможен, возможен только обратный
Энергия Гельмгольца – характеризует предел и направление самопроизвольного течения химической реакции при изохорно-изотермических условиях, которое возможно при соблюдении неравенства deltaF < 0 ∆F=∆U−T∆S
22. Условия самопроизвольного протекания химических реакций.
В химических системах вещества стремятся к минимуму внутренней энергии. Экзотермические реакции протекают самопроизвольно, так как вещества при их окончании достигают своего минимума внутренней энергии. Но также самопроизвольно протекают и эндотермические реакции - это растворение солей. Макросостояние системы тем более вероятно, чем большим числом микросостояний оно может быть описано. Условия самопроизвольного протекания реакций:
1. стремление системы к достижению минимального значения внутренней энергии
2. стремление системы к более вероятному своему состоянию. Но часто происходит столкновение этих двух определяющих факторов, и возникает состояние, называемое химическим равновесием. Функция, которая учитывает оба этих фактора – энергия Гиббса. Самопроизвольно протекают те процессы, энергия Гиббса которых равна отрицательному значению. Если температура мала, то энтальпия равна энергии Гиббса и самопроизвольно протекают экзотермические реакции. Если высокая температура, то отрицательное значение имеет энергия Гиббса и реакции протекают самопроизвольно. Необратимые реакции протекают до полного израсходования одного из реагентов. Обратимые протекают во взаимопротивоположных направлениях. В состоянии химического равновесия система достигает своего минимального значения энергии и энергия Гиббса, как и константа химического равновесия, равна нулю.
23.Изотерма химической реакции. Стандартное изменение свободной энергии.
Для реакции, протекающей в изобарно-изотермических условиях, в некотором неравновесном исходном состоянии энергии Гиббса или химические потенциалы реагирующих веществ и продуктов реакции в общем случае не одинаковы, их разность (ΔGT) может быть рассчитана по уравнению: 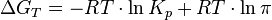 где
где 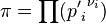 — отношение парциальных давлений участников реакции в исходном состоянии в степенях, равных их стехиометрическим коэффициентам; R — универсальная газовая постоянная. Это уравнение называют уравнением изотермы химической реакции. Оно позволяет рассчитать изменение энергии Гиббса при протекании процесса и определить направление протекания реакции: при
— отношение парциальных давлений участников реакции в исходном состоянии в степенях, равных их стехиометрическим коэффициентам; R — универсальная газовая постоянная. Это уравнение называют уравнением изотермы химической реакции. Оно позволяет рассчитать изменение энергии Гиббса при протекании процесса и определить направление протекания реакции: при 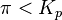
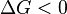 — реакция идёт в прямом направлении, слева направо; при
— реакция идёт в прямом направлении, слева направо; при 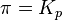
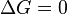 — реакция достигла равновесного состояния; при
— реакция достигла равновесного состояния; при 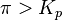
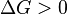 — реакция идёт в обратном направлении. константа равновесия может быть рассчитана по уравнению:
— реакция идёт в обратном направлении. константа равновесия может быть рассчитана по уравнению: 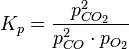
24. Константа химического равновесия. Различные способы выражения констант равновесия. Соотношение между константами. Рассмотрим гомогенную химическую реакцию: 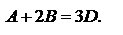 Реакции протекают до полного исчезновения исходных веществ, а останавливаются при достижении определенного состояния равновесия. Условия химического равновесия:
Реакции протекают до полного исчезновения исходных веществ, а останавливаются при достижении определенного состояния равновесия. Условия химического равновесия: 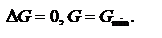 Равновесные давления участников реакции:
Равновесные давления участников реакции: 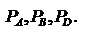 Согласно закону действующих масс
Согласно закону действующих масс 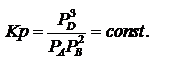
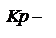 константа равновесия, выраженная через парциальные давления. Размерность
константа равновесия, выраженная через парциальные давления. Размерность  .
. 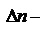 изменение числа молей при протекании реакции.При написании констант равновесия гетерогенных реакции учитываются парциальные давления только газообразных участников реакций, поскольку давления пара конденсированных фаз малы по сравнению с газообразными компонентами. Пример.
изменение числа молей при протекании реакции.При написании констант равновесия гетерогенных реакции учитываются парциальные давления только газообразных участников реакций, поскольку давления пара конденсированных фаз малы по сравнению с газообразными компонентами. Пример. 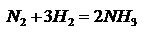
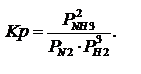
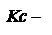 константа равновесия, выраженная через концентрации.
константа равновесия, выраженная через концентрации. 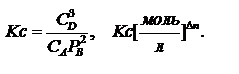 Кроме того существуют
Кроме того существуют 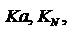 где а-активности, н-мольная доля. Соотношения между константами равновесия:
где а-активности, н-мольная доля. Соотношения между константами равновесия: 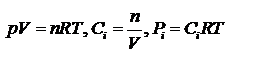
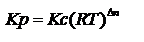
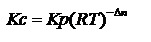
25.Зависимость константы химического равновесия от температуры (изобара и изохора химической реакции).
Зависимость константы равновесия реакции от температуры может быть описана уравнением изобары химической реакции (изобары Вант-Гоффа): 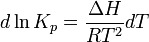
и изохоры химической реакции (изохоры Вант-Гоффа): 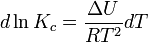 Здесь ∆H и ∆U − тепловой эффект реакции, протекающей, соответственно, при постоянном давлении или при постоянном объёме. Если тепловой эффект положителен (реакция эндотермическая), то температурный коэффициент константы равновесия тоже положителен, то есть с ростом температуры константа равновесия эндотермической реакции увеличивается, равновесие сдвигается вправо (что вполне согласуется с принципом Ле Шателье). При изотермических реакциях T – const.
Здесь ∆H и ∆U − тепловой эффект реакции, протекающей, соответственно, при постоянном давлении или при постоянном объёме. Если тепловой эффект положителен (реакция эндотермическая), то температурный коэффициент константы равновесия тоже положителен, то есть с ростом температуры константа равновесия эндотермической реакции увеличивается, равновесие сдвигается вправо (что вполне согласуется с принципом Ле Шателье). При изотермических реакциях T – const.
26.Принцип Ле-Шателье. С конкретными примерами. При неизменных условиях химическое равновесие в системе может сохраняться сколь угодно долго. В случае же изменения условий (концентрация, температура, давление) одна из противоположно направленных реакций может ускориться. После этого равновесие сместится, и установится новое состояние равновесия. Принцип Ле-Шателье: если на систему, находящуюся в истинном химическом равновесии, оказывают воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то оно смещается в направлении той реакции, протекание которой ослабляет эффект произведенного воздействия. 1. Влияние температуры. Повышение температуры смещает равновесие в сторону процесса, идущего с поглощением тепла: 2SO2+O2 → 2SO3+Q  2. Влияние концентрации. При увеличении концентрации исходных веществ равновесие смещается в сторону реакции, потребляющей эти вещества (вправо): 2SO2+O2 → 2SO3 3. Влияние давления. Увеличение давления смещает равновесие в сторону меньшего числа молей, т.е. в сторону падения давления. Примечание. На реакцию, идущую без изменения числа молей, давление не влияет. 2SO2+O2 → 2SO3
2. Влияние концентрации. При увеличении концентрации исходных веществ равновесие смещается в сторону реакции, потребляющей эти вещества (вправо): 2SO2+O2 → 2SO3 3. Влияние давления. Увеличение давления смещает равновесие в сторону меньшего числа молей, т.е. в сторону падения давления. Примечание. На реакцию, идущую без изменения числа молей, давление не влияет. 2SO2+O2 → 2SO3 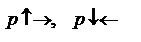 Действие принципа Ле Шателье можно проследить на примере изменения химического состава дождя или растворения шипучей антацидной (снижающей кислотность желудочного сока) таблетки в воде. В обоих случаях в химической реакции участвуют углекислый газ (CO2), вода(H2O) и угольная кислота (H2CO3): CO2 + H2O <—> H2CO3 Когда дождевая капля попадает в воздух, она поглощает углекислый газ, и концентрация в левой части реакции возрастает. Для поддержания равновесия образуется большее количество угольной кислоты. В результате дождь становится кислотным. Добавление углекислого газа смещает равновесие реакции вправо. Противоположная реакция происходит при опускании в воду таблетки антацида (вещества, нейтрализующего кислоту). Бикарбонат натрия (антацид) вступает в реакцию с водой, и образуется угольная кислота, что приводит к увеличению концентрации вещества в правой части реакции. Чтобы восстановилось равновесие, угольная кислота разлагается на воду и углекислый газ, который мы и наблюдаем в виде пузырьков.
Действие принципа Ле Шателье можно проследить на примере изменения химического состава дождя или растворения шипучей антацидной (снижающей кислотность желудочного сока) таблетки в воде. В обоих случаях в химической реакции участвуют углекислый газ (CO2), вода(H2O) и угольная кислота (H2CO3): CO2 + H2O <—> H2CO3 Когда дождевая капля попадает в воздух, она поглощает углекислый газ, и концентрация в левой части реакции возрастает. Для поддержания равновесия образуется большее количество угольной кислоты. В результате дождь становится кислотным. Добавление углекислого газа смещает равновесие реакции вправо. Противоположная реакция происходит при опускании в воду таблетки антацида (вещества, нейтрализующего кислоту). Бикарбонат натрия (антацид) вступает в реакцию с водой, и образуется угольная кислота, что приводит к увеличению концентрации вещества в правой части реакции. Чтобы восстановилось равновесие, угольная кислота разлагается на воду и углекислый газ, который мы и наблюдаем в виде пузырьков.
27.Скорость химической реакции. Закон действующих масс. Физический смысл константы скорости.
Скорость гомогенной (однофазной) реакции зависит от природы реагирующих веществ, их концентрации и температуры. Скорость гетерогенных (многофазных) процессов зависит от размеров и состояния поверхности раздела фаз. Примечание. Гетерогенные – процессы, происходящие на поверхности раздела соприкасающихся фаз. (горение топлива, окисление металлов кислородом воздуха). Закон действующих масс. Справедлив для гомогенных реакций. Формулировка: при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ. Константа скорости обозначается как 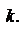 Пример.
Пример. 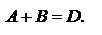
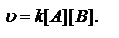 в квадратных скобках концентрации веществ. A+2B=3D
в квадратных скобках концентрации веществ. A+2B=3D 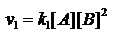
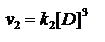 «k» не зависит от концентрации в каждый момент времени. Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
«k» не зависит от концентрации в каждый момент времени. Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
28.Молекулярность и порядок реакции. Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия. Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.): H2S → H2 + S Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных): СН3Вr + КОН → СН3ОН + КВr Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц: О2 + NО + NО → 2NО2 Реакции с молекулярностью более трёх неизвестны. Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Чётко определенной взаимосвязи между понятиями молекулярности и порядка реакции нет, так как порядок реакции характеризует кинетическое уравнение реакции, а молекулярность — механизм реакции. Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции. Реакция нулевого порядка Кинетическое уравнение имеет следующий вид: 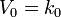 Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения. Реакция первого порядка Кинетическое уравнение реакции первого порядка:
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения. Реакция первого порядка Кинетическое уравнение реакции первого порядка: 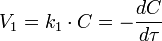 Приведение уравнения к линейному виду даёт уравнение:
Приведение уравнения к линейному виду даёт уравнение: 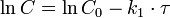 Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени:
Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени: 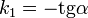 Период полупревращения:
Период полупревращения: 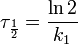 Реакция второго порядка Для реакций второго порядка кинетическое уравнение имеет следующий вид:
Реакция второго порядка Для реакций второго порядка кинетическое уравнение имеет следующий вид: 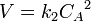 или
или 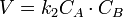 В первом случае скорость реакции определяется уравнением
В первом случае скорость реакции определяется уравнением 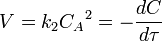 Линейная форма уравнения:
Линейная форма уравнения: 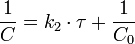 Константа скорости реакции равна тангенсу угла наклона прямой к оси времени:
Константа скорости реакции равна тангенсу угла наклона прямой к оси времени: 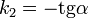
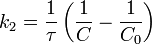 Во втором случае выражение для константы скорости реакции будет выглядеть так:
Во втором случае выражение для константы скорости реакции будет выглядеть так: 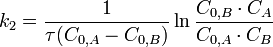 Период полупревращения (для случая равных начальных концентраций!):
Период полупревращения (для случая равных начальных концентраций!): 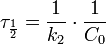
29.Кинетическая классификация по степени сложности. Обратимые и необратимые реакции. По степени сложности реакции подразделяются на изолированные, параллельные, сопряженные, последовательные (многоступенчатые), обратимые и необратимые. Изолированные – при их протекании образуются продукты только одного типа. Параллельные – в ходе них взятые вещества одновременно реагируют в двух или более направлениях (образуются разные продукты).Пример. Разложение бертолетовой соли 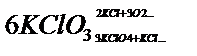 Скорость реакции:
Скорость реакции: 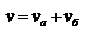 Сопряженные – совместные реакции типа:
Сопряженные – совместные реакции типа: 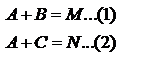 Вторая реакция протекает лишь совместно с первой. А – актор реакции, B – индуктор реакции, С – акцептор. Последовательные.
Вторая реакция протекает лишь совместно с первой. А – актор реакции, B – индуктор реакции, С – акцептор. Последовательные. 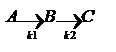 В – промежуточный продукт. Обратимые и необратимые. Подавляющее большинство химических реакций являются обратимыми, т.е. могут протекать в двух направлениях. Скорость реакции: v=v1-v2 Различают практически необратимые и совершенно необратимые реакции. Практически необратимые – реакции, в результате которых образуется осадок. Совершенно необратимые – протекают только в одном направлении. Пример.
В – промежуточный продукт. Обратимые и необратимые. Подавляющее большинство химических реакций являются обратимыми, т.е. могут протекать в двух направлениях. Скорость реакции: v=v1-v2 Различают практически необратимые и совершенно необратимые реакции. Практически необратимые – реакции, в результате которых образуется осадок. Совершенно необратимые – протекают только в одном направлении. Пример. 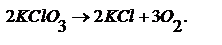
30.Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса. Энергия активации химической реакции. Аналитический и графический метод расчета. Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило: При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза. Уравнение, которое описывает это правило, следующее: 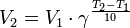 Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле: 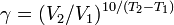 Уравне́ние Арре́ниуса устанавливает зависимость константы скорости k химической реакции от температуры T.Согласно простой модели столкновений, химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции. Необходимо преодолеть определённый энергетический барьер, чтобы молекулы начали друг с другом реагировать. То есть молекулы должны обладать некой минимальной энергией (энергия активации
Уравне́ние Арре́ниуса устанавливает зависимость константы скорости k химической реакции от температуры T.Согласно простой модели столкновений, химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции. Необходимо преодолеть определённый энергетический барьер, чтобы молекулы начали друг с другом реагировать. То есть молекулы должны обладать некой минимальной энергией (энергия активации 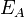 ), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией
), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией 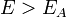 , пропорционально
, пропорционально 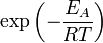 . В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений:
. В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусом из термодинамических соображений: 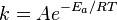 Здесь A характеризует частоту столкновений реагирующих молекул, R — универсальная газовая постоянная. В рамках теории активных соударений A зависит от температуры, но эта зависимость достаточно медленная:
Здесь A характеризует частоту столкновений реагирующих молекул, R — универсальная газовая постоянная. В рамках теории активных соударений A зависит от температуры, но эта зависимость достаточно медленная: 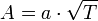 Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений на 10 %. Энергия активации — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция. Типичное обозначение энергии реакции - Ea. Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции:
Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений на 10 %. Энергия активации — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоулях на моль), чтобы произошла реакция. Типичное обозначение энергии реакции - Ea. Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции: 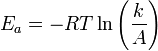 . С повышением температуры растёт вероятность преодоления энергетического барьера. Уравнение Аррениуса часто представляют в логарифмической форме: lnk = lnА – Еа\RT удобной для графического определения энергии. Необходимо иметь несколько значений k при разных T, чтобы построить график ln k = f(T).
. С повышением температуры растёт вероятность преодоления энергетического барьера. Уравнение Аррениуса часто представляют в логарифмической форме: lnk = lnА – Еа\RT удобной для графического определения энергии. Необходимо иметь несколько значений k при разных T, чтобы построить график ln k = f(T).
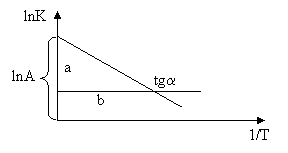 Здесь tg a =
Здесь tg a = 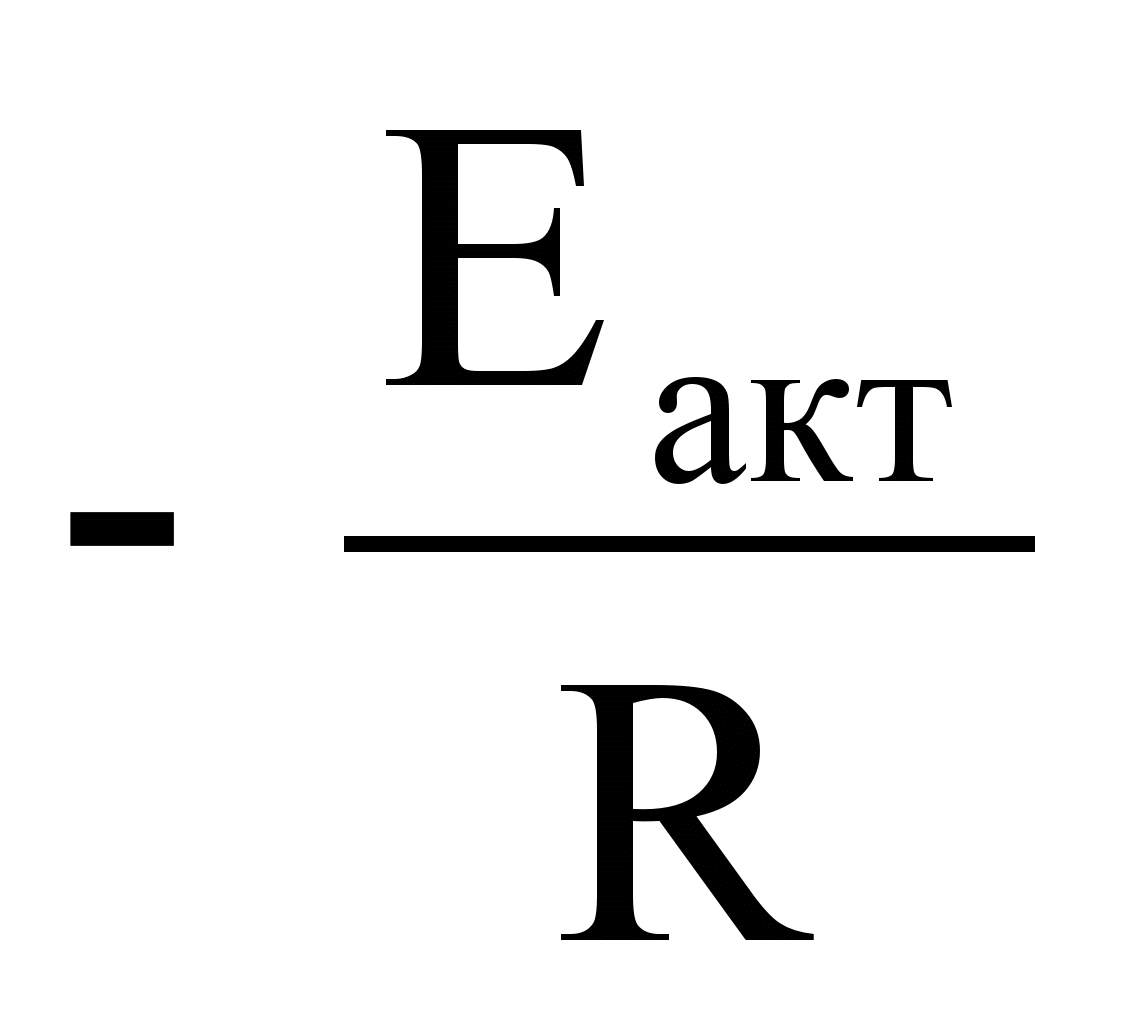 .
.
Аналитический метод определения энергии активации применим, если есть возможность определить две константы скорости при двух температурах.
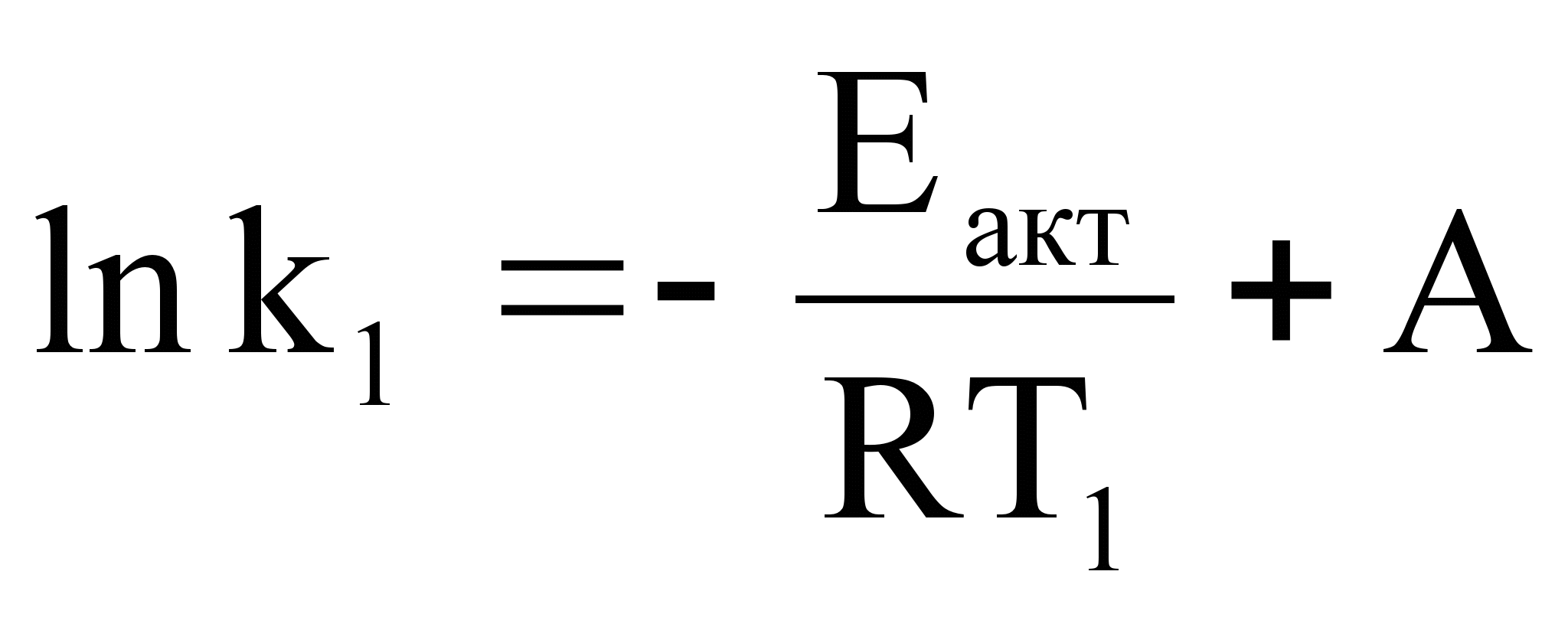 ;
; 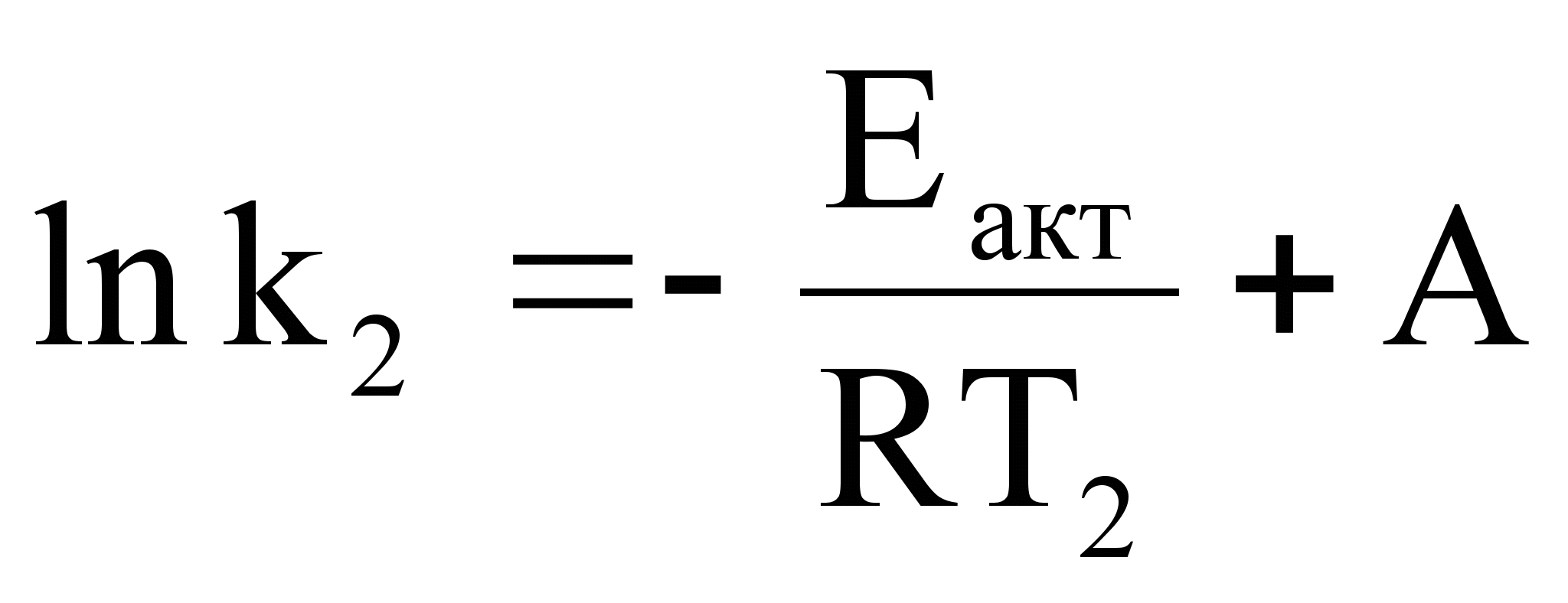
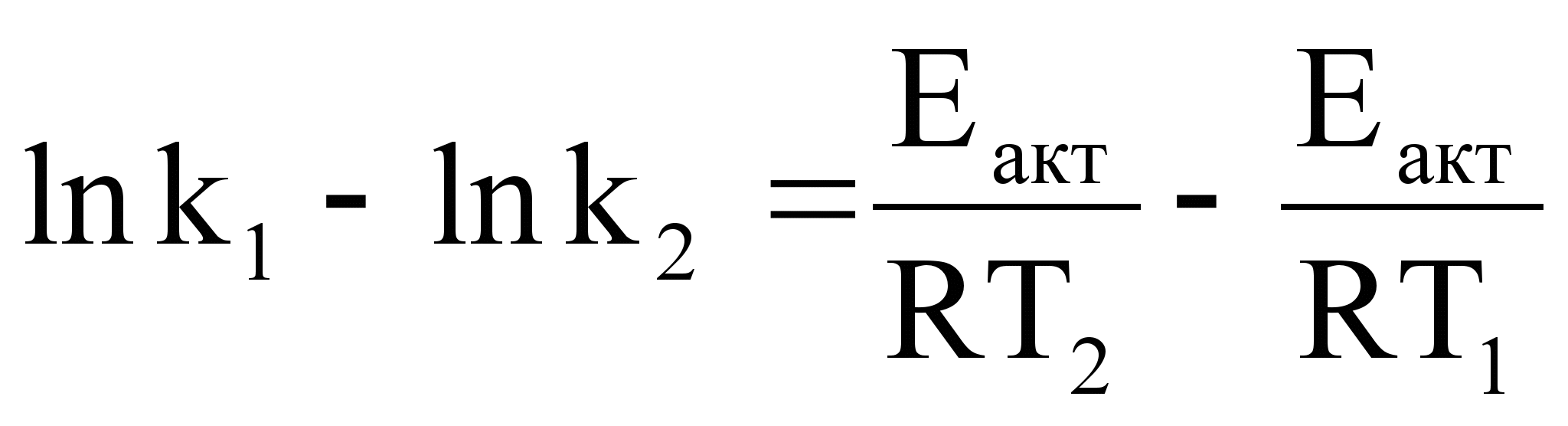 ;
;