Пероксид водорода.
H 2 O 2
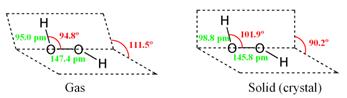
Это бесцветная неустойчивая жидкость, существует только в виде раствора в воде. Ее концентрированный раствор (30%) взрывоопасен и называется пергидролем.
Получение пероксида водорода:
Гидролиз пероксидов металлов водой или кислотами:
BaO2+H2SO4=H2O2+BaSO4↓
Химические свойства:Пероксид водорода может быть как окислителем, так и восстановителем.
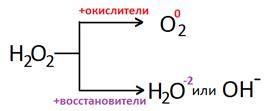 a ) Окислительные свойства более характерны – реагирует с восстановителями, при этом переходит в Н2О или ОН-
Na2S+4O3 + H2O2 = Na2S+6O4 + H2O (неметаллы в промежуточной степени окисления окисляет в высшую степень окисления)
Fe(OH)2 + H2O2à Fe(OH)3
2KI + H2O2 + H2SO4à I2 + K2SO4 + 2H2O
PbS + 4H2O2àPbSO4 + 4H2O (сульфиды переходят в сульфаты)
2Cr+3Cl3 + 3H2O2 + 10KOHà 2K2Cr+6O4 + 6KCl + 8H2O (любые соединения хрома +3 окисляет в +6)
b ) Восстановительные свойства – реагирует с сильными окислителями и переходит в О2:
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5O2 + 8H2O
K2Cr2O7 + 3H2O2 + 4H2SO4 = Cr2(SO4)3 + K2SO4 + 3O 2 + 7H2O
СаОСl2 + H2O2 = CaCl2 + O 2 + H2O
хлорная известь
с) Разложение пероксида водорода – это реакция диспропорционирования:
2H2O2 –tà 2H2O + O2.
Реакцию проводят в присутствии катализатора MnO2.
a ) Окислительные свойства более характерны – реагирует с восстановителями, при этом переходит в Н2О или ОН-
Na2S+4O3 + H2O2 = Na2S+6O4 + H2O (неметаллы в промежуточной степени окисления окисляет в высшую степень окисления)
Fe(OH)2 + H2O2à Fe(OH)3
2KI + H2O2 + H2SO4à I2 + K2SO4 + 2H2O
PbS + 4H2O2àPbSO4 + 4H2O (сульфиды переходят в сульфаты)
2Cr+3Cl3 + 3H2O2 + 10KOHà 2K2Cr+6O4 + 6KCl + 8H2O (любые соединения хрома +3 окисляет в +6)
b ) Восстановительные свойства – реагирует с сильными окислителями и переходит в О2:
2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5O2 + 8H2O
K2Cr2O7 + 3H2O2 + 4H2SO4 = Cr2(SO4)3 + K2SO4 + 3O 2 + 7H2O
СаОСl2 + H2O2 = CaCl2 + O 2 + H2O
хлорная известь
с) Разложение пероксида водорода – это реакция диспропорционирования:
2H2O2 –tà 2H2O + O2.
Реакцию проводят в присутствии катализатора MnO2.
|
Пероксиды и надпероксиды металлов . Ионные соединения
Получение:
а) Горение щелочных металлов (кроме лития) приводит к образованию пероксида натрия и надпероксидов (в смеси с пероксидами) более активных щелочных металлов:
Na + O2 = Na2O2
или
K + O2 = KO2
б) оксиды металлов + кислород Na2O + O2 = Na2O2K2O + O2 = KO2
Свойства:
1) Разлагаются водой:
Без нагревания образуется пероксид водорода:
Na2O2 + H2O = H2O2 + 2NaOH;
при нагревании выделяется кислород:
Na2O2 + H2O = O2 + 2NaOH;
К2O2 + H2O = H2O2 + О2 + КOH (образуется пероксид водорода и кислород)
2) Сильные окислители: KO2 + Al = KAlO2
3) Могут быть восстановителями в реакциях с окислителями:
2KMnO4 + 5Na2O2 + 8H2SO4 = 2MnSO4 + K2SO4 + 5Na2SO4 + 5O2 + 8H2O
4) Взаимодействуют с углекислым газом: Na2O2 + CO2 = Na2CO3 + O2
Эта реакция используется для регенерации кислорода в подводных лодках, например.








