Применение водорода
ВОДОРОД.
Атом водорода в электронной оболочке имеет всего 1 электрон на 1s-орбитали.
H 1s1 
| Характерные степени окисления: +1 и -1 | Водород – легкий газ без цвета, без запаха. |
Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью: Н – Н или Н:Н
ИЗОТОПЫ ВОДОРОДА:
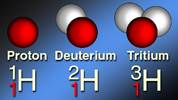
| Протий Н - в ядре только 1 протон | Дейтерий D - в ядре 1 протон и 1 нейтрон. Радиоактивный изотоп. | Тритий Т - в ядре 1 протон и 2 нейтрона. Очень нестабильный изотоп. |
ПОЛУЧЕНИЕ ВОДОРОДА:
| 1.В промышленности: а) Конверсионный способ. Вначале получают водяной газ, пропуская пары воды через раскаленный кокс при 1000 °С: С + Н2О -tà СО + Н2. Затем оксид углерода (II) окисляют в оксид углерода (IV), пропуская смесь водяного газа с избытком паров воды над нагретым до 400–450 °С катализатором Fe2O3: CO +H2O = CO2 + H2. б) Окисление метана водяным паром: CH4 + 2Н2O –(t, Ni)à4Н2 + CO2 Термическое разложение метана при 1200 °С: CH4 -tàC + 2H2 в) Электролиз водного раствора поваренной соли или гидроксида натрия: (NaOH) + 2Н2O –эл.токà 2Н2 + O2 2NaCl + 2H2O –эл.токàH2 + Cl2 + 2NaOH; 2. В лаборатории: Металлы (в ряду активности левее Н) с минеральными кислотами: Zn + 2HClàZnCl2 + Н2 Амфотерные металлы (кроме хрома и железа) со щелочами: 2Al + 2NaOH + 6H2O =2Na[Al(OH)4]+ 3H2 |
Свойства:
1. С активными металлами (щелочными, кальцием, стронием и барием) образует гидриды:
Н2 + 2Na -tà2NaH Н2 + Са -tà СаН2
2. С неметаллами: не реагирует с кремнием, плохо в специальных условиях реагирует с фосфором и углеродом: а) Идут легко, без катализаторов:
| 2Н2 + O2à 2Н2O | Н2 + Cl2 -hvà 2HCl | H2 + SàH2S |
Б) Только в присутствии катализатора, при высоком давлении и температуре:
3Н2 + N2 -t, p, кат.à 2NH3
3. Восстановление оксидов металлов (неактивных) и неметаллов(кроме серы, фосфора):
CuO + H2àCu + H2O (металл не должен реагировать с водой)
2NO + 2H2àN2 + 2H2O (с любым оксидом азота)
SiO2 + H2–(t)àSi + H2O
СО + 2Н2⇄ СН3ОН (катализатор, температура, давление)
4. C органическими веществами: реакция гидрирования веществ,имеющих кратные связи.
Применение водорода
Применение водорода основано на его физических и химических свойствах:
-как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
-кислородно-водородное пламя применяется для получения высоких температур при сварки металлов;
-как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
-для получения аммиака и искусственного жидкого топлива, для гидрогенизации жиров.
Водородные соединения металлов и неметаллов.
1. Ионные гидриды активных металлов: твёрдые вещества белого цвета.
Получение: Н2 + 2Na -tà2NaH
Свойства: 1) разлагаются водой и кислотами:
| NaH + Н2O àNaOH + Н2 | СаН2 + 2HCl à CaCl2 + 2Н2 |
2) окисляются кислородом, галогенами, другими окислителями:
| 2NaH + O2 = 2NaOH | NaH + Cl2 = NaCl + HCl |
2. Ковалентные летучие водородные соединения:
Физические свойства: Все имеют газообразное состояние, кроме воды.
| CH4- метан | NH3-аммиак | H2O - вода | HF –фтороводород |
| SiH4 - силан | PH3 - фосфин | H2S - сероводород | HCl - хлороводород |
| AsH3 - арсин | H2Se - селеноводород | HBr – бромоводород | |
| H2Te - теллуроводород | HI - йодоводород |
Неустойчивые водородные соединения (воспламеняются на воздухе) : фосфин и силан.
Основными свойствами обладает: аммиак.
Амфотерные свойства проявляет: вода.
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Получение:
1) Из простых веществ (кроме силана, фосфина)
| H2 + Cl2 = 2HCl +Q | 3H2 + N2(t,p,kat) ⇄ 2NH3 +Q |
2) Из бинарных соединений неметаллов с активными металлами – гидролиз водой или слабыми растворами кислот-неокислителей: Mg3P2 + H2O = PH3 + Mg(OH)2
3) Аммиак получают вытеснением щелочью из солей аммония: NH4Cl + NaOH = NH3 + NaCl + H2O
Свойства летучих водородных соединений сильно различаются.
1) Галогеноводороды – проявляют все свойства кислот.
2) Аммиак имеет свойства основания, реагирует с кислотами, образуя соли.
3) Фосфин и силан – неустойчивы на воздухе, самовоспламеняются: РН3 + О2 = Р2О5 + Н2О
4) Метан – не проявляет кислотно-основных свойств.
5) Все водородные соединения неметаллов, кроме HF – хорошие восстановители, реагируют с различными окислителями:
| H2S + Cl2 = 2HCl + S | 2HI + H2O2 = I2 + 2H2O |
Вода .
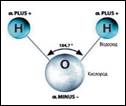
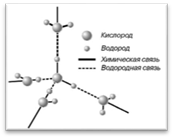
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
СВОЙСТВА
1. Реагирует с металлами, левее Н в ряду активности:
а) с щелочными и щелочноземельными (кроме бериллия и магния) при комнатной температуре, образуя щелочи: 2Na + 2Н2O = 2NaOH + Н2
б) с магнием реагирует при кипячении: Mg + 2H2O –tàMg(OH)2 + H2
в) алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид: 2Al + 6H2O = 2Al(OH)3 +3H2
г) остальные металлы в ряду активности до Н реагируют с водяным паром при высокой температуре, образуя оксиды и водород: Fe + 4Н2O(пар) -tàFe3O4 + 4Н2
2. Реагирует с оксидами щелочных и щелочноземельных металлов, образуя щелочи (с оксидом магния – при кипячении): Н2O + СаО = Са(OH)2
3. Взаимодействует с кислотными оксидами (кроме SiO2): P2O5 + 3H2O = 2H3PO4.
4. Гидролиз солей, бинарных соединений металлов и неметаллов:
2CuSO4 + 2Н2O ⇄ (CuOH)2SO4 + H2SO4 Al2S3 + 6H2O à 2Al(OH)3 + 3H2S
Са3Р2 + 6Н2О à 3Са(ОН)2 + 2РН3↑PCl5 + 4H2OàH3PO4 + 5HCl
5. С органическими веществами – вступает в реакции присоединения (гидратации), гидролиза.
КИСЛОРОД
Самый распространенный элемент на Земле: в воздухе – 21% по объему; в земной коре – 49% по массе; в гидросфере – 89% по массе; в составе живых организмов – до 65% по массе.
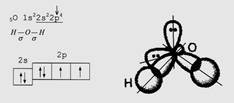
Атом: порядковый № 8, электронное строение: 1s22s22p4
1s 2s 2p
Валентность: II (в СО – валентность IIIзасчётдонорно-акцепторной связи). Степени окисления: 1) -2 – оксиды, гидроксиды, соли 2) -1 – пероксиды 3) -1/2, -1/3 – надпероксиды и озониды 4) +2 (OF2), +1 (O2F2) Электроотрицательность: ЭО = 3,5. Изотопы природного кислорода:
| Физические свойства:
Кислород – газ без цвета, вкуса и запаха, немного тяжелее воздуха. Плохо растворим в воде. Жидкий кислород – голубоватая жидкость, кипящая при -1830С.
Притягивается магнитом.
Твердый кислород – синие кристаллы, плавящиеся при -218,7оС.
Строение молекулы:
Молекула состоит из двух атомов, связанных двойной связью. Связь – ковалентная неполярная.
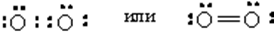 Аллотропные модификации:
О2 и О3 (озон).
Аллотропные модификации:
О2 и О3 (озон).
| ||||||||
| СПОСОБЫ ПОЛУЧЕНИЯ. | |||||||||
| 1. Промышленный способ: перегонка жидкого воздуха.
2. Лабораторный способ: разложение некоторых кислородосодержащих веществ Перманганата калия: 2KMnO4=K2MnO4+ MnO2 + O2 Бертолетовой соли: 2KClO3 –t;MnO2à2KCl + 3O2 Пероксида водорода: 2H2O2 –MnO2à2H2O + O2 Оксида ртути (исторический способ получения): 2HgO à 2Hg + O2 Разложение нитратов щелочных металлов: 2KNO3à 2KNO2 + O2
Способы собирания кислорода:так как кислород почти не растворяется в воде, то его можно собирать вытеснением воды; а так как он тяжелее воздуха, то можно собирать вытеснением воздуха, но в сосуд, повёрнутый вниз дном.
| |||||||||
| Химические свойства |
| 1. С неметаллами: кроме галогенов,He, Ne и Ar. Образуются оксиды. 1) углерод, фосфор, мышьяк: в зависимости от количества кислорода получаются разные оксиды: C + O2(изб)=CO2; C+ O2(нед) = CO 2) Сера сгорает до сернистого газа: S + O2 = SO2 2. С металлами: образуются в основном оксиды 1) натрий образует пероксид:Na + O2 = Na2O2 2) Калий, рубидий, цезий – надпероксиды: K + O2 = KO2 3) железо – образует оксид Fe3O4 или Fe2O3 4) марганец – MnO2 3. Со сложными веществами: 1) Горение и обжиг сульфидов, водородных соединений: 4FeS2 +11O2 = 2Fe2O3 + 8SO2 2H2S + 3O2 = 2SO2 + 2H2O CH4 + 2O2 = CO2 + 2H2O 2) Окисление низших оксидов до высших: FeO + O2 = Fe2O3; CO + O2 = CO2 3) Окисление гидроксидов и солей в водных растворах: если вещество неустойчиво на воздухе. 2HNO2 + O2à 2HNO3 4Fe(OH)2 + O2 + 2H2Oà 4Fe(OH)3 4) Окисление в присутствии катализаторов: а) аммиака NH3 + O2 (kat) à NO + H2O б) органических веществ: С2Н5ОН + О2 –Cu,tàCH3-COH (альдегид) и т.п. |
ОЗОН O 3
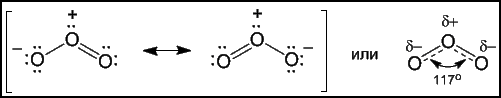
Это аллотропная модификация кислорода.
Физические свойства: газ, бесцветный, с характерным запахом.
ПОЛУЧЕНИЕ:
1) Озонирование воздуха: 3O2 ⇄ 2O3 В лаборатории – в озонаторе.
2) Во время грозы (в природе),
ХИМИЧЕСКИЕ СВОЙСТВА:
1. Озон - неустойчив, легко распадается: O 3 à O 2 + O ·
При этом образуется атомарный кислород, очень сильный окислитель. Обесцвечивает красящие вещества, отражает УФ - лучи, уничтожает микроорганизмы.
2. Сильный окислитель, сильнее кислорода: 6NO2+O3à3N2O53PbS+4O3à 3PbSO4
3. Качественная реакция на озон: реакция с иодидом калия; появляется желто-коричневая окраска йода: 2KI + O3 + H2O =2KOH + I2 + O2