Первый закон термодинамики
1. Основные понятия и определения технической термодинамики.
Теплотехника – наука, которая изучает методы получения, преобразования, передачи и использования теплоты, а также принципы действия и конструктивные особенности тепло - и парогенераторов, тепловых машин, аппаратов и устройств.
Различают два принципиально различных направления использования теплоты – энергетическое и технологическое.
При энергетическом использовании, теплота преобразуется в механическую работу, с помощью которой в специальных установках (генераторах) создается электрическая энергия, наиболее удобная для передачи на значительное расстояние. Теплоту при этом получают сжиганием топлива в котельных установках или непосредственно в двигателях внутреннего сгорания.
При технологическом использовании тепловой энергии она используется для направленного изменения механических, физических или химических свойств различных тел (расплавления, затвердевания, изменения структуры и т. п.).
Термодинамика - наука, изучающая энергию и законы ее превращения из одного вида в другой. Изучение основ термодинамики позволяет понимать принципы работы тепловых двигателей (паровых машин, двигателей внутреннего сгорания), тепловых насосов, холодильной техники, кондиционеров и других устройств.
Термодинамическая система-это совокупность тел, находящихся во взаимодействии, как между собой, так и с окружающей средой. Простым примером термодинамической системы может служить газ, расширяющийся или сжимающийся в цилиндре с движущимся поршнем.
2. Законы термодинамики.
Первый закон термодинамики
Абсолютный по своему существу, один из наиболее общих законов природы – закон сохранения и превращения энергии. Согласно этому закону, энергия закрытой системы при любых процессах, происходящих в системе, остается неизменной. При этом энергия может только превращаться из одной формы в другую.
Первый закон термодинамики является частным случаем этого всеобщего закона и представляет собой его приложение к процессам в термодинамических системах. Он устанавливает возможность превращения различных форм энергии друг в друга и определяет, в каких количественных соотношениях эти взаимные превращения осуществляются.
Изменение энергии произвольной неизолированной системы может происходить в общем случае только за счет двух форм энергообмена – теплоты и работы:
∆E = Q –L , (1.12)
где ∆ E – изменение энергии системы;
Q – теплота, подведенная к системе;
L – работа, совершенная над системой.
Согласно уравнению (1.12), изменение энергии термодинамической системы возможно за счет подведенной к системе теплоты и совершенной над системой работой.
Значение первого закона:
во-первых, он формирует принцип устройства теплоэнергетических установок и систем;
во-вторых, он объясняет физическую сущность процессов, происходящих в тепловых машинах;
в-третьих, он используется при расчетах термодинамических процессов и позволяет оценить энергетический баланс тепловых машин.
Второй закон термодинамики.
1. Для превращения теплоты в механическую работу необходимо иметь источник теплоты и холодильник, температура которого ниже температуры источника, т. е. необходим температурный перепад.
2. Нельзя осуществить тепловой двигатель, единственным результатом действия которого было бы превращение теплоты какого-либо тела в работу без того, чтобы часть теплоты не передавалась другим телам.
Из этой формулировки можно сделать вывод, что невозможно построить вечный двигатель, совершающий работу благодаря лишь одному источнику теплоты, поскольку любой, даже самый колоссальный источник теплоты в виде материального тела не способен отдать тепловой энергии больше, чем ему позволяет энтальпия (часть полной энергии тела, которую можно превратить в теплоту, охладив тело до температуры абсолютного нуля).
3. Теплота не может сама по себе переходить от менее нагретого тела к более нагретому без затраты внешней работы.
Второй закон термодинамики не имеет в своей основе формулярного содержания, а лишь описывает условия, при которых возможны те или иные термодинамические явления и процессы, подтверждая, по сути, общий закон сохранения энергии.
3. Параметры и функции состояния рабочего тела. Приборы для измерения параметров состояния рабочего тела.
1. Основные параметры состояния рабочего тела.
Сюда относят давление, объем (удельный), температуру.
1.1. Объем. Удельный объем.
V [м ³]-объем.
Ư [м ³ / кг]-удельный объем.
Ư = 1 / ρ; ρ-плотность.
1.2. Давление.
Р [Па]-давление. Различают абсолютный (полный) давление, избыточное (манометрическое) давление, атмосферное (барометрическое) давление, вакуум.
Давление-это сила в 1Н, действующая на площадь 1м ² [Па] = [Н / м ²]
Существует следующие соотношения между давлениями:
Рабс. = Рнад. + Ратмосф; Рпов. = Рманом. + Рбаром.; Рабс. = Ратмосф.-Рвак.; Рпов. = Рбаром. -Рвак.
Существует следующее соотношение между единицами измерения давлений:
1тех.атм. = 1кг/см ² = 9,8 • 104Па = 10м.вод.ст. = 735мм.рт.ст. 0,1 МПа 1Бар.
1Бар = 750мм.рт.ст.
1физ.атмосф. = 760мм.рт.ст.
1.3. Температура.
Т [К]; t [º C].
Температура-степень нагрева тела. Определяют по шкалам Кельвина и Цельсия. Температура тела изменяется пропорционально кинетической энергии движения его молекул. Т (f) = (mƯ2) / 2, где m-масса молекулы, кг Ư-скорость движения молекул, м / с.
Общее между шкалами Кельвина и Цельсия-цена делений шкал, или разница температур, или темп падения или роста температуры. За начало отсчета по шкале Цельсия принята температура, соответствующая тройном состояния воды при нормальном атмосферном давлении. Тройной стан-смесь воды, льда, водяного пара. За начало отсчета по шкале Кельвина принята температура абсолютного нуля, при которой прекращается тепловое движение молекул, тело перестает существовать, распадается. Все температуры по шкале Кельвина положительные. Верно следующее соотношение между температурами: Т = t +273,15.
4. Основные термодинамические процессы. Термодинамический цикл.
| Изобарный процесс | Изотермический процесс | Адиабатный процесс | Изохорный процесс |
| p constНа p v − диаграмме изобарный процесс изображается прямой линией параллельной оси абсцисс. Если газ в процессе испытывает расширение, то его работа положительна, если в сторону сжатия, то отрицательна | T const На p v − диаграмме кривая процесса представляется уравнением pv const = , т.е. гиперболой, для которой оси координат являются асимптотами. Вся подведенная теплота превращается в работу расширения газа и обратно, вся работа, затраченная на сжатие газа, должна быть отведена в окружающую среду в форме теплоты. | pv constАдиабата, представляя собой гиперболу высшего порядка (так как k 1 > ), на p v − диаграмме изображается более крутой кривой, чем изотерма. В этом процессе вся совершаемая газом работа получается за счет уменьшения его внутренней энергии и, наоборот, вся работа, затраченная на сжатие газа, идет на увеличение внутренней энергии. | v constНа p v − диаграмме изохора представляется прямой, параллельной оси давлений. Направление процесса из начальной точки характеризует увеличение внутренней энергии и нагрев газа, а вниз - охлаждение путем отвода теплоты в окружающую среду. |
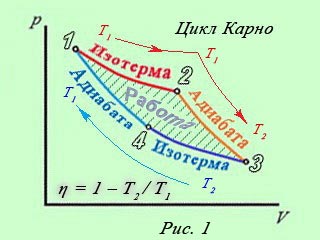
Термодинамический цикл Карно
В термодинамике цикл Карно́ или процесс Карно — это обратимый круговой процесс, состоящий из двух адиабатических и двух изотермических процессов[1]. В процессе Карно термодинамическая система выполняет механическую работу и обменивается теплотой с двумя тепловыми резервуарами, имеющими постоянные, но различающиеся температуры. Резервуар с более высокой температурой называется нагревателем, а с более низкой температурой — холодильником
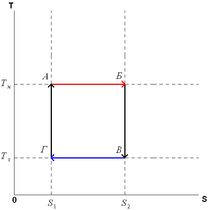
Цикл Карно состоит из четырёх обратимых стадий, две из которых осуществляются при постоянной температуре (изотермически), а две — при постоянной энтропии (адиабатически). Поэтому цикл Карно удобно представить в координатах T (температура) и S (энтропия).
5. T-S, i-S диаграммы воды и водяного пара. Процессы изменения состояния водяного пара.
6. Функции процесса. Графические изображение тепла и работы.
Функции процесса
Функции процесса зависят не только от текущего состояния системы, но также и от пути, по которому система пришла в данное состояние.
Функции процесса в термодинамике включают:
-количество теплоты
-термодинамическую работу.
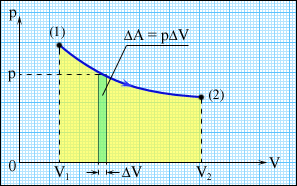
Для этого строят диаграммы. Надиаграмме, приведенной на рис.3.2, точки 1 и 2 характеризуютначальное и конечное состояния системы, Термодинамический процесс изображается кривой . Элементарная работа  определяется площадью узкой голубой полоски на рисунке. Работа, совершаемая системой в процессе , равная , измеряется площадью под кривой .Из рисунка видно, что величина работы  зависит от того, каким образом система переходит из начального состояния в конечное, т. е. от вида процесса .
7. Сжатие газа в компрессоре.
Одноступенчатый компрессор представляет собой цилиндр 3 с поршнем 4, перемещаемым с помощью кривошипно-шатунного механизма 5. В крышке цилиндра установлены автоматические впускной 1 и выпускной 2 клапаны. При движении поршня от верхней мертвой точки вниз в цилиндре возникает разрежение, открывается впускной клапан и происходит всасывание очередной порции газа с давлением р1 в цилиндр. Как только направление движения поршня меняется на противоположное, впускной клапан закрывается и начинается сжатие газа. Когда давление газа в цилиндре достигнет определенной величины р2, открывается выпускной клапан и сжатый газ выталкивается потребителю.Идеальным называют компрессор, способный (в отличие от реального случая) вытолкнуть весь сжатый в цилиндре газ. Рассмотрим индикаторную диаграмму идеального компрессора:
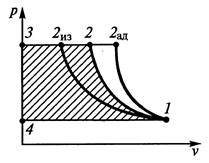
Здесь линия 1–2 изображает процесс сжатия газа в цилиндре, линия 2–3 – выталкивание сжатого газа, а линия 4–1 – всасывание газа в цилиндр. Отметим, что во время всасывания и выталкивания состояния газа не меняются (параметры р и Т газа остаются неизменными), меняется лишь масса газа в цилиндре, т.е. происходит перемещение газа без изменения его внутренней энергии. Работа на компрессирование 1 кг газа lКопределяется заштрихованной площадью индикаторной диаграммы.
8. Схема двухступенчатого компрессора. Диаграмма процесса сжатия.
Многоступенчатый компрессор применяется для получения сжатого газа высокого давления. Сжатие газа в нем осуществляется в нескольких ступенях с промежуточным охлаждением сжимаемого газа между ступенями. Охлаждение газа после каждой ступени производится при постоянном давлении.
Многоступенчатое сжатие газа позволяет:
· снизить температуру газа в конце сжатия, применяя промежуточное охлаждение, и обеспечить надежную эксплуатацию компрессора;
· понизить мощность, идущую на привод компрессора, за счет работы, сэкономленной при охлаждении газа в холодильнике.
На рис. 9.8, а дана схема двухступенчатого компрессора, а на рис. 9.8, б представлена рV-диаграмма процесса сжатия газа в обеих ступенях такого компрессора.
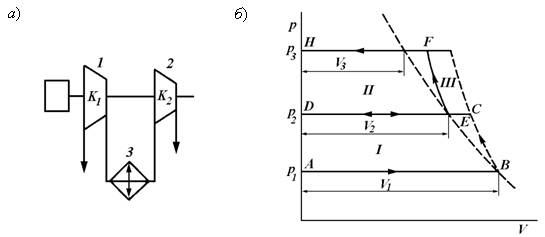
Рис. 9.8. Схема двухступенчатого компрессора (а) и рV-диаграмма процесса сжатия газа в обеих ступенях компрессора (б)
Рассмотрим рV-диаграмму двухступенчатого компрессора (рис. 9.8). Здесь А–В – всасывание газа в первую ступень; В–С – политропное сжатие в первой ступени; C–D – процесс выталкивания газа из первой ступени; D–C – процесс поступления газа в холодильник; C-Е – процесс охлаждения в холодильнике; E–D – процесс выталкивания газа из холодильника; D–E – процесс всасывания газа во вторую ступень; E–F – политропное сжатие газа во второй ступени; F–H – процесс нагнетания газа из второй ступени к потребителю; пл. I – работа сжатия газа в первой ступени; пл. II – работа сжатия газа во второй ступени; пл. III – работа, сэкономленная при охлаждении газа в холодильнике.
9. Циклы тепловых двигателей и установок. Обобщенный цикл ТД: параметры и диаграмма.








