УДФ-глюкоза + гликоген (n) → гликоген (n+1) + УДФ, где n ≥ 4-6.
УДФ-глюкоза взаимодействует с нередуцированным остатком цепи. Ветвление гликогена осуществляется ферментом амило-1,4-1,6-глюкозилтрансферазой («гликогенветвящий» фермент). Этот фермент присоединяет полисахаридную цепочку (n ≥7) с помощью α-1,6-гликозидной связи (точка ветвления). В месте ветвления находится 10-12 остатков глюкозы, от ближайшего места ветвления не менее 4 остатков глюкозы.
Значение ветвления: увеличивается растворимость, ускоряется рост полисахаридной цепи.
59. Регуляция углеводного обмена: саморегуляция, нейрогуморальная регуляция. Механизм действия глюкозы, адреналина, инсулина и глюкокортикоидов на обмен углеводов. Уровень глюкозы крови в норме. Гипергликемия и гипогликемия. Нарушения обмена углеводов при сахарном диабете. Биохимическая диагностика сахарного диабета
В регуляции постоянства концентрации сахара в крови главную роль выполняет печень. При избыточном поступлении углеводов в организм в печени происходит накопление гликогена, а при недостаточном поступлении, наоборот, гликоген, в ней распадается до глюкозы. Таким образом поддерживается нормальное количество сахара. Постоянство содержания глюкозы в крови, гликогена в печени регулируется нервной системой. На обмен углеводов оказывает влияние кора больших полушарий головного мозга. Доказательством этого является повышение сахара в моче у студентов после трудного экзамена. Центр углеводного обмена находится в гипотоламусе и продолговатом мозге. Влияние гипоталамуса и коры больших полушарий на углеводный обмен осуществляется преимущественно посредством симпатической нервной системы, которая вызывает усиленную секрецию адреналина надпочечниками. Большое значение в углеводном обмене имеют железы внутренней секреции — поджелудочная, щитовидная, надпочечники, гипофиз и др., которые под действием ЦНС регулируют ассимиляцию и диссимиляцию углеводов. Гормон поджелудочной железы инсулин переводит глюкозу в гликоген и тем самым уменьшает количество сахара в крови. Адреналин и гликогон увеличивают расщепление гликогена в печени, в мышцах, вследствие чего увеличивается содержание сахара в крови. Следовательно, инсулин — это сахаропонижающий гормон, гликогон — сахароповышающий. При снижении концентрации сахара в крови возбуждается центр углеводного обмена в гипоталамусе, который дает импульсы поджелудочной железе, и она увеличивает выработку глюкагона до тех пор, пока содержание глюкозы за счет распада гликогена не увеличится до нормального уровня.
60. Лабильность уровня глюкозы в крови у детей раннего возраста. Наклонность к гипогликемии. Своеобразие учета результатов нагрузной пробой сахара у детей.
Нарушение углеводного обмена. Сахарный диабет. Важным показателем гомеостаза является концентрация глюкозы в крови. В норме концентрация глюкозы в крови 3,3 – 5,5 ммоль/л. Больше 5,5 ммоль/л – гипергликемия. В норме сахар в моче отсутствует. Почечный порог для глюкозы – 10 ммоль/л или 180 мг% в крови. Для уточнения диагноза сахарный диабет проводят тест на толерантность к глюкозе. Тест на толерантность к глюкозе (метод сахарной нагрузки). Перед проведением теста в течение 3-х дней рекомендуется низкоуглеводная диета. В день анализа пациенту натощак дают выпить раствор 100 г глюкозы/100 мл воды. Концентрацию глюкозы определяют в трех пробах крови: натощак, через 60 и через 120 минут после «Сахарной нагрузки». Результат на фоне здоровья: натощак менее 5,55 ммоль/л, через 60 мин. – менее 8,88 ммоль/л, через 120 мин. – менее 6,66 ммоль/л. На основе полученных данных строят «сахарные кривые»: Особенности сахарной нагрузки у детей. До 6 лет дают 1,5 г/кг веса, от 6 до 12 – 2 г/кг веса, после 13 лет по 2,5 г/кг веса. Наличие гипергликемии через 2 часа после начала исследования, глюкозурия и обнаружение кетоновых тел в моче – триада симптомов для постановки диагноза сахарный диабет. Содержание глюкозы в моче определяют пробой Бенедикта.
61. Пищевые жиры, их гидролиз. Всасывание продуктов переваривания. Роль желчных пигментов в переваривании и всасывании липидов. Транспорт ресинтезированных в кишечнике жиров. Использование жиров, включенных в транспортные липопротеины: липопротеинлипазы. Гиперлипопротеинемия.
Жиры, или триглицериды — природные органические соединения, полные сложные эфиры глицерина и одноосновных жирных кислот; входят в класс липидов. В живых организмах выполняют структурную, энергетическую и др. функции. Наряду с углеводами и белками, жиры — один из главных компонентов питания. Жидкие жиры растительного происхождения обычно называют маслами. Гидролиз жиров. Расщепление жиров на глицерин и жирные кислоты проводится обработкой их щёлочью — (едким натром), перегретым паром, иногда — минеральными кислотами. Этот процесс называется омылением. Липопротеинлипаза — фермент, относящийся к классу липаз. ЛПЛ расщепляет триглицериды самых крупных по размеру и богатых липидами липопротеинов плазмы крови — хиломикронов и липопротеинов очень низкой плотности (ЛПОНП или ЛОНП)). ЛПЛ регулирует уровень липидов в крови, что определяет её важное значение в атеросклерозе. Гиперлипидемия (гиперлипопротеинемия) — аномально повышенный уровень липидов и/или липопротеинов в крови человека. Нарушение обмена липидов и липопротеинов встречается довольно часто в общей популяции. Гиперлипидемия является важным фактором риска развития сердечно-сосудистых заболеваний в основном в связи со значительным влиянием холестерина на развитие атеросклероза. Кроме этого, некоторые гиперлипидемии влияют на развитие острого панкреатита.
62. Особенности переваривания и всасывания жиров в организме ребенка.
Расщепление триглицеридов в пищеварительном тракте. Слюна не содержит расщепляющих жиры ферментов. Следовательно, в полости рта жиры не подвергаются никаким изменениям. У взрослых людей жиры проходят через желудок также без особых изменений. В желудочном соке содержится липаза, получившая название желудочной, однако роль ее в гидролизе пищевых триглицеридов у взрослых людей невелика. Во-первых, в желудочном соке взрослого человека и других млекопитающих содержание липазы крайне низкое. Во-вторых, рН желудочного сока далек от оптимума действия этого фермента (оптимальное значение рН для желудочной липазы 5,5–7,5). Напомним, что значение рН желудочного сока около 1,5. В-третьих, в желудке отсутствуют условия для эмульгирования триглицеридов, а липаза может активно действовать только на триглицериды, находящиеся в форме эмульсии. Поэтому у взрослых неэмульгированные триглицериды, составляющие основную массу пищевого жира, проходят через желудок без особых изменений. Вместе с тем расщепление триглицеридов в желудке играет важную роль в пищеварении у детей, особенно грудного возраста. Слизистая оболочка корня языка и примыкающей к нему области глотки ребенка грудного возраста секретирует собственную липазу в ответ на сосательные и глотательные движения (при кормлении грудью). Эта липаза получила название лингвальной. Активность лингвальной липазы не успевает ≪проявиться≫ в полости рта, и основным местом ее воздействия является желудок. Оптимум рН лингвальной липазы в пределах 4,0–4,5; он близок к величине рН желудочного сока у таких детей. Лингвальная липаза наиболее активно действует на триглицериды, содержащие жирные кислоты с короткой и средней длиной цепи, что характерно для триглицеридов молока. Иными словами, жир молока – самый подходящий субстрат для этого энзима. У взрослых активность лингвальной липазы крайне низкая. Расщепление триглицеридов в желудке взрослого человека невелико, но оно в определенной степени облегчает последующее переваривание их в кишечнике. Даже незначительное по объему расщепление триглицеридов в желудке приводит к появлению свободных жирных кислот, которые, не подвергаясь всасыванию в желудке, поступают в кишечник и способствуют там эмульгированию жиров, облегчая таким образом воздействие на них липазы панкреатического сока. После того как химус попадает в двенадцатиперстную кишку, прежде всего происходит нейтрализация попавшей в кишечник с пищей соляной кислоты желудочного сока бикарбонатами, содержащимися в панкреатическом и кишечном соках. Выделяющиеся при разложении бикарбонатов пузырьки углекислого газа способствуют хорошему перемешиванию пищевой кашицы с пищеварительными соками. Одновременно начинается эмульгирование жира. Наиболее мощное эмульгирующее действие на жиры оказывают соли желчных кислот, попадающие в двенадцатиперстную кишку с желчью в виде натриевых солей. Большая часть желчных кислот конъюгирована с глицином или таурином. Желчные кислоты представляют собой основной конечный продукт метаболизма холестерина. В желчи человека в основном содержатся холевая (3,7,12-триоксихолановая), дезоксихолевая (3,12-диоксихолановая) и хенодезоксихолевая (3,7-диоксихолановая) кислоты (все гидроксильные группы имеют α-конфигурацию и поэтому обозначены пунктирной линией). Кроме того, в желчи человека в малых количествах содержатся литохолевая (3α-оксихолановая) кислота, а также аллохолевая и уреодезоксихолевая кислоты – стереоизомеры холевой и хенодезоксихолевой кислот. Как отмечалось, желчные кислоты присутствуют в желчи в конъюгированной форме, т.е. в виде гликохолевой, гликодезоксихолевой, гли- кохенодезоксихолевой (около 2/3 – 4/5 всех желчных кислот) или таурохолевой, тауродезоксихолевой и таурохенодезоксихолевой (около 1/5 – 1/3 всех желчных кислот) кислот. Эти соединения иногда называют парными желчными кислотами, так как они состоят из двух компонентов – желчной кислоты и глицина или таурина. Соотношения между конъюгатами обоих видов могут меняться в зависимости от характера пищи: в случае преобладания в ней углеводов увеличивается относительное содержание глициновых конъюгатов, а при высокобелковой диете – тауриновых конъюгатов. Считают, что только комбинация соль желчной кислоты + ненасыщенная жирная кислота + моноглицерид придает необходимую степень эмульгирования жира. Соли желчных кислот резко уменьшают поверхностное натяжение на поверхности раздела жир/вода, благодаря чему они не только облегчают эмульгирование, но и стабилизируют уже образовавшуюся эмульсию.
63. Химизм окисления жирных кислот, его связь с митохондриальным окислением. Энергетика окисления жирных кислот. Значение этого процесса для организма. Нарушение окисления жирных кислот при авитаминозах.
Окисление жирных кислот протекает в печени, почках, скелетных и сердечной мышцах, в жировой ткани. В мозговой ткани скорость окисления жирных кислот весьма незначительна; основным источником энергии в мозговой ткани служит глюкоза. Жирные кислоты, входящие в состав естественных жиров животных и растений, имеют четное число углеродных атомов. Любая такая кислота, от которой отщепляется по паре углеродных атомов, в конце концов проходит через стадию масляной кислоты. После очередного β-окисления масляная кислота становится ацетоуксусной. Последняя затем гидролизуется до двух молекул уксусной кислоты. Доставка жирных кислот к месту их окисления – к митохондриям – происходит сложным путем: при участии альбумина осуществляется транспорт жирной кислоты в клетку; при участии специальных белков – транспорт в пределах цитозоля; при участии карнитина – транспорт жирной кислоты из цитозоля в митохондрии. Процесс окисления жирных кислот складывается из следующих основных этапов. Активация жирных кислот. Свободная жирная кислота независимо от длины углеводородной цепи является метаболически инертной и не может подвергаться никаким биохимическим превращениям, в том числе окислению, пока не будет активирована. Активация жирной кислоты протекает на наружной поверхности мембраны митохондрий при участии АТФ, коэнзима A (HS-KoA) и ионов Mg2+. Реакция катализируется ферментом ацил-КоА- синтетазой:
R—COOH + HS-KoA + АТФ + R—CO—S-KoA + АМФ + РРi.
Жирная кислота Ацил-КоА-синтетаза
Транспорт жирных кислот внутрь митохондрий. Коэнзимная форма жирной кислоты, в равной мере как и свободные жирные кислоты, не обладает способностью проникать внутрь митохондрий, где, собственно, и протекает их окисление. Переносчиком активированных жирных кислотс длинной цепью через внутреннюю митохондриальную мембрану служит карнитин. Ацильная группа переносится с атома серы КоА на гидроксильную группу карнитина с образованием ацилкарнитина, который диффундирует через внутреннюю митохондриальную мембрану: Нарушение переноса жирных кислот в митохондрии. Скорость переноса жирных кислот внутрь митохондрий, а следовательно и скорбеть процесса р-окисления, зависит от доступности карнитина и скорости работы фермента карнитинацилтрансферазы I. р-Окисление могут нарушать следующие факторы:
- длительный гемодиализ, в ходе которого организм теряет карнитин;
- длительная ацидурия, при которой карнитин выводится как основание с органическими кислотами;
- лечение больных сахарным диабетом препаратами сульфонилмочевины, ингибирующими карнитинацилтрансферазу I;
- низкая активность ферментов, синтезирующих карнитин;
Невозможность использовать жирные кислоты как источники энергии приводит к увеличению скорости окисления глюкозы. В результате у детей развивается гипогликемия - причина внезапной детской смертности (10% от общего числа умерших новорождённых). Если такие дети выживают, то после голодания в течение 6-8 ч у них развиваются гипогликемические приступы (слабость, головокружение, рвота, потеря сознания). Введение глюкозы приводит к исчезновению симптомов. Во всех случаях, когда нарушается β-окисление, жирные кислоты накапливаются в клетках и распадаются по пути ω-окисления, которое в норме идёт с очень низкой скоростью. Окисление происходит по метильному ω-атому углерода, и в результате образуются дикарбоновые кислоты, выделяющиеся с мочой. Определение этих кислот в моче может служить диагностическим признаком нарушения β-окисления.
64-65. Биосинтез и окисление глицерина в тканях, их этапы. Энергетика окисления глицерина. Взаимосвязь глицерина с углеводным обменом. Синтез жирных кислот, этапы этого процесса. Строение и функция синтетазы жирных кислот. Взаимосвязь синтеза жирных кислот с обменом углеводов и аминокислот. Образование ненасыщенных жирных кислот. Незаменимые жирных кислоты, их роль в метаболизм
Окисление жирных кислот и глицерина. Катаболизм липидов. В организме человека (70 кг) находится около 12-15 кг жира. Этот запас ТАГ обеспечивает поддержание основного обмена в течении нескольких недель. Жировая ткань очень метаболически активна и реагирует на изменения в обмене веществ. Особенно тесно связана с печенью, сердечной и скелетными мышцами (50% энергии получают при окислении липидов), т.к. в молекуле ТАГ основная доля – высшие жирные кислоты. Окисление происходит в матриксе митохондрий. Сначала жирная кислота активируется: 1.В цитоплазме каждой кислота активируется с использованием КоА-SH и энергии АТФ. 2.Активная жирная кислота- ацил-КоА – из цитозоля транспортируется в матрикс митохондрий (МХ). КоА-SH остается в цитозоле, а остаток жирной кислоты - ацил- соединяется с карнитином - карнитин выделен из мышечной ткани) с образованием ацил-карнитина, который поступает в межмембранное пространство МХ. Их межмембранного пространства митохондрий комплекс ацил-карнитин переносится в матрикс МХ. При этом карнитин остается в межмембранном пространстве. В матриксе ацил соединяется с КоА-SH. Окисление. В матриксе МХ образуется активная жирная кислота, которая в дальнейшем подвергается реакциям окисления до конечных продуктов. При бета- окислении окисляется группа-СН2- в бета- положении жирной кислоты до группы-С-. При этом на двух стадиях происходит дегидрирование: при участии ацилдегидрогеназы (флавиновый фермент, водород переносится на убихинон) и бета-оксиацилдегидрогеназа (акцептор водорода НАД+). Затем бета кетоацил-КоА при действии фермента тиолазы, распадается на ацетил КоА и ацил-КоА, укороченный на 2 углеродных атома по сравнению с исходным. Этот ацил-КоА вновь подвергается бета-окислению. Многократное повторение этого процесса приводит к полному распаду жирной кислоты до ацил-КоА. Окисление жирных кислот. Включает 2 этапа: 1.последовательное отщепление от С-конца эжкислоты двухуглеродного фрагмента в виде ацетил-КоА; 2.окисление ацетил-КоА в цикле Кребса до СО2 и Н2О. Энергетическая ценность окисления жирных кислот. Стеариновая кислота(С18) проходит 8 циклов окисления с образованием 9 ацетил-КоА.В каждом цикле окисления образуется 8*5 АТФ=40 АТФ, ацетил-КоА дает 9*12 АТФ=108 АТФ. Итого:148 АТФ, но 1 АТФ расходуется на активацию жирной кислоты в цитозоле, поэтому итог 147 АТФ. Особенности окисления ненасыщенных жирных кислот. Окисление ненасыщенных жирных кислот происходит также по двойной связи. В случае, когда двойная связь имеет цис-конфигурацию, действует специальный фермент цис-транс-изомераза, который переводит двойную связь в транс-форму. Транс-еноил-КоА подвергается окислению как описано выше. Особенности окисления жирных кислот с нечетным количеством углеродных атомов. В этом случае образуется 3-х углеродный продукт пропионил-КоА. Таким образом, окисление высших жирных кислот - очень важный источник большого количества энергии для клетки, но жирные кислоты становятся альтернативным энергетическим
топливом, а на первом месте – глюкоза,т.к. их окисление зависит от окисления глюкозы (1. для
активации жирной кислоты требуется АТФ, которая образуется в цитозоле в ходе гликолиза; 2.
для реакции ЦТК требуется ЩУК, которая образуется из глюкозы). Глицерин – продукт метаболизма жировой ткани, глицерин не используется адипоцитами. Глицерин утилизируют ткани, содержащие фермент глицеролкиназу (печень, почки, слизистая кишечника, молочная железа). Глицерол-3-фосфат в клетках этих органов может использоваться по трем направлениям: 1. окисление до конечных продуктов; 2. глюконеогенез; 3. синтез жиров и фосфолипидов.
66. Биосинтез жиров в организме: ресинтез жира в эндотелии кишечника, синтез жиров в печени и подкожно-жировой клетчатке. Транспорт жиров липопротеинами крови. Резервирование жиров. Физиологическое значение жиров для организма человека. Нарушение процесса синтеза жиров: ожирение, жировое перерождение печени.
Жировой обмен — совокупность процессов переваривания и всасывания нейтральных жиров (триглицеридов) и продуктов их распада в желудочно-кишечном тракте, промежуточного обмена жиров и жирных кислот и выведение жиров, а также продуктов их обмена из организма. Понятия «жировой обмен» и «липидный обмен» часто используются как синонимы, т.к. входящие в состав тканей животных и растений входят нейтральные жиры и жироподобные соединения, объединяются под общим названием липиды. Нарушения Ж. о. служат причиной или являются следствием многих патологических состояний. В организм взрослого человека с пищей ежесуточно поступает в среднем 70 г жиров животного и растительного происхождения. В ротовой полости жиры не подвергаются никаким изменениям, т.к. слюна не содержит расщепляющих жиры ферментов. Частичное расщепление жиров на глицерин или моно-, диглицериды и жирные кислоты начинается в желудке. Однако оно протекает с небольшой скоростью, поскольку в желудочном соке взрослого человека и млекопитающих активность фермента липазы, катализирующего гидролитическое расщепление жиров, крайне невысока, а величина рН желудочного сока далека от оптимальной для действия этого фермента (оптимальное значение рН для желудочной липазы находится в пределах 5,5—7,5 единиц рН). Кроме того, в желудке отсутствуют условия для эмульгирования жиров, а липаза может активно гидролизовать только жир, находящийся в форме жировой эмульсии. Поэтому у взрослых людей жиры, составляющие основную массу пищевого жира, в желудке особых изменений не претерпевают. Однако в целом желудочное пищеварение значительно облегчает последующее переваривание жира в кишечнике. В желудке происходит частичное разрушение липопротеиновых комплексов мембран клеток пищи, что делает жиры более доступными для последующего воздействия на них липазы панкреатического сока. Кроме того, даже незначительное по объему расщепление жиров в желудке приводит к появлению свободных жирных кислот, которые, не подвергаясь всасыванию в желудке, поступают в кишечник и там способствуют эмульгированию жира. Наиболее сильным эмульгирующим действием обладают желчные кислоты, попадающие в двенадцатиперстную кишку с желчью. В двенадцатиперстную кишку вместе с пищевой массой заносится некоторое количество желудочного сока, содержащего соляную кислоту, которая в двенадцатиперстной кишке нейтрализуется в основном бикарбонатами, содержащимися в панкреатическом и кишечном соке и желчи. Образующиеся при реакции бикарбонатов с соляной кислотой пузырьки углекислого газа разрыхляют пищевую кашицу и способствуют более полному перемешиванию ее с пищеварительными соками. Одновременно начинается эмульгирование жира. Соли желчных кислот адсорбируются в присутствии небольших количеств свободных жирных кислот и моноглицеридов на поверхности капелек жира в виде тончайшей пленки, препятствующей слиянию этих капелек. Нарушения жирового обмена. Одной из причин недостаточного всасывания жиров в тонкой кишке может быть их неполное расщепление вследствие либо пониженной секреции сока поджелудочной железы (недостаток панкреатической липазы), либо вследствие пониженного выделения желчи (недостаток желчных кислот, необходимых для эмульгирования жира и образования жировых мицелл). Другой, наиболее частой причиной недостаточного всасывания жира в кишечнике является нарушение функции кишечного эпителия, наблюдаемое при энтеритах, гиповитаминозах, гипокортицизме и некоторых других патологических состояниях. В этом случае моноглицериды и жирные кислоты не могут нормально всасываться в кишечнике из-за повреждения его эпителия. Нарушение всасывания жиров наблюдается также при панкреатитах, механической желтухе, после субтотальной резекции тонкой кишки, а также ваготомии, приводящей к понижению тонуса желчного пузыря и замедленному поступлению желчи в кишечник. Нарушение всасывания жира в тонкой кишке приводит к появлению большого количества жира и жирных кислот в кале — стеаторее. При длительном нарушении всасывания жира организм получает также недостаточное количество жирорастворимых витаминов. Особенности жирового обмена у детей. Гидролитическое расщепление жиров в желудке играет важную роль в процессе пищеварения у детей, особенно у детей грудного возраста, умеренная кислотность желудочного сока у которых (рН около 5,0) способствует перевариванию эмульгированного жира грудного молока желудочной липазой. Кроме того, при длительном употреблении молока в качестве основного продукта питания у детей грудного возраста возможно адаптивное усиление синтеза желудочной липазы. Слизистая оболочка верхней части пищевода грудного ребенка секретирует свою собственную липазу в ответ на сосательные движения при кормлении ребенка грудью (возможно, что именно эта липаза и проявляет свое действие в желудке детей грудного возраста). У новорожденных желудочная липаза расщепляет только те жиры, в состав молекулы которых входят жирные кислоты с короткой углеродной цепью. Вследствие относительной незрелости внешнесекреторной функции печени и низкой активности панкреатической липазы у детей (особенно у новорожденных и у детей первых 3-х лет жизни) усвоение жира (в основном триглицеридов, содержащих жирные кислоты с длинной углеродной цепью) ниже, чем у взрослых. У доношенных новорожденных усваивается около 85—90% поступающего в организм жира, у недоношенных — 60—79%. У новорожденных вследствие низкого коэффициента усвоения жира нередко отмечается стеаторея. Выделение липидов с калом у 3-месячного ребенка составляет 3 г, а в последующем уменьшается до 1 г в сутки.
67. Обмен глицерофосфолипидов. Переваривание фосфолипидов в желудочно-кишечном тракте. Внутриклеточный гидролиз фосфолипидов. Ферменты этих процессов. Биосинтез глицерофосфолипидов. Этапы этого процесса. Транспорт фосфолипидов липопротеинами крови. Регуляция обмена фосфолипидов: липотропные факторы. Значение фосфолипидов для организма человека.
Обмен глицерофосфолипидов. Начальные этапы синтеза глицерофосфолипидов и жиров происходят одинаково до образования фосфатидной кислоты. Фосфатидная кислота может синтезироваться двумя разными путями: через глицеральдегид-3-фосфат и через дигидроксиацетонфосфат. На следующем этапе фосфатидаза отщепляет от фосфатидной кислоты фосфатный остаток, в результате чего образуется диацилглицерол. Дальнейшие превращения диацилглицерола также могут идти разными путями. Один из вариантов - образование активной формы "полярной головки" фосфолипида: холин, серии или этаноламин превращаются в ЦДФ-холин, ЦДФ-серин или ЦДФ-этаноламин. Далее диацилглицерол взаимодействует с ЦМФ-производными, при этом выделяется ЦМФ, и образуется соответствующий фосфолигщц, например фосфатидилхолин. Между глицерофосфолипидами возможны различные взаимопревращения. Фосфатидилхолин может образовываться и другим путём: из фосфатидилэтаноламина, получая последовательно 3 метальные группы от SAM. Фосфатидилсерин может превращаться в фосфа-тидилэтаноламин путём декарбоксилирования. Фосфатидилэтаноламин может превращаться в фосфатидилсерин путём обмена этаноламина на серии. Катаболизм глицерофосфолипидов. Различные типы фосфолипаз, локализованных в клеточных мембранах или в лизосомах, катализируют гидролиз глицерофосфолипидов. Гидролиз некоторых глицерофосфолипидов под действием фосфолипаз имеет значение не только как путь катаболизма, но и как путь образования вторичных посредников или предшественников в синтезе биологически активных веществ - эйкозаноидов. Кроме того, фосфолипазы А1 и А2 участвуют в изменении состава жирных кислот в глицерофосфолипидах, например при синтезе в эмбриональном периоде развития дипальмитоилфосфатидилхолина - компонента сурфактанта.
68. Обмен ацетоуксусной кислоты в организме. Синтез ацетоуксусной кислоты и использование ее в тканях. Образование кетоновых тел. Нарушение этого процесса при патологии: сахарном диабете, кахексии, острой гипоксии. Биохимические механизмы развития диабетической комы.
В печени часть жирных кислот превращается в так называемые кетоновые тела – ацетоуксусную и β-гидроксимасляную кислоты. Эти вещества затем поступают в кровь и используются как источники энергии в других органах и тканях. Непосредственным предшественником кетоновых тел служит ацетил-КоА, который может образоваться как из жирных кислот так из углеводов. Однако для синтеза кетоновых тел используется преимущественно ацетил-КоА, образующийся из жирных кислот. Это происходит в результате действия специальных регуляторных механизмов. Содержание кетоновых тел в крови увеличивается в таких состояниях когда основным источником энергии для организма служат жирные кислоты –при длительной мышечной работе, при голодании, при некоторых болезнях. Через двое суток голодания концентрация кетоновых тел в крови достигает 5-8мг/дл через неделю 40-50мг/дл. При сахарном диабете концентрация кетоновых тел может повышаться до 300-400мг/дл, что приводит к метаболическому ацидозу. Кетонемия и кетонурия. Вследствие недостаточности инсулина уменьшается отношение инсулина/глюкагон, т.е. имеется относительное избыточность глюкагона. Однако скорость синтеза кетоновых тел может превышать даже увеличенное в этих условиях их потребление тканями (концентрация кетоновых тел в крови в норме меньше 2мг/дл, при голодании до 30 мг/дл). При диабете кетонемия часто бывает 100 мг/дл, а может достигать и 350 мг/дл. При такой кетонемии возникает и кетонурия - с мочой выделяется до 5г кетовых тел в сутки. В тканях происходит декарбоксилирование ацетоуксусной кислоты: от больных исходит запах ацетона, который ощущается даже на расстоянии). Кетовые теля, являясь кислотами, снижают буферную емкость крови, а при высоких концентрациях снижают и рН крови - возникает ацидоз. В норме рН крови равна 7,4+0,04. При содержании кетовых тел 100мг/дл и больше рН крови может быть близко к 7,0. Ацидоз такой степени резко нарушает функции мозга, вплоть до потери сознания.
69. Холестерин, его химическое строение, роль в организме, экзогенный и эндогенный холестерин. Биосинтез холестерина, основные этапы этого процесса. Метаболизм холестерина, его транспорт, пути выведения. Понятие о гиперхолестеринемии. Биохимические основы формирования камней желчного пузыря.
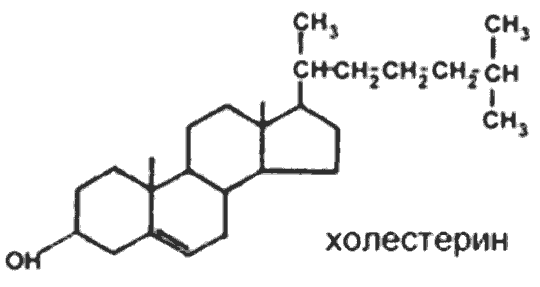
Синтез холестерина. Многоэтапный процесс синтеза холестерина (ХЛ) подразделяется на 3 стадии: 1. Образование мевалоновой кислоты из ацетил-КоА, 2. Образование «активного изопрена» и реакции конденсации с образованием сквалена, 3. Реакции циклизации сквалена с образованием стеранового скелета. Начальные реакции синтеза ХЛ сходны с начальными реакциями синтеза кетоновых тел (до образования ОМГ-КоА). Отличием является локализации процессов: синтез кетоновых тел происходит в МХ, а синтез ХЛ-ЦЗ. 1) 2 ацетил-КоА → ацетил-КоА → ОМГ-КоА тиолаза ОМГ-синтаза 2) ОМГ-редуктаза – регуляторный фермент, лимитирующий скорость биосинтеза ХЛ в целом. Её активность подавляется избытком пищевого холестерина. І стадия. Активация мевалоновой кислоты. ІІ стадия. Мевалонат---сквален. Через образование различных эфиров с Р-кислотой(5-фосфорный эфир,5-пирофосфорный эфир). Декарбоксилирование и дефосфорилирование активной мевалоновой кислоты (фермент декарбоксилаза и фосфорилаза). Активный изопрен (изопентинилпирофосфат и димитилаллилпирофосфат ) является предшественником не только ХЛ. В клетках растений и бактерий из него образуются каротиноиды, убихинон, хлорофилл, каучук. Оба изомерных изопентилпирофосфата конденсируются с высвобождением пирофосфата и образованием геранилпирофосфата С10. К геранилпирофосфату вновь присоединяется изопентил пирофосфат, образуя в результате этой реакции фарнезилпирофосфат С15 В заключительной реакции данной стадии в результате НАДФН2- зависимой восстановительной конденсации 2 молекул фарнезилпирофосфата образуется сквален С30 ІІІ стадия. Реакции конденсации изопрена: Сквален (С30) → ланостерин → холестерин. Реакции конденсации и циклизации углеродного скелета требуют большого количества энергии в форме АТФ. Гидроксилирование стеранового кольца предшественника ХЛ протекает с участием монооксигеназной цепи мембран ЭПС. Эфиры ХЛ образуются путем переноса активной жирной кислоты на гидроксильную группу ХЛ. Перенос осуществляют ферменты либо холестерол-ацил- трансфераза(ХАТ) либо лецитин-ХАТ (ЛХАТ). а сутки у здорового человека синтезируется около 2 г ХЛ (с пищей поступает 0,4-0,5 г экзогенного ХЛ). Транспорт ХЛ от печени и кишечника к органам. ХЛ синтезируется в печени как для собственных нужд, так и на «экспорт». Вновь образованный ХЛ и его эфиры включаются вместе с ТАГ в ЛПОНП и поступают в плазму крови. После освобождения ЛПОНП от ТАГ, происходящего на поверхности адипоцитов, из них образуется ЛПНП с высоким содержанием в них ХЛ. На поверхности клеток внутренних органов ЛПНП соединяются с специфическими рецепторами и поглощаются этими клетками. В лизосомах клеток происходит гидролитический распад ЛП. Освободившиеся ХЛ встраивается в клеточные мембраны. Изменение соотношения в плазме фракций ЛП- одна из причин нарушения обмена ХЛ. Пищевой (экзогенный) ХЛ транспортируется ХМ от кишечного эпителия к печени. Избыток ХЛ с желчью выводится в кишечник, где восстанавливается ферментами микрофлоры до копростерина и вместе с небольшим количеством не измененного ХЛ выделяется с калом. Выведению избытка ХЛ из кишечника в значительной мере способствует клетчатка, содержащаяся в пище. Желчнокаменная болезнь. У здорового человека ХЛ в желчи находится в определенном соотношении с ФЛ и желчными кислотами, образую с ними растворимые мицеллы. При увеличении концентрации ХЛ в составе мицелл или снижении содержания желчных кислот и ФЛ, ХЛ выпадает в осадок кристаллизируется и формирует холестериновые камни. Этому способствует застой желчи.
70. Биохимические основы развития атеросклероза. Основные фактоыр риска, гипохолестериноз, нарушение обмена липопротеинов, состояние сосудистой стенки. Добавочные факторы – повышение уровня триацилглицеринов, ожирение, физическая активность. Генетическая предрасположенность – одна из предпосылок развития гиперхолестеринемии. Нормализация гиперхолестеринемии – одно из основных условий лечения атеросклероза
Факторы риска развития атеросклероза. Основное биохимическое проявление АС – отложение ХЛ в стенках артерий. Болезнь является результатом нарушения любого звена сложной метаболической системы, включающей:
1. синтез ХЛ
2. транспорт и выведение ХЛ
3. рецепция ЛПНП клетками тканей, в т.ч. сосудистой стенки
4. состояние клеточных мембран эндотелия сосудов
5. соотношение ЛПНП и ЛПВП в плазме.
Следствием нарушения путей системы является гиперхолестеринемия, преобладание в плазме ЛПНП, которые на фоне поврежденного эпителия сосудов сопровождается увеличением его проницаемости для ХЛ и накопление последнего в сосудистой стенке. Это приводит к нарушению клеток, выведение ХЛ в межклеточное пространство, разрастанию и кальцификации соединительной ткани и образованием атеросклеротических бляшек. ЛПНП (бета-ЛП), вводящие ХЛ в клетки, вызываются атерогенными. ЛПВП (альфа-ЛП) удаляют ХЛ из тканей и поэтому являются антиатерогенными. Вероятность развития атеросклероза прогнозируется «индексом атерогенности», который представляет собой отношение ХЛ в ЛПНП к ХЛ в составе ЛПВП. У взрослых людей до 30 лет индекс 2-2,8; у лиц старше 30 лет 3-3,5. При АС индекс 4-6 и выше. Факторы риска развития АС:
1. Гиподинамия. Следствием её является накопление АТФ, ослабление реакции биологического окисления, торможение реакций ЦТК, усиление свободнорадикального окисления мембранных липидов, гиперхолестеринемия.
2. Гипоксия, следствием которой является ослабление реакций биологического окисления и ЦТК, накопление ацетил-КоА, гиперхолестеринемия.
3. Избыточное УВ питание, способствующие интенсивному синтезу ТАГ и ХЛ.
4. Стресс, следствием которого является мобилизация гликогена, усиленный синтез ТАГ и ХЛ
5. Избыток жиров в рационе.
71. Повышенная концентрация фосфолипидов в крови и тканях в раннем возрасте. Роль фосфатидилхолина и сфингомиелина. Врожденная патология обмена фосфолипидов (болезнь Гоше).
Фосфатидилхолины ― группа фосфолипидов, содержащих холин. Также входят в группу лецитинов. Фосфатидилхолины одни из самых распространенных молекул клеточных мембран. Сфингомиелин — это тип сфинголипида, который находится в клеточной мембране животных. Сфингомиелин локализуется на внешнем слое липидного бислоя клеточной мембраны и может. Структура и функции. Лецитины, как и простые жиры, содержат структурные остатки глицерина и жирных кислот, но в их состав ещё входят фосфорная кислота и холин. Лецитины широко представлены в клетках различных тканей, они выполняют как метаболические, так и структурные функции в мембранах. Болезнь Гоше (глюкозилцерамидный липид) - это самая распространенная из озлизосомных болезней накопления, которая развивается в результате недостаточности фермента глюкоцереброзидазы, что приводит к накоплению глюкоцереброзида во многих тканях, включая селезенку, печень, почки, легкие, мозг и костный мозг. Симптомы болезни Гоше:
· Увеличение печени и значительное увеличение селезенки, что может стать причиной болей в животе, преждевременного ложного насыщения и общего дискомфорта
· Изменения в селезенке могут привести к анемии и проявлениям усталости, слабости, бледности кожных покровов.
72. Повышенная активность биосинтеза и распада нейтральных жиров в тканях ребенка. Бурый жир, его значение.
Бурые жировые клетки участвуют в образовании бурой жировой ткани. Эти клетки имеют полигональную форму и содержат небольшие капельки жира, рассеянные по цитоплазме. Ядро клетки расположено эксцентрично. Клетка буквально напичкана митохондриями, из-за них жировая ткань приобретает бурый цвет. Этот жир участвует в теплопродукции, а новорождённым помогает адаптироваться к новым условиям жизни уже без связи с материнским организмом. Бурый жир участвует в теплопродукции, во-первых, благодаря большому количеству митохондрий, а, во-вторых, присутствию в них особого белка термогенина. Этот белок разобщает окислительное фосфорилирование и дыхательную цепь: ток протонов через белки мембраны обеспечивает не синтез АТФ, как это происходит в других тканях, а выделение тепла. Недавние исследования показали, что физические упражнения влекут за собой выделение неизвестного ранее гормона ирисина, который заставляет белый жир становиться бурым и препятствует ожирению.
73. Неустойчивость липидного обмена, связанная с недостаточно сформированной нейроэндокринной регуляцией. Кетонемия и ацетонемия у детей. Факторы, способствующие их развитию.
Целый ряд заболеваний обусловлен нарушением липидного обмена. Важнейшими среди них следует назвать атеросклероз и ожирение. Одно из самых распространенных проявлений атеросклероза - поражение коронарных сосудов сердца. Аккумуляция холестерина в стенках сосудов приводит к образованию атеросклеротических бляшек. Они, увеличиваясь со временем в размере, могут перекрывать просвет сосуда и препятствовать нормальному кровотоку. Если вследствие этого кровоток нарушается в коронарных артериях, то возникает стенокардия или инфаркт миокарда. Предрасположенность к атеросклерозу зависит от концентрации транспортных форм липидов крови альфа-липопротеинов плазмы. Факторы, влияющие на повышенный уровень ЛПНП у человека:
- Пол - у мужчин выше, чем у женщин в пременопаузе, и ниже, чем у женщин в постменопаузе
- Старение
- Насыщенные жиры в диете
- Высокое потребление холестерина
- Диета с низким содержанием грубых волокнистых продуктов.
Нарушения липидного обмена (дислипидемии), характеризующиеся в первую очередь повышенным содержанием в крови холестерина и триглицеридов, являются важнейшими факторами риска атеросклероза и связанных с ним заболеваний сердечно-сосудистой системы. Первичное нарушение липидного обмена детерминировано единичными или множественными мутациями соответствующих генов, в результате которых наблюдается гиперпродукция или нарушение утилизации триглицеридов и холестерина ЛПНП или гиперпродукция и нарушения клиренса ЛПВП. Другими причинами вторичного нарушения липидного обмена могут быть:
1. Сахарный диабет.
2. Злоупотребление алкоголя.
3. Хроническая почечная недостаточность.
4. Гипертиреоидизм.
5. Первичный билиарный цирроз.
6. Прием некоторых препаратов (бета-блокаторы, антиретровирусные препараты, эстрогены, прогестины, глюкокортикоиды).
Кетонемия - повышенное содержание в крови кетоновых тел. Возникает такое состояние при тяжёлой форме сахарного диабета или голодании. При голодании в крови падает концентрация глюкозы, а при диабете глюкоза не поступает в клетку с необходимой скоростью. В результате начинается усиленный липолиз для высвобождения необходимой энергии. Мобилизованные жировые кислоты направляются из жировых депо в печень, где и образуются кетоновые тела. Выявить кетонемию можно по результатам анализовмочи и крови. Ацетонемия — содержание в крови ацетоновых (кетоновых) тел: ацетоуксусной, оксимасляной кислот, ацетона. Ацетоновые тела образуются преимущественно в печени из жирных кислот. В физиологических условиях скорость образования кетоновых тел соответствует их распаду, в норме их содержание в крови составляет 0,7—0,8 мг %.
74. Мобилизация жиров в жировой ткани, ферменты этого процесса. Гормональная регуляция: роль инсулина, глюкагона, адреналина. Значение внутриклеточного липолиза, нарушение его при ожирении.
Адипоциты (место депонирования жиров) располагаются в основном под кожей, образуя подкожный жировой слой, и в брюшной полости, образуя большой и.малый сальники. Мобилизация жиров, т.е. гидролиз до глицерола и жирных кислот, происходит в постабсорбтивный период, при голодании и активной физической работе. Гидролиз внутриклеточного жира осуществляется под действием фермента гормончувствительной липазы - ТАГ-липазы. Этот фермент отщепляет одну жирную кислоту у первого углеродного атома глицерола с образованием диацилглицерола, а затем другие липазы гидролизуют его до глицерола и жирных кислот, которые поступают в кровь. Глицерол как водорастворимое вещество транспортируется кровью в свободном виде, а жирные кислоты (гидрофобные молекулы) в комплексе с белком плазмы - альбумином. Гормональная регуляция синтеза
и мобилизации жиров. В абсорбтивный период при увеличении соотношения инсулин/глюкагон в печени активируется синтез жиров. В жировой ткани индуцируется синтез ЛП-липазы в адипоцитах и осуществляется её экспонирование на поверхность эндотелия; следовательно, в этот период увеличивается поступление жирных кислот в адипоциты. Одновременно инсулин активирует белки-переносчики глюкозы - ГЛЮТ-4. Поступление глюкозы в адипоциты и гликолиз также активируются. Результат действия инсулина на обмен углеводов и жиров в печени - увеличение синтеза жиров и секреция их в кровь в составе ЛПОНП. ЛПОНП доставляют жиры в капилляры жировой ткани, где действие ЛП-липазы обеспечивает быстрое поступление жирных кислот в адипоциты, где они депонируются в составе триацилглицеринов.
75. Патология обмена холестерина у детей. Наследственные нарушения липидного обмена: семейная гиперхолестеринемия и семейная триглицеридемия.
Содержание ЛП в крови зависит от ритма питания. После приема пищи увеличивается концентрация ХМ. В постабсорбтивный период в крови отсутствуют ХМ и циркулируют только ЛПОНП-15%, ЛПНП-60% и ЛПВП-25%. Концентрация ХЛ в крови здорового человека составляет 150-200мг% или 5,6-6,3ммоль/л, а концентрация жиров 1-2,3ммоль/л. Повышение содержания ЛП (гиперлипопротеинемия) связано с увеличением в крови ХЛ (гиперхолистеринемия) и ТАГ. В связи с этим различаются 3 формы гиперлипопротеинемии: 1. гиперхолистеринемия, обусловленная повышением концентрации ЛПНП и ЛПВП; 2. гипертриацилглицеридемия, связанная с повышением концентрации ХМ и ЛПОНП; 3. смешанная форма. Гиперлипопротеинемии бывают наследственные (первичными) и приобретенными (вторичными) примерами первичных гиперлипопротеинемий являются: 1. гиперхиломикронемия.
76. Обмен аминокислот и белков в питании ребенка. Понятие об азотистом балансе. Физиологическая азотемия новорожденных.
Для оценки состояния обмена белков используется понятие азотистый баланс. Азотистый баланс – разница между введением с пищей азота и выведением его в виде конечных продуктов азотистого обмена.Различают 3 вида азотистого баланса:1)Положительный – количество выводимого из организма азота меньше количества азота, вводимого с пищей. Азот остается в организме и расходуется на синтез белков. Характерен для растушего организма и во время беременности. 2)Отрицательный – количество выделяемого азота превышает количество азота, поступающего в течение суток. Встречается при голодании, белковой недостаточности, тяжелых заболеваниях, когда происходит интенсивный распад белков тела. Отрицательный азотистый баланс наблюдается у пожилых людей. 3)Азотистое равновесие – количество азота выводимого из организма, равно количеству получаемого с пищей азота. Характерно для здорового взрослого человека. Недостаток в пище одной незаменимой аминокислоты ведет к неполному усвоению других аминокислот. Для человека наиболее ценны белки молока, яиц, мяса, т.к. их аминокислотный состав ближе к аминокислотному составу органов и тканей человека. Азотемия — повышенное содержание в крови азотистых продуктов обмена, выводимых почками.
77. Источники и пути использования аминокислот в тканях (общая схема). Азотистый баланс. Полноценные и неполноценные белки. Переваривание белков в полости желудка. Ферменты, расщепляющие белки. Соляная кислота, ее роль. Гормональная регуляция сокоотделени. Состав желудочного сока, методы его исследования, диагностическое значение. Определение уропепсина.
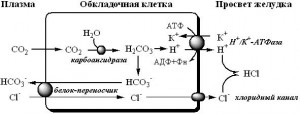 Источники и пути использования аминокислот в клетках. Источники свободных аминокислот в клетках - белки пищи, собственные белки тканей и синтез аминокислот из углеводов. Аминокислоты - органические соединения, являющиеся основной составляющей частью белков (протеинов). Аминокислоты определяют биологическую специфичность белков и их пищевую ценность. Нарушение обмена аминокислот является причиной многих болезней. Аминокислоты всасываются из желудочно-кишечного тракта и с кровью поступают во все органы и ткани, где используются для синтеза белков и подвергаются различным изменениям. В крови поддерживается постоянная концентрация аминокислот. В мышцах, ткани головного мозга и печени содержание свободных аминокислот во много раз выше, чем в крови, и менее постоянно. Аминокислоты делятся на незаменимые (валин, лейцин, фенилаланин, изолейцин, метионин, триптофан, треонин, лизин); частично заменимые (аргинин и гистидин); заменимые (аланин, аспарагин, аспарагиновая кислота, глицин (гликокол), серин, глутамин, пролин, тирозин, глутаминовая кислота, цистеин. Незаменимые аминокислоты не синтезируются в организме человека, но необходимы для нормальной жизнедеятельности. Они должны поступать в организм с пищей. При недостатке незаменимых аминокислот задерживается рост и развитие организма. В желудке переваривание белков происходит при действии протеолитического фермента пепсина; существенную роль в этом процессе играет соляная кислота желудочного сока. Соляная кислота образуется в обкладочных клетках желудочных желез и секретируется в полость желудка, где ее концентрация достигает 0,16 М (около 0,5 %). За счет этого желудочный сок имеет низкое значение рН, в пределах 1-2. Соляная кислота, помимо активации пепсиногена, выполняет и другие важные функции. В кислой среде желудочного сока большинство белков денатурируется, что облегчает их последующее переваривание пепсином. Конечно, если употребляется пища, обработанная при высокой температуре (например, вареное мясо), эта роль соляной кислоты не имеет значения. Кроме того, кислый поджелудочный сок, обладая бактерицидным действием, создает барьер для попадания болезнетворных бактерий в кишечник. Протеолитические ферменты — белки, пептид-гидролазы, ферменты класса гидролаз, расщепляющие пептидные связи между аминокислотами в белках и пептидах. Протеолитические ферменты играют важнейшую роль в переваривании белков пищи в желудке и кишечнике человека. Большинство протеолитических ферментов органов пищеварения продуцируется в виде проферментов. Физиологический смысл этого заключается в том, чтобы акт продукции фермента (профермента) был отделен от акта его активации — превращения в фермент и, таким образом, белки тканей, продуцирующих ферменты, не подвергались воздействию этих самых ферментов. Протеазы подразделяются на: экзопептидазы (пептидазы), гидролизующие (расщепляющие), преимущественно, внешние пептидые связи в белках и пептидах эндопептидазы (протеиназы), гидролизующие, преимущественно, внутренние пептидые связи Химический состав желудочного сока: вода (995 г/л); хлориды (5—6 г/л); сульфаты (10 мг/л); фосфаты (10—60 мг/л); гидрокарбонаты (0—1,2 г/л) натрия, калия, кальция, магния; аммиак (20—80 мг/л). В сутки в желудке взрослого человека вырабатывается около 2 л желудочного сока. Уропепсин (пепсиноген мочи) выделяется почками в повышенных количествах при язвенной болезни и гиперацидном гастрите, стероидной терапии, болезни Иценко—Кушинга. Понижено выделение уропепсина при желудочной ахилии, гипо– и анацидном гастритах, раке желудка, аддисоновой болезни
Источники и пути использования аминокислот в клетках. Источники свободных аминокислот в клетках - белки пищи, собственные белки тканей и синтез аминокислот из углеводов. Аминокислоты - органические соединения, являющиеся основной составляющей частью белков (протеинов). Аминокислоты определяют биологическую специфичность белков и их пищевую ценность. Нарушение обмена аминокислот является причиной многих болезней. Аминокислоты всасываются из желудочно-кишечного тракта и с кровью поступают во все органы и ткани, где используются для синтеза белков и подвергаются различным изменениям. В крови поддерживается постоянная концентрация аминокислот. В мышцах, ткани головного мозга и печени содержание свободных аминокислот во много раз выше, чем в крови, и менее постоянно. Аминокислоты делятся на незаменимые (валин, лейцин, фенилаланин, изолейцин, метионин, триптофан, треонин, лизин); частично заменимые (аргинин и гистидин); заменимые (аланин, аспарагин, аспарагиновая кислота, глицин (гликокол), серин, глутамин, пролин, тирозин, глутаминовая кислота, цистеин. Незаменимые аминокислоты не синтезируются в организме человека, но необходимы для нормальной жизнедеятельности. Они должны поступать в организм с пищей. При недостатке незаменимых аминокислот задерживается рост и развитие организма. В желудке переваривание белков происходит при действии протеолитического фермента пепсина; существенную роль в этом процессе играет соляная кислота желудочного сока. Соляная кислота образуется в обкладочных клетках желудочных желез и секретируется в полость желудка, где ее концентрация достигает 0,16 М (около 0,5 %). За счет этого желудочный сок имеет низкое значение рН, в пределах 1-2. Соляная кислота, помимо активации пепсиногена, выполняет и другие важные функции. В кислой среде желудочного сока большинство белков денатурируется, что облегчает их последующее переваривание пепсином. Конечно, если употребляется пища, обработанная при высокой температуре (например, вареное мясо), эта роль соляной кислоты не имеет значения. Кроме того, кислый поджелудочный сок, обладая бактерицидным действием, создает барьер для попадания болезнетворных бактерий в кишечник. Протеолитические ферменты — белки, пептид-гидролазы, ферменты класса гидролаз, расщепляющие пептидные связи между аминокислотами в белках и пептидах. Протеолитические ферменты играют важнейшую роль в переваривании белков пищи в желудке и кишечнике человека. Большинство протеолитических ферментов органов пищеварения продуцируется в виде проферментов. Физиологический смысл этого заключается в том, чтобы акт продукции фермента (профермента) был отделен от акта его активации — превращения в фермент и, таким образом, белки тканей, продуцирующих ферменты, не подвергались воздействию этих самых ферментов. Протеазы подразделяются на: экзопептидазы (пептидазы), гидролизующие (расщепляющие), преимущественно, внешние пептидые связи в белках и пептидах эндопептидазы (протеиназы), гидролизующие, преимущественно, внутренние пептидые связи Химический состав желудочного сока: вода (995 г/л); хлориды (5—6 г/л); сульфаты (10 мг/л); фосфаты (10—60 мг/л); гидрокарбонаты (0—1,2 г/л) натрия, калия, кальция, магния; аммиак (20—80 мг/л). В сутки в желудке взрослого человека вырабатывается около 2 л желудочного сока. Уропепсин (пепсиноген мочи) выделяется почками в повышенных количествах при язвенной болезни и гиперацидном гастрите, стероидной терапии, болезни Иценко—Кушинга. Понижено выделение уропепсина при желудочной ахилии, гипо– и анацидном гастритах, раке желудка, аддисоновой болезни
78. Протеолитические ферменты поджелудочной железы: энтерокиназа. Роль секретина для выработки сока поджелудочной железы. Диагностическое значение исследования дуоденального сока. Гидролиз продуктов переваривания белков в кишечнике. Ферменты кишечного сока. Пристеночное и полостное пищеварение. Всасывание аминокислот. Факторы, влияющие на этот процесс.
Панкреатический сок имеет высокую концентрацию бикарбонатов, которые обусловливают его щелочную реакцию. Его рН колеблется от 7,5 до 8,8. В соке содержатся хлориды натрия, калия и кальция, сульфаты и фосфаты. Вода и электролиты выделяются в основном центроацинарными и эпителиальными клетками выводах протоков. В состав сока входит и слизь, которая вырабатывается бокаловидными клетками главного протока поджелудочной железы. Панкреатический сок богат ферментами, осуществляющими гидролиз белков, жиров и углеводов. Протеолитические ферменты (трипсин, химотрипсин, эластаза, карбок-сипептидазы А и В) выделяются панкреацитами в неактивном состоянии, что предотвращает самопереваривание клеток. Трипсиноген превращается в трипсин в полости двенадцатиперстной кишки под влиянием фермента энтерокиназы, который вырабатывается слизистой оболочкой кишки. Выделение энторокинизы обусловлено влиянием желчных кислот. С появлением трипсина наступает аутокаталитический процесс активации всех протеолитических ферментов, выделяющихся в зимогенной форме. Трипсин, химотрипсин и эластаза расщепляют внутренние пептидные связи белковой молекулы и высокомолекулярных полипептидов. Содержащаяся в панкреатическом соке а-амилаза расщепляет крахмал на декстрины, мальтозу и мальтотриозу. Панкреатическая липаза секретируется в активной форме. Колипаза образует комплекс с панкреатической липазой. В образовании этого комплекса участвуют соли жирных кислот. Липаза гидролизует жир на моноглицериды и жирные кислоты. Кишечный сок — сложный по составу пищеварительный сок, вырабатываемый клетками слизистой оболочки тонкой кишки. Он содержит до 2,5 % твёрдых веществ, белков, свёртывающийся от жара, ферменты и соли, между которыми особенно преобладает сода, придающая всему соку резко щелочную реакцию. Полостное пищеварение в тонкой кишке осуществляется за счет пищеварительных секретов и их ферментов, поступивших в полость тонкой кишки (секрет поджелудочной железы, желчь, кишечный сок). Полостное пищеварение в тонкой кишке осуществляется как в жидкой фазе кишечного химуса, так и на границе фаз: на поверхности пищевых частиц, растительных волокон, сохраненных и разрушенных десквамированных энтероцитов, хлопьев (флокул), образовавшихся в результате взаимодействия кислого содержимого желудка и щелочного дуоденального химуса. В результате полостного пищеварения гидролизуются крупномолекулярные вещества и образуются в основном олигомеры. Последующий их гидролиз происходит в зоне, прилегающей к слизистой оболочке, и непосредственно на ней. В слое кишечной слизи адсорбированы ферменты из полости тонкой кишки (панкреатические и кишечные), из разрушенных энтероцитов и транспортированные в кишку из кровотока
79. Замедленное переваривание белков в желудке у детей. Особенности исследования функции желудка в детском возрасте.
Процесс расщепления пищевых веществ начинается в полости рта, где пища размельчается и смешивается со слюной, способствующей перевариванию крахмала. А у ребенка до 6 месяцев совсем нет зубов, слюнные железы у него до 4 месяцев вырабатывают мало слюны с небольшим содержанием в ней фермента. Слюнные железы начинают усиленно вырабатывать слюну только с 4-5 месяцев жизни. Железы желудка ребенка также выделяют незначительное количество ферментов, особенно мало фермента, переваривающего жиры (липазы). Желудочный сок младенца первых месяцев жизни обладает малой кислотностью, достаточной только для переваривания и усвоения женского молока. Постепенно переваривающая активность желудочного сока нарастает, и уже к концу первого года желудок способен переваривать более сложную пищу, однако кислотность приближается к активности взрослых только к школьному возрасту ребенка. Вместимость желудка у новорожденных очень маленькая, всего 30-35 мл, в возрасте 3 месяцев - уже 100 мл и к году - 250 мл. Количество и активность пищеварительных ферментов кишечника у детей первых месяцев жизни также довольно низкие. Важной и отличительной особенностью кишечника ребенка грудного возраста является повышенная проницаемость его стенок. Поэтому при различных заболеваниях, особенно желудочно-кишечных, продукты неполного переваривания пищи - токсины проникают через кишечные стенки и поступают в кровь, вызывая у ребенка тяжелое состояние.
80. Прямое и непрямое дезаминирование аминокислот. Окислительное дезаминирование аминокислот. Роль глутамата, глутаматдегидрогеназы. Значение дезаминирования. Пути обезвреживания аммиака в организме. Роль глутамина в обезвреживании и транспорта аммиака. Образование и выведение солей аммония почками.
Дезаминирование АК — реакция отщепления α-аминогруппы от АК, в результате чего образуется соответствующая α-кетокислота и выделяется молекула аммиака. Прямое дезаминирование - это дезаминирование, которое происходит в 1 стадию с участием одного фермента. Прямому дезаминированию повергаются глу, гис, сер, тре, цис. Окислительное дезаминирование - самый активный вид прямого дезаминирования АК. 1. Глутаматдегидрогеназа (глу-ДГ) - олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД), содержит кофермент НАД+. Глу-ДГ катализирует обратимое дезаминирование глу, очень активна в митохондриях клеток практически всех органов, кроме мышц. Глу-ДГ аллостерически ингибируют АТФ, ГТФ, НАДH2, активирует избыток АДФ. Индуцируется Глу-ДГ стероидными гормонами (кортизолом). Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование α-иминоглутарата, затем — неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется α-кетоглутарат. При избытке аммиака реакция протекает в обратном направлении (как восстановительное аминирование α-кетоглутарата). 2. Оксидаза L-аминокислот. В печени и почках есть оксидаза L-АК, способная дезаминировать некоторые L-аминокислоты: Оксидаза L-АК имеет кофермент ФМН. Т.к. оптимум рН оксидазы L-АК равен 10,0, активность фермента очень низка и вклад ее в дезаминирование незначителен. 3. Оксидаза D-аминокислот. Оксидаза D-аминокислот также обнаружена в почках и печени. Это ФАД-зависимый фермент, с оптимумом рН в нейтральной среде. Оксидаза D-аминокислот превращает, спонтанно образующиеся из L-аминокислот, D-аминокислоты в кетокислоты.
81. Трансаминирование: специфичность аминотрансфераз и механизм их действия. Роль глутаминовой кислоты в этих процессах. Биологическая роль реакций трансаминирования. Диагностическое значение определения активности трансаминаз в сыворотке крови (инфаркт миокарда).
Трансаминирование — биохимическая ферментативная реакция обратимого переноса аминогруппы с аминокислоты на кетокислоту без промежуточного образования аммиака. Ферменты, катализирующие процесс, назвали трансаминазами, или аминотрансферазами. Продуктами чаще всего являются аланин, аспарагин и глутамат, так как соответствующие им кетокислоты образуются в процессе метаболизма углеводов. Трансаминирование играет важную роль в процессах мочевинообразования, глюконеогенеза, путях образования новых аминокислот. Трансаминирование аминокислот с образованием глутаминовой кислоты в сочетании с ёё дезаминированием НАД(Ф)-зависимой глутаматдегидрогеназой называется непрямым дезаминированием аминокислот (трансдезаминирование).
82. Обмен безазотистого остатка аминокислот. Гликогенные и кетогенные аминокислоты. Синтез глюкозы из аминокислот (глюкозо-аланиновый цикл). Синтез аминокислот из продуктов обмена глюкозы: синтез серина, глицина. Роль фолиевой кислоты в обмене этих аминокислот. Использование глицина для синтеза различных веществ в организме.
За сутки у человека распадаются примерно 100г АК. Катаболизм всех АК сводится к образованию шести веществ, вступающих в общий путь катаболизма: ПВК, ацетил-КоА, α-кетоглутарат, сукцинил-КоА, фумарат и ЩУК. Эти вещества окисляются в ЦТК для образования АТФ или используются для синтеза глюкозы и кетоновых тел. Гликогенные аминокислоты - АК, которые превращаются в ПВК и промежуточные продукты ЦТК (а-КГ, сукцинил-КоА, фумарат, ЩУК). Они через ЩУК, используются в глюконеогенезе (ала, асн, асп, гли, глу, глн, про, сер, цис, арг, гис, вал, мет, тре). Кетогенные аминокислоты – АК, которые в процессе катаболизма превращаются в ацетоацетат (Лиз, Лей) или ацетил-КоА (Лей) и могут использоваться в синтезе кетоновых тел. Смешанные (гликкетогенными) аминокислоты – АК, при катаболизме которых образуются метаболит цитратного цикла и ацетоацетат (Три, Фен, Тир) или ацетил-КоА (Иле). Эти АК используются для синтеза глюкозы и кетоновых тел.
83. Декарбоксилирование аминокислот. Биогенные амины: гистамин, серотонин, гаммааминомасляная кислота, катехоламины. Их происхождение, функции, расщепление. Образование токсических аминов в толстом кишечнике, их обезвреживание в печени.
Процесс отщепления карбоксильной группы аминокислот в виде CO2 получил название декарбоксилирования. В животных тканях установлено декарбоксилирование следующих аминокислот и их производных: тирозина,триптофана, 5-окситриптофана, валина, серина, гистидина, глутаминовой и γ-оксиглутаминовой кислот, 3,4-диоксифенилаланина, цистеина, аргинина, орнитина, S-аденозилметионина и α-аминомалоновой кислоты. Помимо этого, у микроорганизмов и растений открыто декарбоксилирование ряда других аминокислот. Биогенные амины — вещества, обычно образующиеся в организме животных или растений из аминокислот при их декарбоксилировании (удалении карбоксильной группы) ферментами декарбоксилазами и обладающие высокой биологической активностью. К биогенным аминам относятся дофамин, норадреналин и адреналин (синтезируются изначально из аминокислоты тирозина), серотонин, мелатонин и триптамин и многие другие соединения. В организме животных многие биогенные амины выполняют роль гормонов и нейромедиаторов. Разлагаются в организме при участии ферментов аминоксидаз. Реакции декарбоксилирования являются необратимыми. Они катализируются специфическими ферментами – декарбоксилазами аминокислот, отличающимися от декарбоксилаз α-кетокислот как белковым компонентом, так и природой кофермента.
84. Обмен фенилаланина и тирозина. Образование катехоламинов, гормонов щитовидной железы, меланина. Нарушения процессов распада тирозина: фенилкетонурия, алкаптонурия, альбинизм.
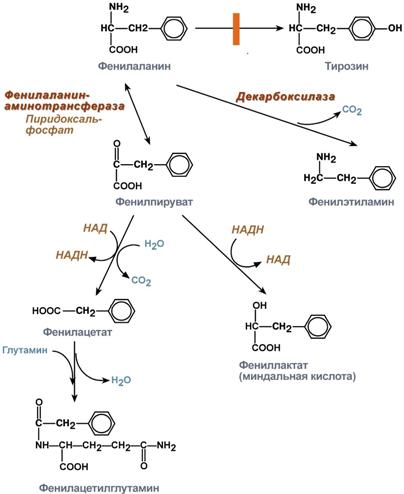 Фенилаланин – незаменимая аминокислота, так как в клетках животных не синтезируется ее бензольное кольцо. Метаболизм метионина осуществляется по 2-м путям: включается в белки или превращается в тирозин под действием специфической монооксигеназы – фенилаланингидроксилазы. Кроме использования в синтезе белков, тирозин в разных тканях выступает предшественником таких соединений как катехоламины, тироксин, меланин и др. В щитовидной железе из тирозина синтезируются гормоны тироксин и трийодтиронин.
Фенилаланин – незаменимая аминокислота, так как в клетках животных не синтезируется ее бензольное кольцо. Метаболизм метионина осуществляется по 2-м путям: включается в белки или превращается в тирозин под действием специфической монооксигеназы – фенилаланингидроксилазы. Кроме использования в синтезе белков, тирозин в разных тканях выступает предшественником таких соединений как катехоламины, тироксин, меланин и др. В щитовидной железе из тирозина синтезируются гормоны тироксин и трийодтиронин.
В мозговом веществе надпочечников и нервной ткани тирозин является предшественником катехоламинов. Промежуточным продуктом их синтеза является ДОФА. Однако в отличие от меланоцитов, гидроксилирование тирозина осуществляется под действием тирозингидроксилазы, которая является Fe2+- зависимым ферментом, и его активность регулирует скорость синтеза катехоламинов.
85. Лабильность дезаминирования в гепатоцитах ребенка. Повышенная концентрация аминокислот в крови и моче ребенка раннего возраста. Своеобразие обмена некоторых аминокислот. Фенилаланин, тирозин.
О гипераминоацидуриях говорят в том случае, когда выведение одной или нескольких аминокислот с мочой превышает физиологические значения. В зависимости от происхождения можно выделить: 1. метаболические или преренальные и 2. ренальные аминоацидурий. При метаболических аминоацидуриях одной или нескольких аминокислот образуется больше, нежели в норме, или метаболизируется меньшее их количество. Фенилкетонурия. Фенилпировиноградная олигофрения (болезнь Фёллинга). Энзимопатия, наследуемая по аутосомно-рецессивному типу. Ее биохимической сущностью является невозможность превращения фенилаланина в тирозин вследствие отсутствия фермента фенилаланин-оксидазы. Клинические проявления этой аномалии связаны с выраженным повреждением мозга, сопровождающимся умственной отсталостью. Это нередкое заболевание - одна из наиболее частых причин олигофрении. Среди населения встречается с частотой 1:10 000-1: 20 000. Алкаптонурия. Заболевание характеризуется темно-коричневой окраской мочи, которая появляется при стоянии на воздухе. Наследственная энзимопатия, у больных отсутствует фермент гомогентизиназа. Гомогентизиновая кислота, выделяемая в большем количестве, на воздухе окисляется, приобретая коричневый цвет. Пеленки и нижнее белье ребенка также окрашиваются, что облегчает постановку диагноза. Кроме описанной выше особенности мочи, при этой аномалии имеются только два других симптома: появляющаяся в более позднем возрасте артропатия и синеватая окраска хрящей, легко обнаруживаемая на ушной раковине. Лечения нет. Альбинизм также является наследственной аномалией обмена ароматических аминокислот. При этом отсутствует энзим тирозиназа, который катализирует превращение тирозина в ДОФА - диоксифенилаланиц. Так как ДОФА - основа для синтеза меланина, то носители аномалии светлокожие, светловолосые люди, у которых через лишенную пигментации радужную оболочку просвечивает красноватая сосудистая сеть. Больным следует избегать прямого солнечного света.
86. Генетически детерминированные патологии аминокислот у детей. Нарушения обмена триптофана, тирозина, фенилаланина.
Нарушения обмена фенилаланина. Фенилаланин в норме необратимо окисляется в тирозин. Если же в печени нарушается синтез необходимого для этого фермента фенилаланингидроксилазы, то окисление фенилаланина идет по пути образования фенилпировиноградной и фенилмолочной кислот — развивается фенилкетонурия. Однако этот путь обладает малой пропускной способностью и поэтому фенилаланин накапливается в большом количестве в крови, тканях и цереброспинальной жидкости, что впервые же месяцы жизни ведет к тяжелому поражению центральной нервной системы и неизлечимому слабоумию. Из-за недостаточного синтеза тирозина снижается образование меланина, что обусловливает посветление кожи и волос. Кроме того, при увеличенной выработке фенилпировиноградной кислоты тормозится активность фермента (дофамингидроксилазы), необходимого для образования катехоламинов (адреналина, норадреналина). Поэтому тяжесть наследственного заболевания определяется комплексом всех этих нарушений. Нарушения обмена тирозина. Обмен тирозина осуществляется несколькими путями. При недостаточном превращении образовавшейся из тирозина парагидроксифенилпировиноградной кислоты в гомогентизиновую первая, а также тирозин выделяются с мочой. Это нарушение носит название тирозиноза. Если же задержка окисления тирозина происходит в момент превращения гомогентизиновой кислоты в малеилацетоуксусную, развивается алкаптонурия. Фермент, окисляющий гомогентизиновую кислоту (оксидаза гомогентизиновой кислоты), образуется в печени. В норме он настолько быстро разрывает ее гидрохиноновое кольцо, что кислота "не успевает" появиться в крови, а если и появляется, то быстро выводится почками. При наследственном дефекте этого фермента гомогентизиновая кислота в большом количестве обнаруживается в крови и моче. Моча при стоянии на воздухе, а также при добавлении к ней щелочи становится черной. Это объясняется окислением гомогентизиновой кислоты кислородом воздуха и образованием в ней алкаптона ("захватывающий щелочь"). Гомогентизиновая кислота из крови проникает в ткани — хрящевую, сухожилия, связки, внутренний слой стенки аорты, вследствие чего появляются темные пятна в области ушей, носа, щек, на склерах. Иногда развиваются тяжелые изменения в суставах. Нарушения обмена триптофана. Основной путь метаболизма триптофана приводит к синтезу амида никотиновой кислоты, который играет очень важную роль в жизнедеятельности организма, являясь простетической группой ряда окислительных ферментов — никотинамидадениндинук-леотида (НАД) и его восстановленной формы никотинамидаденин-динуклеотидфосфата (НАДФ). Поэтому при недостаточности никотиновой кислоты и ее амида нарушаются многие обменные реакции, а при значительном дефиците этих веществ развивается пеллагра. Нарушение обмена триптофана может проявиться также в изменении количества образующегося из него серотонина.
87. Мочевина как конечный продукт азотистого обмена. Биосинтез мочевины, его этапы. Связь орнитинового цикла с метаболизмом фумаровой и аспарагиновой кислот. Нарушения синтеза и выведения мочевины. Гипераммониемия. 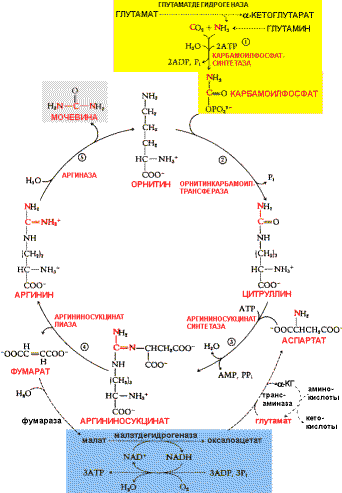 Мочевина — химическое соединение, диамид угольной кислоты. Белые кристаллы, растворимые в полярных растворителях (воде, этаноле, жидком аммиаке). Мочевина является конечным продуктом метаболизма белка у млекопитающих. Производные нитрозомочевин находят применение в фармакологии в качестве противоопухолевых препаратов. Анализ на мочевину входит в биохимический анализ крови. Нормы:
Мочевина — химическое соединение, диамид угольной кислоты. Белые кристаллы, растворимые в полярных растворителях (воде, этаноле, жидком аммиаке). Мочевина является конечным продуктом метаболизма белка у млекопитающих. Производные нитрозомочевин находят применение в фармакологии в качестве противоопухолевых препаратов. Анализ на мочевину входит в биохимический анализ крови. Нормы:
· дети до 14 лет — 1,8—6,4 ммоль/л
· взрослые до 60 лет — 2,5—6,4 ммоль/л
· взрослые старше 60 лет — 2,9—7,5 ммоль/л
Синтез мочевины — циклический процесс состоит из пяти реакций, катализируемый пятью отдельными ферментами. Суммарное уравнение: СO2+NH3+2H2O+Аспарат → H2N—CO—NH2+Фумарат. При недостаточной активности ферментов орнитинового цикла возникают гипераммониемии — патологические состояния сопровождающиеся повышением концентрации аммиака в крови.
88. Пути обезвреживания аммиака в организме ребенка. Преобладание у детей раннего возраста урикотелического пути обмена аммиака. Причины нарастания аммиака крови.
В тканях аммиак находится преимущественно в виде иона аммония NН  в равновесии с небольшой концентрацией неионизированного аммиака. Одним из путей связывания и обезвреживания аммиака в организме, в частности в мозге, сетчатке, почках, печени и мышцах - это биосинтез амидов глутаминовой и аспарагиновой кислот (глутамина или аспарагина). Обезвреживание аммиака путем синтеза глутамина имеет и анаболическое значение, поскольку глутамин используется для синтеза ряда соединений. Прежде всего нужно отметить, что глутамин — одна из 20 аминокислот, входящих в белки. Кроме того, амидная группа глутамина используется для синтеза аспарагина, глюкозамина и других аминосахаров, пуриновых и пиримидиновых нуклеотидов. Таким образом, в этих реакциях азот аммиака включается в разнообразные структурно-функциональные компоненты клетки. Экскреция аммиака с мочой в норме невелика — около 0,5 г в сутки. Но она в несколько раз повышается при ацидозе, т. е. при увеличении содержания кислот в организме. Аммиак в почках образуется главным образом за счет амидной группы глутамина. Глутамин гидролизуется активируемой фосфатом глутаминазой, имеющейся в клетках эпителия канальцев почки. Часть аммиака (примерно 30%) образуется другим путем — в результате непрямого дезаминирования аминокислот. Образующийся аммиак нейтрализует кислоты: NH3 + Н+ → NH4+. Неионизированные аммиак и кислоты в клетках находятся в равновесии с их ионизированными формами. Через клеточные мембраны проникают преимущественно неионизированные аммиак и кислоты, и в просвете почечного канальца (т. е. уже в моче) аммиак акцептирует протон кислоты, образуя аммонийную соль, которая выводится из организма. Экскреция аммиака почками служит для выведения именно кислот, а не азота, на что указывает значительная скорость экскреции при ацидозе, малая — при нормальной кислотности межклеточной жидкости и крови, и отсутствие экскреции аммиака при алкалозе. Одновременно этот процесс обеспечивает сохранение организмом ионов Na+, которые в отсутствие ионов аммония выводились бы с анионами кислот. Потеря таких количеств Na+, которые необходимы для выведения кислот при ацидозе, могла бы вызвать снижение осмотического давления межклеточной жидкости и крови, а вследствие этого уменьшение объема межклеточной жидкости, т. е. обезвоживание тканей.
в равновесии с небольшой концентрацией неионизированного аммиака. Одним из путей связывания и обезвреживания аммиака в организме, в частности в мозге, сетчатке, почках, печени и мышцах - это биосинтез амидов глутаминовой и аспарагиновой кислот (глутамина или аспарагина). Обезвреживание аммиака путем синтеза глутамина имеет и анаболическое значение, поскольку глутамин используется для синтеза ряда соединений. Прежде всего нужно отметить, что глутамин — одна из 20 аминокислот, входящих в белки. Кроме того, амидная группа глутамина используется для синтеза аспарагина, глюкозамина и других аминосахаров, пуриновых и пиримидиновых нуклеотидов. Таким образом, в этих реакциях азот аммиака включается в разнообразные структурно-функциональные компоненты клетки. Экскреция аммиака с мочой в норме невелика — около 0,5 г в сутки. Но она в несколько раз повышается при ацидозе, т. е. при увеличении содержания кислот в организме. Аммиак в почках образуется главным образом за счет амидной группы глутамина. Глутамин гидролизуется активируемой фосфатом глутаминазой, имеющейся в клетках эпителия канальцев почки. Часть аммиака (примерно 30%) образуется другим путем — в результате непрямого дезаминирования аминокислот. Образующийся аммиак нейтрализует кислоты: NH3 + Н+ → NH4+. Неионизированные аммиак и кислоты в клетках находятся в равновесии с их ионизированными формами. Через клеточные мембраны проникают преимущественно неионизированные аммиак и кислоты, и в просвете почечного канальца (т. е. уже в моче) аммиак акцептирует протон кислоты, образуя аммонийную соль, которая выводится из организма. Экскреция аммиака почками служит для выведения именно кислот, а не азота, на что указывает значительная скорость экскреции при ацидозе, малая — при нормальной кислотности межклеточной жидкости и крови, и отсутствие экскреции аммиака при алкалозе. Одновременно этот процесс обеспечивает сохранение организмом ионов Na+, которые в отсутствие ионов аммония выводились бы с анионами кислот. Потеря таких количеств Na+, которые необходимы для выведения кислот при ацидозе, могла бы вызвать снижение осмотического давления межклеточной жидкости и крови, а вследствие этого уменьшение объема межклеточной жидкости, т. е. обезвоживание тканей.
89. Биосинтез пиримидиновых нуклеотидов, этапы этого процесса. Оротацидурия. Распад пиримидиновых нуклеотидов. Биосинтез дезоксирибонуклеотидов. Участие УТФ и ЦТФ в обменных процессах.
Синтез пуринов и пиримидинов приводит к монофосфатам, соответственно ИМФ (IMP] и УМФ (UMP). Из этих двух предшественников синтезируются все другие нуклеотиды. Синтез пуриновых нуклеотидов осуществляется из инозинмонофосфата [ИМФ (IMP)]. Его основание гипоксантин превращается в две стадии соответственно в аденин или гуанин. Образующиеся нуклеозидмонофосфаты АМФ (AMP) и ГМФ (GMP) переходят в дифосфаты АДФ(ADP) и ГДФ (GDP) под действием нуклеозидфосфаткиназ и, наконец, фосфорилируютсянуклеозиддифосфаткиназами до трифосфатов АТФ (АТР) и ГТФ (GTP). Нуклеозидтрифосфаты служат строительными блоками для РНК (RNA) или функционируют в качестве коферментов. Преобразование рибонуклеотидов в дезоксирибонуклеотиды происходит на стации дифосфатов и катализируется нуклеозиддифосфат-редуктазой. Пути биосинтеза пиримидиновых нуклеотидов: прежде всего исходный УМФ фосфорилируется до ди-, а затем трифосфата УТФ. УТФ превращается цитидинтрифосфат-синтазой (CTP-синтаза) в ЦТФ. 2'-Дезоксирибоза, структурный элемент ДНК, не синтезируется в виде свободного сахара, а образуется на стадии дифосфата при восстановлении ρибонуклеозиддифосфатов. Такое восстановление — сложный процесс, в котором участвует несколько белков. Необходимые восстановительные эквиваленты поставляются НАДФН (NADPH). Тем не менее, они не переносятся непосредственно от кофермента к субстрату, а проходит прежде всего через ряд окислительно-восстановительных реакций. На первой стадии тиоредоксинредуктаза восстанавливает с помощью связанного с ферментом флавинадениндинуклеотида небольшой белок, тиоредоксин. При этом дисульфидный мостик в тиоредоксине расщепляется. Образующиеся SH-группы снова восстанавливают каталитически активный дисульфидный мостик в нуклеозиддифосфат-редуктазе («рибонуклеотид-редуктаза»). Свободные SH-группы являются действенными донорами электронов для восстановления рибонуклеотиддифосфатов. Рибонуклеотид-редуктаза эукариот представляет собой тетрамер, состоящий из двух R1- и R2 -субъединиц. Кроме упомянутого дисульфидного мостика, в ферменте во время реакции образуется тирозин-радикал, генерирующий радикал в субстрате. Последний отщепляет молекулу воды и вследствие этого переходит в радикал-катион. При последующем восстановлении образуется остаток дезоксирибозы и регенерируется тирозиновый радикал. Процесс регуляции рибонуклеотид-редуктазы имеет довольно сложный механизм. Субстратная специфичность и активность фермента контролируются двумя аллостерическими центрами связывания R1-субъединицы. АТФ и дАТФ соответственно повышают и уменьшают активность редуктазы, связываясь с центром а. С центром б взаимодействует другой нуклеотид, изменяющий в результате связывания субстратную специфичность фермента.
90. Распад нуклеиновых кислот. Нуклеазы пищеварительного тракта и тканей. Биосинтез пуриновых нуклеотидов. Источники атомов пуринового кольца. Синтез пуриновых нуклеотидов: аденина и гуанина. Распад пуриновых нуклеотидов, образование мочевой кислоты. Нарушения обмена пуриновых нуклеотидов, подагра, синдром Леша-Нихана.
Нуклеазы — большая группа ферментов, гидролизующих фосфодиэфирную связь между субъединицами нуклеиновых кислот. Различают несколько типов нуклеаз в зависимости от их специфичности: экзонуклеазы и эндонуклеазы, рибонуклеазы и дезоксирибонуклеазы, рестриктазы и некоторые другие. Рестриктазы занимают важное положение в прикладной молекулярной биологии. Подагра — гетерогенное по происхождению заболевание, которое характеризуется отложением в разли чных тканях организма кристаллов уратов в форме моноурата натрия или мочевой кислоты. В основе возникновения лежит накопление мочевой кислоты и уменьшение её выделения почками, что приводит к повышению концентрации последней в крови (гиперурикемия). Клинически подагра проявляется рецидивирующим острым артритом и образованием подагрических узлов — тофусов. Чаще заболевание встречается у мужчин, однако в последнее время возрастает распространённость заболевания среди женщин, с возрастом распространённость подагры увеличивается. Синдром Лёша — Нихена — наследственное заболевание, характеризующееся увеличением синтеза мочевой кислоты (у детей) вызванное дефектом фермента гипоксантин-гуанинфосфорибозилтрансферазы, который катализирует реутилизацию гуанина и гипоксантина — в результате образуется большее количество ксантина и, следовательно, мочевой кислоты.
91. Обмен нуклеиновых кислот и нуклеотидов у ребенка. Генетические нарушения, связанные с наследственными заболеваниями.
Обмен нуклеиновых кислот. В клетках тканей нуклеиновые кислоты распадаются под влиянием ферментов. Ферменты, расщепляющие полинуклеотидные цепи, называют нуклеазами, или фосфодиэстеразами, так как они ускоряют реакции разрыва межнуклеотидных фосфодиэфирных связей в молекулах нуклеиновых кислот. Различают эндонуклеазы и экзонуклеазы. Эндонуклеазы действуют на внутренние межнуклеотидные связи в молекулах ДНК и РНК. Таким образом, при их участии осуществляется деполимеризация нуклеиновых кислот, в основном до олигонуклеотидов. Экзонуклеазы отщепляют нуклеотиды с 3′- или 5'-конца полинуклеотидной цепи и обеспечивают распад нуклеиновых кислот до свободных нуклеотидов. По специфичности действия различают дезоксирибонуклеазы (ДНКазы, расщепляющие ДНК) и рибонуклеазы (РНКазы, гидролизующие РНК). В результате их действия образуются олигонуклеотиды и лишь небольшое количества мононуклеотидов. Рибо- и дезоксирибонуклеозидфосфаты расщепляются до нуклеозидов и фосфорной кислоты под действием фосфатаз (нуклеотидаз). Нуклеозиды могут расщепляться гидролитическим путем с участием фермента нуклеозидазы: Аденозин + Н2О → Аденин + рибоза Пентозы окисляются до CO2 и H2O; фосфорная кислота используется для фосфорилирования органических соединений или выводится из организма. Азотистые основания превращаются в конечные продукты обмена и выделяются с мочой. Продукты гидролиза нуклеиновых кислот поступают в клетки организма, где используются для синтеза нуклеотидов, нуклеиновых кислот, или же для удовлетворения энергетических потребностей клетки и организма.
92. Биосинтез ДНК (репликация): стехиометрия реакций, ДНК-полимераза, матрица. Повреждение и распад ДНК.
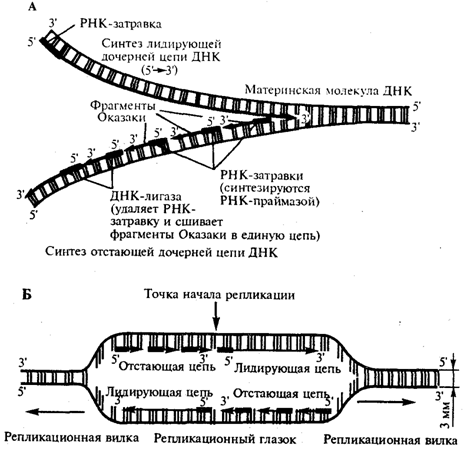 Источником энергии в реакциях полимеризации мононуклеотидов является энергия, освобождаемая всеми четырьмя типами дезоксирибонуклеозидтрифосфатов, участвующих в синтезе ДНК. Образующийся пирофосфат под действием пирофосфатазы также расщепляется на две молекулы ортофосфата, давая дополнительную энергию для биосинтеза ДНК. Помимо энергии, биогенез ДНК требует наличия специфических ферментов, катализирующих отдельные этапы синтеза, и множества белковых факторов, абсолютно необходимых для регулирования процесса репликации и проявления каталитической активности ферментов. По имеющимся данным, в репликации ДНК, включающей узнавание точки начала процесса, расплетение родительских цепей ДНК в репликационной вилке, инициацию биосинтеза дочерних цепей и дальнейшую их элонгацию и, наконец, окончание (терминация) процесса, участвует более 40 ферментов и белковых факторов, объединенных в единую ДНК репликазную систему, называемую реплисомой. Основным ферментом, катализирующим биосинтез новообразованной ДНК (точнее, стадию элонгации репликации ДНК), является ДНК-полимераза III, представляющая собой мультимерный комплекс собственно ДНК-полимеразы (мол. масса около 900000) и ряда других белков. ДНК-полимераза III катализирует сопряженный синтез ведущей (лидирующей) и отстающей цепей ДНК при репликации. ДНК-полимераза I катализирует отщепление затравочного олигорибонуклеотидного праймера и заполнение образующихся после этого пробелов (ниш) дезоксирибонуклеотидами. Важную функцию соединения двух цепей ДНК или замыкания двух концов одной цепи ДНК в процессе репликации либо репарации ДНК выполняет особый фермент – ДНК-лигаза, катализирующая за счет энергии АТФ образование фосфодиэфирной связи между 3'-ОН-группой дезоксирибозы одной цепи и 5'-фосфатной группой другой цепи ДНК. Функцию раскручивания (расплетения) двойной спирали ДНК в репликационной вилке, происходящего за счет энергии гидролиза АТФ, выполняет специфический rep-белок, названный хеликазой (мол. Масса 300000). Этапы биосинтеза ДНК. Этап I – инициация биосинтеза ДНК – является началом синтеза дочерних нуклеотидных цепей; в инициации участвует минимум восемь хорошо изученных и разных ферментов и белков. Первая фаза – это ферментативный биосинтез на матрице ДНК необычного затравочного олигорибонуклеотида (праймера) со свободной гидроксильной группой у С-3' рибозы. При инициации к цепям ДНК последовательно присоединяются ДНК-раскручивающие и ДНК-связывающие белки, а затем комплексы ДНК-полимераз и праймаз. Этап II – элонгация синтеза ДНК – включает два кажущихся одинаковыми, но резко различающихся по механизму синтеза лидирующей и отстающей цепей на обеих материнских цепях ДНК. Синтез лидирующей цепи начинается с синтеза праймера (при участии праймазы) у точки начала репликации, затем к праймеру присоединяются дезоксирибонуклеотиды под действием ДНК-полимеразы III; далее синтез протекает непрерывно, следуя шагу репликационной вилки. Синтез отстающей цепи, напротив, протекает в направлении, обратном движению репликационной вилки и начинается фрагментарно. Этап III – терминация синтеза ДНК – наступает, скорее всего, когда исчерпана ДНК-матрица и трансферазные реакции прекращаются. Точность репликации ДНК чрезвычайно высока, возможна одна ошибка на 1010 трансферазных реакций, однако подобная ошибка обычно легко исправляется за счет процессов репарации.
Источником энергии в реакциях полимеризации мононуклеотидов является энергия, освобождаемая всеми четырьмя типами дезоксирибонуклеозидтрифосфатов, участвующих в синтезе ДНК. Образующийся пирофосфат под действием пирофосфатазы также расщепляется на две молекулы ортофосфата, давая дополнительную энергию для биосинтеза ДНК. Помимо энергии, биогенез ДНК требует наличия специфических ферментов, катализирующих отдельные этапы синтеза, и множества белковых факторов, абсолютно необходимых для регулирования процесса репликации и проявления каталитической активности ферментов. По имеющимся данным, в репликации ДНК, включающей узнавание точки начала процесса, расплетение родительских цепей ДНК в репликационной вилке, инициацию биосинтеза дочерних цепей и дальнейшую их элонгацию и, наконец, окончание (терминация) процесса, участвует более 40 ферментов и белковых факторов, объединенных в единую ДНК репликазную систему, называемую реплисомой. Основным ферментом, катализирующим биосинтез новообразованной ДНК (точнее, стадию элонгации репликации ДНК), является ДНК-полимераза III, представляющая собой мультимерный комплекс собственно ДНК-полимеразы (мол. масса около 900000) и ряда других белков. ДНК-полимераза III катализирует сопряженный синтез ведущей (лидирующей) и отстающей цепей ДНК при репликации. ДНК-полимераза I катализирует отщепление затравочного олигорибонуклеотидного праймера и заполнение образующихся после этого пробелов (ниш) дезоксирибонуклеотидами. Важную функцию соединения двух цепей ДНК или замыкания двух концов одной цепи ДНК в процессе репликации либо репарации ДНК выполняет особый фермент – ДНК-лигаза, катализирующая за счет энергии АТФ образование фосфодиэфирной связи между 3'-ОН-группой дезоксирибозы одной цепи и 5'-фосфатной группой другой цепи ДНК. Функцию раскручивания (расплетения) двойной спирали ДНК в репликационной вилке, происходящего за счет энергии гидролиза АТФ, выполняет специфический rep-белок, названный хеликазой (мол. Масса 300000). Этапы биосинтеза ДНК. Этап I – инициация биосинтеза ДНК – является началом синтеза дочерних нуклеотидных цепей; в инициации участвует минимум восемь хорошо изученных и разных ферментов и белков. Первая фаза – это ферментативный биосинтез на матрице ДНК необычного затравочного олигорибонуклеотида (праймера) со свободной гидроксильной группой у С-3' рибозы. При инициации к цепям ДНК последовательно присоединяются ДНК-раскручивающие и ДНК-связывающие белки, а затем комплексы ДНК-полимераз и праймаз. Этап II – элонгация синтеза ДНК – включает два кажущихся одинаковыми, но резко различающихся по механизму синтеза лидирующей и отстающей цепей на обеих материнских цепях ДНК. Синтез лидирующей цепи начинается с синтеза праймера (при участии праймазы) у точки начала репликации, затем к праймеру присоединяются дезоксирибонуклеотиды под действием ДНК-полимеразы III; далее синтез протекает непрерывно, следуя шагу репликационной вилки. Синтез отстающей цепи, напротив, протекает в направлении, обратном движению репликационной вилки и начинается фрагментарно. Этап III – терминация синтеза ДНК – наступает, скорее всего, когда исчерпана ДНК-матрица и трансферазные реакции прекращаются. Точность репликации ДНК чрезвычайно высока, возможна одна ошибка на 1010 трансферазных реакций, однако подобная ошибка обычно легко исправляется за счет процессов репарации.
93. Биосинтез РНК (транскрипция): РНК-полимераза, стехиометрия реакции, ДНК как матрица. Регуляция транскрипции. Посттранскрипционная достройка РНК. Молекулярные мутации. Наследственные болезни.
Субстратами реакции служат трифосфаты рибонуклеозидов. Реакция идет только в присутствии ДНК, выполняющей роль матрицы. Матрицей служит одна из цепей ДНК, называемая матричной (а также кодирующей, значащей) цепью. Все синтезированные молекулы РНК имеют структуру, комплементарную матрице, т. е. одной из цепей ДНК. Поскольку РНК представляет собой одноцепочечную молекулу (спирализованные участки составляют лишь часть молекулы), стехиомет-рические коэффициенты для всех четырех субстратов различны. Транскрипцию катализируют РНК-полимеразы I, II и III. Первый из этих ферментов участвует в синтезе рибосомных РНК, второй — матричных и третий — транспортных РНК. В процессе транскрипции различают стадии инициации, элонгации и терминации. В результате транскрипции образуются предшественники тРНК, рРНК и мРНК — первичные транскрипты. Затем в ядре и в цитоплазме происходит посттранскрипционная доработка (созревание) этих предшественников, и получаются функционально активные рибонуклеиновые кислоты. Промотор содержит последовательность, обогащенную нуклеотидами Т и А (ТАТА-последовательность), узнаваемую белком ТАТА-фактором. РНК-полимера-за присоединяется к промотору, если ТАТА-последовательность связана с ТАТА-фактором. Матрицей для синтеза РНК служит одна из цепей ДНК; промотор с ТАТА-фактором обеспечивают узнавание РНК-полимеразой транскрибируемой цепи ДНК и первого нуклеотида транскрибируемого гена. Связывание РНК-поли-меразы с промотором и вызванные этим конформационные изменения повышают сродство РНК-полимеразы к факторам инициации. Присоединение этих факторов приводит к локальному расхождению нуклеотидных цепей ДНК; расхождение включает около 10 нуклеотидных пар, т. е. примерно один виток спирали.
Элонгация. Наращивание молекулы РНК происходит путем присоединения очередного рибонуклеотида, комплементарного тому дезоксирибонуклеотиду ДНК, который в данный момент находится в области активного центра РНК-полимеразы. В активном центре фермента находится З'-конец растущей цепи РНК, и к нему присоединяется очередной нуклеотид.
94. Биосинтез белков (трансляция). Стадии биосинтеза белка на рибосоме. Универсальность биологического кода и
механизма биосинтеза белков. Посттрансляционные изменения белков. Антибиотики-ингибиторы синтеза белков.
Трансляция — процесс синтеза белка из аминокислот на матрице информационной (матричной) РНК (иРНК, мРНК), осуществляемый рибосомой.
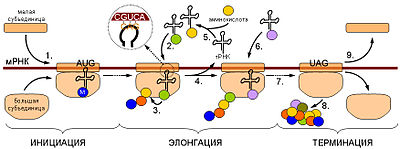 Синтез белка является основой жизнедеятельности клетки. Для осуществления этого процесса в клетках всех без исключения организмов имеются специальные органеллы — рибосомы. Рибосомы представляют собой рибонуклеопротеидные комплексы, построенные из 2 субъединиц: большой и малой. Функция рибосом заключается в узнавании трёхбуквенных (кодонов мРНК, сопоставлении им соответствующих антикодонов тРНК, несущих аминокислоты, и присоединении этих аминокислот к растущей белковой цепи. Двигаясь вдоль молекулы мРНК, рибосома синтезирует белок в соответствии с информацией, заложенной в молекуле мРНК. Для узнавания аминокислот в клетке имеются специальные «адаптеры», молекулы транспортной РНК (тРНК). Эти молекулы, имеющие форму клеверного листа, имеют участок (антикодон), комплементарный кодону мРНК, а также другой участок, к которому присоединяется аминокислота, соответствующая этому кодону. Присоединение аминокислот к тРНК осуществляется в энерго-зависимой реакции ферментами аминоацил-тРНК-синтетазами, а получившаяся молекула называется аминоацил-тРНК. Таким образом, специфичность трансляции определяется взаимодействием между кодоном мРНК и антикодоном тРНК, а также специфичностью аминоацил-тРНК-синтетаз, присоединяющих аминокислоты строго к соответствующим им тРНК (например, кодону GGU будет соответствовать тРНК, содержащая антикодон CCA, а к этой тРНК будет присоединяться только аминокислота глицин). Механизмы трансляции прокариот и эукариот существенно отличаются, поэтому многие вещества, подавляющие прокариотическую трансляцию, в значительно меньшей степени действуют на трансляцию высших организмов, что позволяет использовать их в медицинской практике как антибактериальные средства безопасные для организма млекопитающих. Процесс трансляции разделяют на
Синтез белка является основой жизнедеятельности клетки. Для осуществления этого процесса в клетках всех без исключения организмов имеются специальные органеллы — рибосомы. Рибосомы представляют собой рибонуклеопротеидные комплексы, построенные из 2 субъединиц: большой и малой. Функция рибосом заключается в узнавании трёхбуквенных (кодонов мРНК, сопоставлении им соответствующих антикодонов тРНК, несущих аминокислоты, и присоединении этих аминокислот к растущей белковой цепи. Двигаясь вдоль молекулы мРНК, рибосома синтезирует белок в соответствии с информацией, заложенной в молекуле мРНК. Для узнавания аминокислот в клетке имеются специальные «адаптеры», молекулы транспортной РНК (тРНК). Эти молекулы, имеющие форму клеверного листа, имеют участок (антикодон), комплементарный кодону мРНК, а также другой участок, к которому присоединяется аминокислота, соответствующая этому кодону. Присоединение аминокислот к тРНК осуществляется в энерго-зависимой реакции ферментами аминоацил-тРНК-синтетазами, а получившаяся молекула называется аминоацил-тРНК. Таким образом, специфичность трансляции определяется взаимодействием между кодоном мРНК и антикодоном тРНК, а также специфичностью аминоацил-тРНК-синтетаз, присоединяющих аминокислоты строго к соответствующим им тРНК (например, кодону GGU будет соответствовать тРНК, содержащая антикодон CCA, а к этой тРНК будет присоединяться только аминокислота глицин). Механизмы трансляции прокариот и эукариот существенно отличаются, поэтому многие вещества, подавляющие прокариотическую трансляцию, в значительно меньшей степени действуют на трансляцию высших организмов, что позволяет использовать их в медицинской практике как антибактериальные средства безопасные для организма млекопитающих. Процесс трансляции разделяют на
· инициацию — узнавание рибосомой стартового кодона и начало синтеза.
· элонгацию — собственно синтез белка.
· терминацию — узнавание терминирующего кодона (стоп-кодона) и отделение продукта.
95. Гем, основные этапы биосинтеза. Возможные нарушения обмена порфинов, приводящие к ослаблению синтеза гема. Гемоглобин, его структура. Гетерогенность гемоглобинов (3 типа гемоглобинов у человека). Свойства гемоглобина: кооперативное взаимодействие субъединиц. Виды гемоглобина (P, F, A). Формы гемоглобина: оксигемоглобин, карбгемоглобин, метгемоглобин, карбоксигемоглобин. Функции гемоглобина. Влияние 2,3-дифосфоглицерата эритроцита на процесс оксигенации. Патологии гемоглобина – гемоглобинозы.
Гем, железосодержащее тетрагидропиррольное красящее вещество, является составной частью О2-связывающих белков и различных коферментов оксидоредуктаз. Почти на 85% биосинтез гема происходит в костном мозге и лишь небольшая часть — в печени. В синтезе гема участвуют митохондрии и цитоплазма. Синтез тетрагидропиррольных колец начинается в митохондриях. Из сукцинил-КоА, промежуточного продукта цитратного цикла, конденсацией с глицином получается продукт, декарбоксилирование которого приводит к 5-аминолевулинату (ALA). Отвечающая за эту стадию 5-
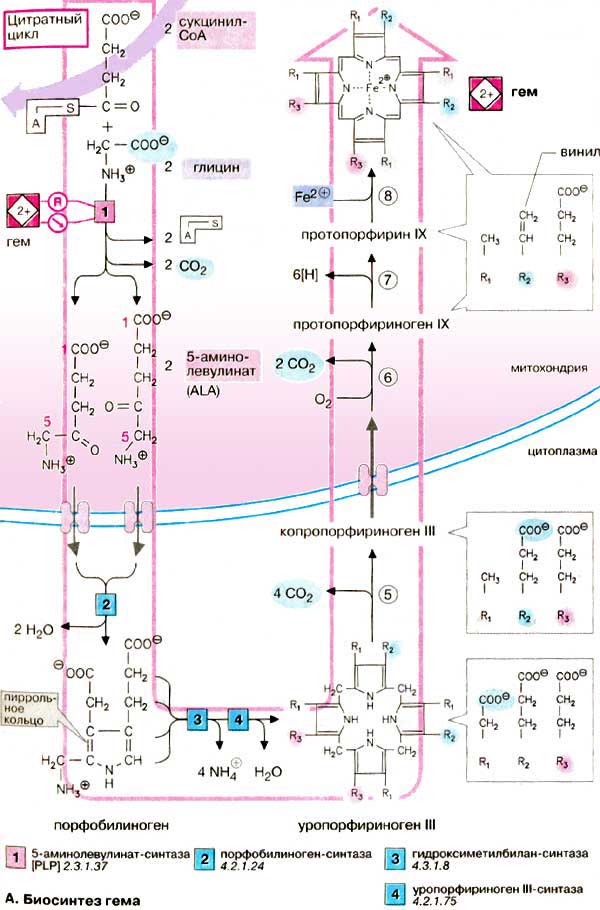 аминолевулинат-синтаза (ALA-синтаза) является ключевым ферментом всего пути. Экспрессия синтеза ALA-синтазы тормозится гемом, т. е. конечным продуктом, и имеющимся ферментом. Это типичный случай торможения конечным продуктом, или ингибирования по типу обратной связи. После синтеза 5-аминолевулинат переходит из митохондрий в цитоплазму, где две молекулы конденсируются в порфобилиноген, который уже содержит пиррольное кольцо. Порфобилиноген-синтаза ингибируется ионами свинца. Поэтому при острых отравлениях свинцом в крови и моче обнаруживают повышенные концентрации 5-аминолевулината. На последующих стадиях образуется характерная для порфирина тетрапиррольная структура. Связывание четырех молекул порфобилиногена с отщеплением NH2-групп и образованиемуропорфириногена III катализируется гидроксиметилбилан-синтазой. Для образования этого промежуточного продукта необходим второй фермент, уропорфириноген III-синтаза. Отсутствие этого фермента приводит к образованию «неправильного» изомера — уропорфириногена I. Тетрапиррольная структура уропорфиринoгена III все еще существенно отличается от гема. Так, отсутствует центральный атом железа, а кольцо содержит только 8 вместо 11 двойных связей. Кроме того, кольца несут только заряженные боковые цепи R (4 ацетатных и 4 пропионатных остатков). Так как группы гема в белках функционируют в неполярном окружении, необходимо, чтобы полярные боковые цепи превратились в менее полярные. Вначале четыре ацетатных остатка (R1) декарбоксилируются с образованием метильных групп. Образующийся копропорфириноген IIIснова возвращается в митохондрии. Дальнейшие стадии катализируются ферментами, которые локализованы на/или внутри митохондриальной мембраны. Прежде всего под действием оксидазы две пропионатные группы (R2) превращаются в винильные. Модификация боковых цепей заканчивается образованием протопорфириногена IX. На следующей стадии за счет окисления в молекуле создается сопряженная π-электронная система, которая придает гему характерную красную окраску. При этом расходуется 6 восстановительных эквивалентов. В заключение с помощью специального фермента, феррохелатазы, в молекулу включается атом двухвалентного железа. Образованный таким образом гем или Fe-протопорфирин IX включается, например, в гемоглобин и миоглобин , где он связан нековалентно, или в цитохром С, с которым связывается ковалентно. Гемоглобин — сложный железосодержащий белок кровосодержащих животных, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У человека содержится в эритроцитах. Нормальным содержанием гемоглобина в крови человека считается: у мужчин 130—170 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин 120—150 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимальный и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови. Виды гемоглобина:
аминолевулинат-синтаза (ALA-синтаза) является ключевым ферментом всего пути. Экспрессия синтеза ALA-синтазы тормозится гемом, т. е. конечным продуктом, и имеющимся ферментом. Это типичный случай торможения конечным продуктом, или ингибирования по типу обратной связи. После синтеза 5-аминолевулинат переходит из митохондрий в цитоплазму, где две молекулы конденсируются в порфобилиноген, который уже содержит пиррольное кольцо. Порфобилиноген-синтаза ингибируется ионами свинца. Поэтому при острых отравлениях свинцом в крови и моче обнаруживают повышенные концентрации 5-аминолевулината. На последующих стадиях образуется характерная для порфирина тетрапиррольная структура. Связывание четырех молекул порфобилиногена с отщеплением NH2-групп и образованиемуропорфириногена III катализируется гидроксиметилбилан-синтазой. Для образования этого промежуточного продукта необходим второй фермент, уропорфириноген III-синтаза. Отсутствие этого фермента приводит к образованию «неправильного» изомера — уропорфириногена I. Тетрапиррольная структура уропорфиринoгена III все еще существенно отличается от гема. Так, отсутствует центральный атом железа, а кольцо содержит только 8 вместо 11 двойных связей. Кроме того, кольца несут только заряженные боковые цепи R (4 ацетатных и 4 пропионатных остатков). Так как группы гема в белках функционируют в неполярном окружении, необходимо, чтобы полярные боковые цепи превратились в менее полярные. Вначале четыре ацетатных остатка (R1) декарбоксилируются с образованием метильных групп. Образующийся копропорфириноген IIIснова возвращается в митохондрии. Дальнейшие стадии катализируются ферментами, которые локализованы на/или внутри митохондриальной мембраны. Прежде всего под действием оксидазы две пропионатные группы (R2) превращаются в винильные. Модификация боковых цепей заканчивается образованием протопорфириногена IX. На следующей стадии за счет окисления в молекуле создается сопряженная π-электронная система, которая придает гему характерную красную окраску. При этом расходуется 6 восстановительных эквивалентов. В заключение с помощью специального фермента, феррохелатазы, в молекулу включается атом двухвалентного железа. Образованный таким образом гем или Fe-протопорфирин IX включается, например, в гемоглобин и миоглобин , где он связан нековалентно, или в цитохром С, с которым связывается ковалентно. Гемоглобин — сложный железосодержащий белок кровосодержащих животных, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У человека содержится в эритроцитах. Нормальным содержанием гемоглобина в крови человека считается: у мужчин 130—170 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин 120—150 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимальный и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови. Виды гемоглобина:
· Гемоглобин A, или ΗbA — нормальный гемоглобин взрослого человека.
· Гемоглобин С (Hemoglobin C), или ΗbC — один из мутантных гемоглобинов
· Гемоглобин E (HbE, эмбриональный гемоглобин) — эмбриональный тип гемоглобина человека.
· Гемоглобин S (HbS) — это особая мутантная форма гемоглобина, образующаяся у больных с серповидно-клеточной анемией и склонная к кристаллизации вместо образования нормальной четвертичной структуры и растворения в цитоплазме эритроцита.
· Гемоглобин F (HbF) — фетальный, плодный тип гемоглобина человека.
96. Распад гема. Билирубин как продукт распада гема. Метаболизм билирубина. Нарушение его обмена. Желтухи и их биологическая диагностика.
Продолжительность жизни эритроцитов составляет 120 дней, затем они разрушаются (состарившиеся эритроциты фагоцитируются макрофагами, главным образом в селезенке, а также в печени и костном мозге; в микросомальной фракции ретикуло-эндотелиальной системы клеток) и освобождается гемоглобин. В организме человека в течение 1 ч разрушается примерно 100-200 млн эритроцитов. Гем повторно не используется: он распадается с образованием железа и желчных пигментов; железо реутилизируется, а желчные пигменты выводятся из организма. Распад гемоглобина в печени начинается с разрыва a-метиновой связи между I и II кольцами порфиринового кольца, т.е окисляется один из метеновых мостиков тетрапиррольной структуры гемма, углерод метеновой группы превращается в оксид углерода СО. Этот процесс катализируется НАДФ-содержащей оксидазой ЭПР (гем-оксигеназой) с помощью кислорода и НАДФН и приводит к образованию зеленого пигмента вердоглобина (холеглобина). Интенсивный цвет гема и других порфиринов является результатом сопряжения многочисленных двойных связей, которые образуют две резонансно стабилизированные (мезомерные) системы. Основное место образования билирубина − печень, селезенка и, по-видимому, эритроциты (при распаде их иногда разрывается одна из метановых связей в протопорфирине). Образовавшийся во всех этих клетках билирубин поступает в печень, откуда вместе с желчью попадает в желчный пузырь. Билирубин, образовавшийся в клетках системы макрофагов, называется свободным, или непрямым, билирубином, поскольку вследствие плохой растворимости в воде он легко адсорбируется на белках плазмы крови и для его определения в крови необходимо предварительное осаждение белков спиртом и только после этого билирубин вступает во взаимодействие с диазореактивом. Так как билирубин нерастворим в воде, плохо растворим в плазме, его транспорт в крови осуществляется в комплексе с альбумином. Повышенный уровень билирубина (>10 мг/л) называется гипербилирубинемией. Билирубин диффундирует из крови в периферические ткани и окрашивает их в желтый цвет. Это особенно легко заметить на белой конъюктиве глаза, в таком случае говорят о желтухе.
97. Физиологическая желтуха новорожденных, ее причины.
Физиологическая желтуха новорождённых — не болезнь, а состояние в периоде адаптации, связанное с заменой фетального гемоглобина(HbF) на гемоглобин А (HbA), незрелостью ферментных систем и приспособлением детского организма к новым условиям окружающей среды. У взрослого человека эритроциты постоянно обновляются, стареющие клетки метаболизируются с образованием билирубина, который выводится печенью. У младенца печень ещё не функционирует в полной мере, поэтому образовавшийся в ходе замены фетального гемоглобина билирубин, придаёт коже и слизистым оболочкам желтоватый оттенок, начиная с третьих суток жизни. По мере того как ферментные системы организма начнут работу в полном объёме, цвет кожи малыша становится бледно-розовым. Наиболее выраженный жёлтый цвет кожа приобретает примерно на 3-4 день, поэтому, если мама и малыш находятся дома, паниковать не стоит, но понаблюдать за течением процесса необходимо. Полностью желтуха у новорожденных исчезает к 7-8 дню жизни. Если цвет кожи не пришёл в норму, необходимо обратиться к врачу, чтобы избежать возможных осложнений и выяснить причину такой патологии.
98. Обмен гемоглобина у детей. Типы и виды гемоглобина. Его возрастная эволюция. Возрастные особенности 2,3-ДФГ эритроцита. Гемоглобинопатии.
Пониженный уровень гемоглобина у детей встречается довольно таки часто. Именно поэтому врачи рекомендуют регулярно проводить общий анализ крови у детей от 7 месяцев до 4-5 лет. Это необходимо делать потому, что низкий уровень гемоглобина в раннем возрасте может привести к неправильному развитию ребенка в психологических и интеллектуальных направлениях. Именно по этой причине важно не только устранять низкий уровень гемоглобина, но также и предотвращать его. Для того, что бы уровень гемоглобина у Вашего ребенка всегда был в норме, необходимо включить в рацион его питания продукты, которые в нужном количестве содержат такие вещества как: медь, марганец и железо. Особенно внимание стоит уделить продуктам содержащим железо, так как именно железо является основным компонентом гемоглобина, обеспечивающим его образование, а также химическое превращение. Марганец и медь также очень важны, так как они непосредственно влияют на баланс и обмен железа. При недостатки этих элементов будет развиваться дефицит железа, который повлечет за собой все вытекающие отсюда последствия. Также одной из причин появления у детей пониженной нормы гемоглобина является тот факт, что ребенок, находясь ещё в утробе, не получает от матери нужного количества необходимых микроэлементов, так как в период беременность у самых матерей нередко встречается низкий уровень гемоглобина. По этому женщинам в период беременности для профилактики тоже нужно употреблять железосодержащую пищу или специальные препараты. Нормальный уровень гемоглобина у новорожденных детей довольно высокий – от 140 до 225г\л. Со временем уровень понижается и в 1-2 месяц это показатель располагается на отметке 95-140г\л. Потом, через некоторое время, когда организм ребенка стает более активным и уже сам синтезирует необходимое количество гемоглобина, норма эго содержания в крови опять повышается и составляет 100-140г\л. Норма гемоглобина у детей до двух лет находится на отметке 100-145г\л. И все последующее года уровень только повышается, к 6 годам достигая отметки в 110-155г\л. У детей возрастом до 15 лет нормальный уровень находится на отметке 115-160г\л и к подростковому возрасту увеличивается до 120-160г\л. Гемоглобинопатия — наследственное или врождённое изменение или нарушение структуры белка гемоглобина, обычно приводящее к клинически или лабораторно наблюдаемым изменениям в его кислород-транспортирующей функции либо в строении и функции эритроцитов. К наиболее часто встречающимся и известным гемоглобинопатиям относятся серповидно-клеточная анемия, бета-талассемия, персистенция фетального гемоглобина. Гемоглобинопатии классифицируются на качественные и количественные. Качественные обусловлены заменой аминокислот в полипептидных цепях. Замена аминокислоты глутамина 6 на валин в β-цепи приводит к образованию аномального гемоглобина S, что лежит в основе развития серповидно-клеточной анемии. Аномальных гемоглобинов более 300, но не все аномалии проявляются. Количественные гемоглобинопатии связаны со скоростью синтеза α- или β-полипептидных цепей глобина. Угнетение скорости синтеза α-цепи приводит к развитию α-талассемии, угнетение синтеза β-цепи лежит в основе заболевания β-талассемии. Гемоглобинопатии —наследственные заболевания. Диагностика гемоглобинопатий основывается, кроме клинических данных, на обязательном специальном исследовании электрофорезе гемоглобина. Это исследование проводится не только для больного, но и для ближайших родственников. Данные электрофореза гемоглобина позволяют поставить диагноз талассемии. Для альфа-талассемии характерно обнаружение гемоглобинов-гомотетрамеров Нв-Н и Нв-Bart.Для бета-талассемии характерно повышенное содержание гемоглобина Α2.
99. Биохимия железа. Соединения железа, находящегося в клетке: гемопротеины, металлофлавопротеины, неферментное железо. Белки, переносящие железо: трансферрин. Белки, связывающие железо в клетке: феррин, гемосидерин. Участие железа в обмене веществ. Нарушение обмена железа (дефицит железа). Железодефицитные анемии.
В гемсодержащих белках железо находится в составе гема. В негемовых железосодержащих белках железо непосредственно связывается с белком. К таким белкам относят трансферрин, ферритин, окислительные ферменты рибонук-леотидредуктазу и ксантиноксидазу, железофлавопротеины NADH-дегидрогеназа и сукцинат-дегидрогеназа. В организме взрослого человека содержится 3 - 4 г железа, из которых только около 3,5 мг находится в плазме крови. Гемоглобин имеет примерно 68% железа всего организма, ферритин - 27%, миоглобин - 4%, трансферрин - 0,1%, На долю всех содержащих железо ферментов приходится всего 0,6% железа, имеющегося в организме. Источниками железа при биосинтезе железосодержащих белков служат железо пищи и железо, освобождающееся при постоянном распаде эритроцитов в клетках печени и селезёнки. В нейтральной или щелочной среде железо находится в окисленном состоянии - Fe3+, образуя крупные, легко агрегирующие комплексы с ОН-, другими анионами и водой. При низких значениях рН железо восстанавливается и легко диссоциирует. Процесс восстановления и окисления железа обеспечивает его перераспределение между макромолекулами в организме. Ионы железа обладают высоким сродством ко многим соединениям и образуют с ними хелатные комплексы, изменяя свойства и функции этих соединений, поэтому транспорт и депонирование железа в организме осуществляют особые белки. В клетках железо депонирует белок ферритин, в крови его транспортирует белок трансферрин. В пище железо в основном находится в окисленном состоянии (Fe3+) и входит в состав белков или солей органических кислот. Освобождению железа из солей органических кислот способствует кислая среда желудочного сока. Наибольшее количество железа всасывается в двенадцатиперстной кишке. Аскорбиновая кислота, содержащаяся в пище, восстанавливает железо и улучшает его всасывание, так как в клетки слизистой оболочки кишечника поступает только Fe2+. В суточном количестве пищи обычно содержится 15 - 20 мг железа, а всасывается только около 10% этого количества. Организм взрослого человека теряет около 1 мг железа в сутки. Количество железа, которое всасывается в клетки слизистой оболочки кишечника, как правило, превышает потребности организма. Поступление железа из энтероцитов в кровь зависит от скорости синтеза в них белка апоферритина. Апоферритин "улавливает" железо в энтероцитах и превращается в ферритин, который остаётся в энтероцитах. Таким способом снижается поступление железа в капилляры крови из клеток кишечника. Когда потребность в железе невелика, скорость синтеза апоферритина повышается (см. ниже "Регуляция поступления железа в клетки"). Постоянное слущивание клеток слизистой оболочки в просвет кишечника освобождает организм от излишков железа. При недостатке железа в организме апоферритин в энтероцитах почти не синтезируется. елезо, поступающее из энтероцитов в кровь, транспортирует белок плазмы крови трансферрин. В плазме крови железо транспортирует белок трансферрин. Трансферрин - гликопротеин, который синтезируется в печени и связывает только окисленное железо (Fe3+). Поступающее в кровь железо окисляет фермент ферроксидаза, известный как медьсодержащий белок плазмы крови церулоплазмин. Одна молекула трансферрина может связать один или два иона Fe3+, но одновременно с анионом СО32- с образованием комплекса трансферрин-2 (Fe3+-CO32-). В норме трансферрин крови насыщен железом приблизительно на 33%. Нарушения метаболизма железа. Железодефицитная анемия может наблюдаться при повторяющихся кровотечениях, беременности, частых родах, язвах и опухолях ЖКТ, после операций на ЖКТ. При железодефицитной анемии уменьшается размер эритроцитов и их пигментация (гипохромные эритроциты малых размеров). В эритроцитах уменьшается содержание гемоглобина, понижается насыщение железом трансферрина, а в тканях и плазме крови снижается концентрация ферритина. Причина этих изменений - недостаток железа в организме, вследствие чего снижается синтез гема и ферритина в неэритроидных тканях и гемоглобина в эритроидных клетках. Гемохроматоз. Когда количество железа в клетках превышает объём ферритинового депо, железо откладывается в белковой части молекулы ферритина. В результате образования таких аморфных тложений избыточного железа ферритии превращается в гемосидерин. Гемосидерин плохо растворим в воде и содержит до 37% железа Накопление гранул гемосидерина в печени, поджелудочной железе, селезёнке и печени приводит к повреждению этих органов - гемохроматозу.
100.Понятие о белках крови. Белки крови как гетерогенная система. Отдельные функции белков, их функциональная роль. Физиологические и патологические белки. Качественные и количественные изменения белков крови. Понятие о гипер-, гипо-, парапротеинемии. Белковый коэффициент.
Из 9–10% сухого остатка плазмы крови на долю белков приходится 6,5–8,5%. Используя метод высаливания нейтральными солями, белки плазмы крови можно разделить на три группы: альбумины, глобулины и фибриноген. Нормальное содержание альбуминов в плазме крови составляет 40–50 г/л, глобулинов – 20–30 г/л, фибриногена – 2,4 г/л. Плазма крови, лишенная фибриногена, называется сывороткой. Синтез белков плазмы крови осуществляется преимущественно в клетках печени и ретикулоэндотелиальной системы. Физиологическая роль белков плазмы крови многогранна. 1. Белки поддерживают коллоидно-осмотическое (онкотическое) давление и тем самым постоянный объем крови. Содержание белков в плазме значительно выше, чем в тканевой жидкости. Белки, являясь коллоидами, связывают воду и задерживают ее, не позволяя выходить из кровяного русла. Несмотря на то что онкотическое давление составляет лишь небольшую часть (около 0,5%) от общего осмотического давления, именно оно обусловливает преобладание осмотического давления крови над осмотическим давлением тканевой жидкости. 2. Белки плазмы принимают активное участие в свертывании крови. Ряд белков, в том числе фибриноген, являются основными компонентами системы свертывания крови. 3. Белки плазмы в известной мере определяют вязкость крови, которая, как отмечалось, в 4– раз выше вязкости воды и играет важную роль в поддержании гемодинамических отношений в кровеносной системе.
крови.
101.Возрастные колебания общего белка крови и его фракции. Наличие фетальных белков в крови. Иммуноглобулины. Неспецифические факторы защиты.
В сыворотке крови здорового человека при электрофорезе на бумаге можно обнаружить 5 фракций: альбумины, α1-, α2-, β, γглобулины. Методом электрофореза в агаровом геле в сыворотке крови выделяют 7– 8 фракций, а при электрофорезе в крахмальном или полиакриламидном геле –до 16–7 фракций. Альбумины. На долю альбуминов приходится более половины (55–60%) белков плазмы крови человека. Мол. масса альбумина около 70000. Сывороточные альбумины сравнительно быстро обновляются (период полурас-
пада альбуминов человека 7 дней). Благодаря высокой гидрофильности, особенно в связи с относительно
небольшим размером молекул и значительной концентрацией в сыворотке, альбумины играют важную роль в поддержании онкотического давления крови. Известно, что концентрация альбуминов в сыворотке ниже 30 г/л вызывает значительные изменения онкотического давления крови, что приводит к возникновению отеков. Альбумины выполняют важную функцию транспорта многих биологически активных веществ (в частности, гормонов). Они способны связываться с холестерином, желчными пигментами. Значительная часть кальция в сыворотке крови также связана с альбуминами. Глобулины. Сывороточные глобулины при высаливании нейтральными солями можно разделить на 2 фракции – эуглобулины и псевдоглобулины. Фракция эуглобулинов в основном состоит из γ-глобулинов, а фракция псевдоглобулинов включает α-, β- и γ-глобулины, которые при электрофорезе, особенно в крахмальном или полиакриламидном геле, способны разделяться на ряд подфракций. α- и β-Глобулиновые фракции содержат липопротеины, а также белки, связанные с металлами. Большая часть антител, содержащихся в сыворотке, находится во фракции γ-глобулинов. При снижении уровня белков этой фракции резко понижаются защитные силы организма. Иммуноглобулины синтезируются В-лимфоцитами или образующимися из них плазматическими клетками. Известно 5 классов иммуноглобулинов: IgG, IgA, IgM, IgD и IgE, при этом IgG, IgA и IgM – основные классы; IgD и IgE – минорные классы иммуноглобулинов плазмы человека. Молекула иммуноглобулина состоит из двух идентичных пар полипептидных цепей. Каждая пара в свою очередь состоит из двух разных цепей: легкой (L) и тяжелой (Н). Гиперпротеинемия – увеличение общего содержания белков плазмы. Диарея у детей, рвота при непроходимости верхнего отдела тонкой кишки, обширные ожоги могут способствовать повышению концентрации белков в плазме крови. Иными словами, потеря воды организмом, а следовательно, и плазмой приводит к повышению концентрации белка в крови (относительная гиперпротеинемия). При ряде патологических состояний может наблюдаться абсолютная гиперпротеинемия, обусловленная увеличением уровня γ-глобулинов: например, гиперпротеинемия в результате инфекционного или токсического раздражения системы макрофагов; гиперпротеинемия при миеломной болезни. В сыворотке крови больных миеломной болезнью обнаруживаются специфические ≪миеломные≫ белки. Появление в плазме крови белков, не существующих в нормальных условиях, принято называть парапротеинемией. Нередко при этом заболевании содержание белков в плазме достигает 100–160 г/л. Гипопротеинемия, или уменьшение общего количества белка в плазме крови, наблюдается главным образом при снижении уровня альбуминов. Выраженная гипопротеинемия – постоянный и патогенетически важный симптом нефротического синдрома. Содержание общего белка снижается до 30–40 г/л. Гипопротеинемия наблюдается также при поражении печеночных клеток (острая атрофия печени, токсический гепатит и др.). Кроме того, гипопротеинемия может возникнуть при резко увеличенной проницаемости стенок капилляров, при белковой недостаточности (поражение пищеварительного тракта, карцинома и др.). Следовательно, можно считать, что гиперпротеинемия, как правило, связана с гиперглобулинемией, а гипопротеинемия – с гипоальбуминемией. При многих заболеваниях очень часто изменяется процентное соотношение отдельных белковых фракций, хотя общее содержание белка в сыворотке крови остается в пределах нормы. Такое состояние носит название диспротеинемия.
102.Ферменты крови: собственные ферменты крови, индикаторные и экскреторные ферменты. Диагностическое значение исследования их активности. Иммуноглобулины крови, их структура и функции. Диагностическое значение их исследования.
Ферменты, которые обнаруживаются в норме в плазме или сыворотке крови, условно можно разделить на 3 группы: секреторные, индикаторные и экскреторные. Секреторные ферменты, синтезируясь в печени, в норме выделяются в плазму крови, где играют определенную физиологическую роль. Типичными представителями данной группы являются ферменты, участвующие в процессе свертывания крови, и сывороточная холинэстераза. Индикаторные (клеточные) ферменты попадают в кровь из тканей, где они выполняют определенные внутриклеточные функции. Один из них находится главным образом в цитозоле клетки (ЛДГ, альдолаза), другие – в митохондриях (глутаматдегидрогеназа), третьи – в лизосомах (β-глюкуронидаза, кислая фосфатаза) и т.д. Большая часть индикаторных ферментов в сыворотке крови определяется в норме лишь в следовых количествах. При поражении тех или иных тканей ферменты из клеток ≪вымываются≫ в кровь; их активность в сыворотке резко возрастает, являясь индикатором степени и глубины повреждения этих тканей. Экскреторные ферменты синтезируются главным образом в печени (лейцинаминопептидаза, щелочная фосфатаза и др.). В физиологических
условиях эти ферменты в основном выделяются с желчью. Еще не полностью выяснены механизмы, регулирующие поступление данных ферментов в желчные капилляры. При многих патологических процессах выделение экскреторных ферментов с желчью нарушается, а активность в плазме крови повышается. Большинство ферментов, содержащихся в печени, присутствуют и в других органах тканей. Однако известны ферменты, которые более или менее специфичны для печеночной ткани. К таким ферментам, в частности, относится γ-глутамилтранспептидаза, или γ-глутамилтрансфераза (ГГТ). Данный фермент – высокочувствительный индикатор при заболеваниях печени. Повышение активности ГГТ отмечается при остром инфекционном или токсическом гепатите, циррозе печени, внутрипеченочной или внепеченочной закупорке желчных путей, первичном или метастатическом опухолевом поражении печени, алкогольном поражении печени. Иногда повышение активности ГГТ наблюдается при застойной сердечной недостаточности, редко – после инфаркта миокарда, при панкреатитах, опухолях поджелудочной железы. Органоспецифическими ферментами для печени считаются также гистидаза, сорбитолдегидрогеназа, аргиназа и орнитинкарбамоилтрансфераза. Изменение активности этих ферментов в сыворотке крови свидетельствуето поражении печеночной ткани. В настоящее время особо важным лабораторным тестом стало исследование активности изоферментов в сыворотке крови, в частности изоферментов ЛДГ. Известно, что в сердечной мышце наибольшей активностью обладают изоферменты ЛДГ1 и ЛДГ2, а в ткани печени – ЛДГ4 и ЛДГ5.
103.Возрастные особенности содержание и распределения воды в организме ребенка. Лябильность водного обмена. Физиологическая потеря жидкости новорожденными.
Водный обмен — совокупность процессов всасывания воды, введенной в организм при питье и с пищевыми продуктами, распределения ее в организме, образования воды при окислении жиров, углеводов и белков в тканях и выделения воды почками, легкими, кожей и кишечником. Водный обмен — составная часть общего обмена веществ организма. Общее содержание воды во взрослом организме составляет 65—70% (у эмбрионов достигает 97%), при этом вода находится в свободном и связанном состоянии. Свободная вода легко переходит из клеток во внеклеточное пространство, плазму крови, лимфу и обратно; связанная вода прочно удерживается главным образом белками. В здоровом организме взрослого человека сохраняется состояние водного равновесия (баланс), т. е. количество воды, потребляемой и образующейся в организме, равно количеству выделяемой воды. Общее количество потребляемой при питье и с пищевыми продуктами воды равно 2000—2500 мл, в том числе при питье — 1200—1500 мл в сутки. Выделение воды происходит главным образом через почки (50—60%), остальная часть выделяется через кожу, легкие и кишечник. Водный обмен регулируется центральной нервной системой и гормонами. Водный обмен у детей. У детей водный обмен имеет ряд особенностей, связанных с большей интенсивностью обменных процессов, недостаточной концентрационной способностью почек, потерей воды в результате неощутимой перспирации (выведение воды через кожу и органы дыхания) и несовершенством нейрогуморальной регуляции усвоения и выведения воды из организма.
Ребенок рождается в состоянии физиологической гипергидратации (содержание воды составляет 75— 80% веса тела). В последующие сутки у новорожденного отмечается отрицательный водный баланс, обусловленный большой потерей воды через легкие почки (выделение изотонической мочи), с меконием. Однако общее содержание воды продолжает оставаться высоким. Интенсивность обмена воды у детей, особенно в раннем возрасте, связана с большой относительной поверхностью тела. Чем моложе ребенок, тем больше у него относительная поверхность тела и тем больше потеря воды. Так, если у взрослого в водном обмене участвует 1/7 часть внеклеточной жидкости, то у ребенка грудного возраста — половина. Незначительное содержание связанной воды во внеклеточной жидкости из-за слабого развития соединительной ткани создает условия гидролабильности.В первые шесть месяцев после рождения содержание воды постепенно снижается и в дальнейшем остается в пределах 65% независимо от возраста и пола. В период полового созревания у юношей наблюдается несколько большее содержание воды в организме, чем у девушек. Уменьшение общего содержания воды в процессе роста ребенка происходит исключительно за счет внеклеточной жидкости. Количество воды внутри клеток по отношению к весу тела практически не изменяется. Влияние возраста на водный обмен особенно интенсивно сказывается на первом году жизни. Максимальная потеря веса наблюдается у большинства доношенных новорожденных на 3–5 день жизни, восстановление массы тела происходит через 6-12 дней после рождения. У недоношенных малышей потеря массы тела зависит также от массы при рождении, но восстанавливается она лишь к второй-третьей неделе жизни, и то не у всех новорожденных. Различают три степени потери первоначальной массы тела новорожденного: первая степень (потеря веса составляет меньше 6% от веса при рождении). В этом случае у ребенка не отмечаются признаки обезвоживания, но может присутствовать жадность во время кормления, беспокойство. На клеточном уровне при лабораторных исследованиях выявляются незначительные признаки внутриклеточной гипогидратации. Большинство новорожденных относятся именно к этой группе. вторая степень (потеря веса новорожденного в пределах 6-10%). В этом случае могут проявляться некоторые признаки обезвоживания: жажда, яркость слизистых оболочек, бледность кожных покровов, учащение сердцебиения, отдышка, в поведении ребенка заметна раздражительность. В лабораторных условиях наблюдаются признаки внутриклеточной гипогидратации и внеклеточного обезвоживания. третья степень (потеря веса более 10%). В этом случае более выражено наблюдаются признаки обезвоживания: сильная жажда, сухие слизистые и кожные покровы, отдышка, выраженная тахикардия, повышение температуры, ребенок ведет себя беспокойно или заторможено. Лабораторно наблюдаются выраженные признаки внутриклеточной и внеклеточной гипогидротации. Потеря более 10% массы тела может привести к существенному ухудшению состояния ребенка, поэтому врач в индивидуальном порядке решает вопрос о необходимости дополнительного допаивания или докармливания смесью.
104.Водно-солевой обмен. Взаимосвязь воды и солей. Значение воды. Распределение ее в организме. Потребность в воде и ее выведение. Физико-химические процессы регуляции транспорта жидкости в условиях целостного организма. Минеральные соли (катионы и анионы) и осмотическое давление. Значение отдельных катионов и анионов. Буферные системы. Местные, обменные факторы регуляции водно-солевого обмена. Альдостерон и вазопрессин, механизм их действия. Роль почек в этом процессе. Нарушение обмена солей (гипер- и гипокалиемия) и воды (отеки, гипер- и гипогидратация).
Водно-солевой обмен — совокупность процессов поступления воды и солей (электролитов) в организм, распределения их во внутренней среде и выведения. Системы регуляции водно-солевого обмена обеспечивают постоянство суммарной концентрации растворенных частиц, ионного состава и кислотно-щелочного равновесия, а также объема и качественного состава жидкостей организма. Организм человека состоит в среднем на 65% из воды (от 60 до 70% от веса тела), которая находится в трех жидкостных фазах — внутриклеточной, внеклеточной и трансцеллюлярной. Наибольшее количество воды (40—45%) находится внутри клеток. Внеклеточная жидкость включает (в процентах от веса тела) плазму крови (5%), межклеточную жидкость (16%) и лимфу (2%). Трансцеллюлярная жидкость (1 — 3%) изолирована от сосудов слоем эпителия и по своему составу близка к внеклеточной. Это — спинномозговая и внутриглазная жидкости, а также жидкости брюшной полости, плевры, перикарда, суставных сумок и желудочно-кишечного тракта. Водный и электролитный балансы у человека рассчитываются по суточному потреблению и выделению воды и электролитов из организма. Вода поступает в организм в виде питья — примерно 1,2 л и с пищей — примерно 1 л. Около 0,3 л воды образуется в процессе обмена веществ (из 100 г жиров, 100 г углеводов и 100 г белков образуется 107, 55 и 41 мл воды соответственно). Суточная потребность взрослого человека в электролитах составляет примерно: натрий — 215, калий — 75, кальций — 60, магний — 35, хлор — 215, фосфат — 105 мг-экв (миллиграмм-эквивалент) в день. Эти вещества всасываются в желудочно-кишечном тракте и поступают в кровь. Временно они могут депонироваться в печени. Избыток воды и электролитов выводится почками, легкими, кишечником и кожей. В среднем за сутки выделение воды с мочой составляет 1,0— 1,4 л, с калом — 0,2 л, кожей и с потом — 0,5 л, легкими — 0,4 л. Вода, поступившая в организм, распределяется между различными жидкостными фазами в зависимости от концентрации в них осмотически активных веществ. Направление движения воды зависит от осмотического градиента и определяется состоянием цитоплазматической мембраны. На распределение воды между клеткой и межклеточной жидкостью оказывает влияние не общее осмотическое давление внеклеточной жидкости, а ее эффективное осмотическое давление, которое определяется концентрацией в жидкости веществ, плохо проходящих через клеточную мембрану. Осмотическое давление крови поддерживается на постоянном уровне — 7,6 атмосфер. Поскольку осмотическое давление определяется концентрацией осмотически активных веществ (осмолярная концентрация), которую измеряют криометрическим методом, то осмолярную концентрацию выражают в мосм/л или Δ °; для сыворотки крови человека это около 300 мосм/л (или 0,553°). Осмолярная концентрация межклеточной, внутриклеточной и трансцеллюлярной жидкостей обычно такая же, как и плазмы крови; выделения ряда желез (например, пот, слюна) гипотоничны. Моча млекопитающих и птиц, секрет солевых желез птиц и рептилий гипертоничны относительно плазмы крови. У человека и животных одной из важнейших констант является рН крови, поддерживаемый на уровне около 7,36. В крови имеется ряд буферных систем — бикарбонатная, фосфатная, белки плазмы, а также гемоглобин, — поддерживающих рН крови на постоянном уровне. Но в основном рН плазмы крови зависит от парциального давления углекислого газа и концентрации НСО–3. Отдельные органы и ткани животных и человека существенно различаются по содержанию воды и электролитов. Важнейшее значение для деятельности клеток всех органов и систем имеет поддержание ионной асимметрии между внутриклеточной и внеклеточной жидкостью. В крови и других внеклеточных жидкостях высока концентрация ионов натрия, хлора, бикарбоната; в клетках главными электролитами являются калий, магний, органические фосфаты. Различия электролитного состава плазмы крови и межклеточной жидкости обусловлены низкой проницаемостью для белков капиллярной стенки. В соответствии с правилом Доннана внутри сосуда, где находится белок, концентрация катионов выше, чем в межклеточной жидкости, где относительно выше концентрация анионов, способных к диффузии. Для ионов натрия и калия фактор Доннана составляет 0,95, для одновалентных анионов 1,05.
105.Обмен кальция и фосфора. Биологическая роль кальция и фосфора. Соотношение кальция и фосфора в норме. Роль кальцитонина и паратгормона в регуляции обмена кальция и неорганического фосфора. Значение витамина Д и активных его форм в поддержании постоянной концентрации кальция и фосфора. Взаимодействие их с паратгормонами. Патологии кальциево-фосфорного обмена (рахит, остеопороз), их биологическое различие.
К функциям кальция в организме относятся:
· структурная (кости, зубы);
· сигнальная (внутриклеточный вторичный мессенджер-посредник);
· ферментативная (кофермент факторов свертывания крови);
· нейромышечная (контроль возбудимости, выделение нейротрансмиттеров, инициация мышечного сокращения).
Главная роль в метаболизме кальция в организме человека принадлежит костной ткани. В костях кальций представлен фосфатами — Са3(РО4)2 (85%), карбонатами — СаСО3 (10%), солями органических кислот — лимонной и молочной (около 5%). Вне скелета кальций содержится во внеклеточной жидкости и практически отсутствует в клетках. В состав плотного матрикса кости, наряду с коллагеном, входит фосфат кальция — кристаллическое минеральное соединение, близкое к гидроксилапатиту Са10(РО4)6(ОН)2. Часть ионов Са2+ замещена ионами Mg2+, незначительная часть ионов ОН– — ионами фтора, которые повышают прочность кости. Минеральные компоненты костной ткани находятся в состоянии химического равновесия с ионами кальция и фосфата сыворотки крови. Клетки костной ткани могут ускорять отложение или, наоборот, растворение минеральных компонентов при локальных изменениях рН, концентрации ионов Са2+, НРО42-, хелатообразующих соединений (Д. Мецлер, 1980). В организме взрослого человека содержится 1-2 кг кальция, 98% которого находится в составе скелета (А. Уайт и соавт., 1981). Он составляет около 2% массы тела (примерно 30 моль). В крови уровень кальция — 9-11 мг/100 мл (2,2-2,8 ммоль/л), во внеклеточной жидкости — около 20 мг/100 мл. Регуляция обмена кальция между вне- и внутриклеточной жидкостью осуществляется паратгормоном, кальцитонином, 1,25-диоксихолекальциферолом. При уменьшении концентрации ионов кальция возрастает секреция паратиреотропного гормона (ПТГ), и остеокласты увеличивают растворение содержащихся в костях минеральных соединений. ПТГ увеличивает одновременно реабсорбцию ионов Са2+ в почечных канальцах. В итоге повышается уровень кальция в сыворотке крови. При увеличении содержания ионов кальция секретируется кальцитонин, который снижает концентрацию ионов Са2+ за счет отложения кальция в результате деятельности остеобластов. В процессе регуляции участвует витамин D, он требуется для синтеза кальцийсвязывающих белков, необходимых для всасывания ионов Са2+ в кишечнике, реабсорбции его в почках. Постоянное поступление витамина D необходимо для нормального течения процессов кальцификации. Изменение уровня кальция в крови могут вызывать тироксин, андрогены, которые повышают содержание ионов Са2+, и глюкокортикоиды, снижающие его. Ионы Са2+ связывают многие белки, в том числе некоторые белки системы свертывания крови. В белках системы свертывания содержатся кальций-связывающие участки, образование которых зависит от витамина К. Нарушения обмена кальция сопровождаются нарушениями обмена фосфатов и клинически проявляются в изменениях костного скелета и нервно-мышечной возбудимости. Наблюдается обратная зависимость между содержанием кальция и фосфора в сыворотке крови (одновременное повышение наблюдается при гиперпаратиреоидизме, снижение — при рахите у детей). При повышенном содержании фосфора в пище в желудочно-кишечном тракте образуется невсасывающийся трехосновной фосфорнокислый кальций. Суточная потребность в кальции взрослого человека составляет 20-37,5 ммоль (0,8-1,5 г), у беременных и кормящих в два раза выше (М. А. Базарнова и соавт., 1986). В пищевой канал ежедневно поступает 35 ммоль кальция, но всасывается только половина, в 50 раз медленнее, чем натрий, но интенсивнее, чем железо, цинк, марганец. Всасывание происходит в тонком кишечнике (максимально в 12-перстной кишке). Лучше всего всасывается глюконат и лактат кальция. Оптимум всасывания наблюдается при рН=3,0. Кальций соединяется с жирными и желчными кислотами и через воротную вену поступает в печень. Транспорту через мембрану энтероцита в кровь способствует витамин D. Всасывание снижается при недостатке фосфатов (важное значение имеет соотношение кальций/фосфор). На всасывание влияет концентрация Nа+, активность щелочной фосфатазы, Mg2+-, Са2+-АТФ-азы, содержание кальций-связывающего белка. Из организма в норме кальций выводится через кишечник. Ежедневно в пищевой канал секретируется слюнными, желудочными и поджелудочными железами и выводится около 25 ммоль Са2+(М. А. Базарнова и соавт., 1986). Выведение кальция с калом сохраняется даже при бескальциевой диете (в составе желчи). В почках за сутки фильтруется около 270 ммоль Са2+. 90% кальция, фильтруемого в почках, реабсорбируется, поэтому в целом с мочой его выделяется мало (выделение возрастает при увеличении концентрации кальция в крови и ведет к образованию камней в почках). Суточная экскреция колеблется от 1,5 до 15 ммоль и зависит от суточного ритма (максимум в утренние часы), уровня гормонов, кислотно-основного состояния, характера пищи (углеводы усиливают выведение кальция). При рассасывании минерального остова костей, реабсорбция кальция снижается. Кости являются резервуаром кальция: при гипокальциемии кальций поступает из костей и, наоборот, при гиперкальциемии он откладывается в скелете. Ионы кальция важны для течения многих процессов:
· нервно-мышечного возбуждения;
· мышечного сокращения;
· свертывания крови;
· проницаемости клеточных мембран;
· активности многих ферментов и перекисного окисления липидов.
Основные источники кальция — молоко, молочные продукты (творог, твердые сыры), рыба, яйца. Он содержится также в зеленых овощах, орехах. Одним из источников кальция является питьевая вода (в 1 литре до 350-500 мг). С питьевой водой поступает 10-30% кальция (В. И. Смоляр, 1991). Биодоступность кальция улучшают кисломолочные продукты, животные белки, снижают ее — пищевые волокна, алкоголь, кофеин, избыток жиров (образуются нерастворимые соединения), фосфаты, оксалаты. Повышенное содержание в пище магния и калия тормозит всасывание кальция: они конкурируют с кальцием за желчные кислоты. Препараты витамина D способствуют всасыванию кальция. При лечении остеопороза одновременно с назначением препаратов кальция необходимо восполнение дефицита белков, кальциферола, витаминов.
Гиперкальциемия — результат повышенного поступления кальция во внеклеточную жидкость из резорбируемой костной ткани или из пищи в условиях снижения почечной реабсорбции. Наиболее частой причиной гиперкальциемии (90% случаев) являются первичный гиперпаратиреоз, злокачественные новообразования. Часто гиперкальциемия клинически не проявляется. К редким причинам гиперкальциемии относят (У. Клаттер, 1995) гранулематозные заболевания (в том числе саркоидоз), гипервитаминоз D, тиреотоксикоз, применение тиазидных диуретиков, препаратов лития, молочно-щелочной синдром, длительную обездвиженность, наследственную гипокальциурическую гиперкальциемию, почечную недостаточность. К клиническим симптомам гиперкальциемии относятся:
· отсутствие аппетита, тошнота, рвота, боли в животе (развивается язва желудка и 12-перстной кишки, панкреатит), запоры;
· слабость, утомляемость, снижение массы тела, мышечная слабость;
· изменения личности, ухудшение концентрации внимания, сонливость, кома;
· аритмии, укорочение интервала Q-T на ЭКГ;
· нефрокальциноз, почечные конкременты, кальциноз сосудов, роговицы;
· полиурия, дегидратация, почечная недостаточность.
Роль фосфора в организме человека. В организме взрослого человека содержится около 670 г фосфора (1% массы тела), который необходим для образования костей и клеточного энергетического обмена. 90% фосфора, подобно кальцию, находится в скелете — костях и зубах (М.А. Базарнова и соавт., 1986). Вместе с кальцием они составляют основу твердого вещества кости. В костях фосфор представлен трудно растворимым фосфатом кальция (2/3) и растворимыми соединениями (1/3). Большая часть остального количества фосфора находится внутри клеток, 1% — во внеклеточной жидкости. Поэтому уровень фосфора в сыворотке крови не позволяет судить об общем его содержания в организме. Фосфаты являются структурными элементами костной ткани, участвуют в переносе энергии в виде макроэргических связей (АТФ, АДФ, креатинфосфат, гуанинфосфат и других). Фосфор и сера — два элемента в организме человека, которые входят в состав различных макроэргических соединений. С участием фосфорной кислоты осуществляется гликолиз, гликогенез, обмен жиров. Фосфор входит в структуру ДНК, РНК, обеспечивающих синтез белка. Он участвует в окислительном фосфорилировании, в результате которого образуется АТФ, фосфорилировании некоторых витаминов (тиамина, пиридоксина и других). Фосфор важен также для функционирования мышечной ткани (скелетной мускулатуры и сердечной мышцы). При нарушении обмена фосфора обнаруживаются повышение и снижение его в крови. Гиперфосфатемия часто наблюдается при почечной недостаточности, встречается при гипопаратиреозе, псевдогипопаратиреозе, рабдомиолизе, распаде опухолей, метаболическом и респираторном ацидозе. Гиперфосфатемия подавляет гидроксилирование 25-гидроксикальциферола в почках. Умеренная гипофосфатемия не сопровождается существенными последствиями. Тяжелая гипофосфатемия (менее 0,3 ммоль/л (1 мг%) сопровождается нарушением функции эритроцитов, лейкоцитов, мышечной слабостью (нарушается образование АТФ, 2,3-дифосфоглицерата). Она наблюдается при злоупотреблении алкоголем и абстиненции, респираторном алкалозе, нарушении всасывания в кишечнике, приеме средств, связывающих фосфат, возобновлении приема пищи после голодания, при переедании, тяжелых ожогах, лечении диабетического кетоацидоза (У. Клаттер, 1995). При диабетическом кетоацидозе гипофосфатемия не является признаком истощения запасов фосфата. Умеренная гипофосфатемия (1,0-2,5 мг%) может наблюдаться при инфузии глюкозы, дефиците витамина D в пище или снижении его всасывания в кишечнике, при гиперпаратиреозе, остром тубулярном некрозе, после пересадки почек, при наследственной гипофосфатемии, синдроме Фанкони, паранеопластической остеомаляции, увеличении объема внеклеточной жидкости. Респираторный алкалоз может вызвать гипофосфатемию, стимулируя активность фосфофруктокиназы и образование фосфорилированных промежуточных продуктов гликолиза. Хроническая гипофосфатемия приводит к рахиту и остеомаляции. Гомеостаз кальция и фосфата. Гипокальциемия стимулирует секрецию паратиреоидного гормона и тем самым увеличивает продукцию кальцитриола. В результате увеличивается мобилизация кальция и фосфатов из костей, их поступление из кишечника. Избыток фосфатов экскретируется с мочой (ПТГ оказывает фосфатурическое действие), а реабсорбция кальция в почечных канальцах возрастает, и концентрация его в крови нормализуется. Гипофосфатемия сопровождается усилением секреции только кальцитриола. Увеличение под действием кальцитриола его концентрации в плазме приводит к снижению секреции паратиреоидного гормона. Гипофосфатемия приводит к стимуляции абсорбции фосфата и кальция в кишечнике. Избыток кальция выводится с мочой, так как кальцитриол усиливает реабсорбцию кальция в незначительной мере (по сравнению с ПТГ). В результате описанных процессов нормальная концентрация фосфата в плазме крови восстанавливается независимо от концентрации кальция.
106.Важность минеральных солей для обменных процессов у детей (пластическая и регуляторная роль). Значение прикорма ребенка для уменьшения дефицита минеральных солей.
Важность минерального обмена для организма ребенка определяется значением минеральных соединений для очень многих жизненных процессов. Эту роль биогенных стимуляторов минеральные вещества выполняют, находясь в тканях в виде пластического материала либо в нерастворимом или ионизированном состоянии в тканях, клетках и жидкостях организма. Сведения о процессе минерального обмена не полны и не совершенны из-за больших трудностей исследования его у детей. Наибольшее значение имеют катионы кальция, калия, натрия, железа, магния и анионы хлора, серной, фосфорной и угольной кислот. Минеральных солей задерживается тем больше, чем больше их получает организм. Суточная потребность организма в кальции равна у грудных детей 0,15—0,18 г, в возрасте 6—7 лет — 0,3—0,5 г и у детей старшего возраста до 1 г в день. Относительная потребность организма в кальции весьма своеобразна у детей первого года жизни: она в 8 раз больше, чем на 2-м году жизни, и в 13 раз больше, чем на 3-м году жизни. Количество кальция в крови здоровых детей составляет около 10 мг%, оно подвержено сезонным колебаниям, особенно снижается ранней весной, что связано с недостаточностью ультрафиолетовой радиации в зимние месяцы. 97% кальция фиксировано в основном в костной ткани и зубах; 3% активного кальция крови и тканей используются организмом для роста костной ткани, свертывания крови, поддержания определенного тонуса нервной системы и других физиологических процессов. Выводится кальций из организма главным образом с калом. Ценность фосфора для растущего организма определяется его основной ролью в жизни клеток, участием фосфора в построении скелета, в ферментативных процессах, функции железистых органов и нервной системы. Фосфор, вводимый с животными белками и жирами (органический) и растительной пищей (неорганический), задерживается в организме при искусственном вскармливании и у детей старшего возраста в 30—3596, тогда как при вскармливании грудным молоком ретенция фосфора равняется 70%.
Средняя потребность в фосфоре на 1 кг веса равняется 0,03 фосфорного ангидрида. В крови фосфора содержится 5 мг%. Выделяется фосфор из организма с мочой. Железо является катализатором окислительных процессов и материалом для образования гемоглобина. Запасы его накапливаются во время внутриутробного развития, и ребенок рождается с некоторым запасом железа в печени. Суточная потребность в железе у детей около 0,5 мг на 1 кг веса, удовлетворяется главным образом за счет мяса, желтка, растительной пищи. Всасывание железа пищи происходит в верхних отделах кишечника, а выделение его в виде окисей — в нижних отделах.
107.Клеточный состав соединительной ткани (фибропласты, тучные клетки, макрофаги), особенности их обмена. Коллаген и эластин – компоненты соеденительной ткани. Особенности аминокислотного состава коллагена. Биосинтез коллагена. Биохимические показатели, характеризующие метаболизм коллагена. Коллагенозы.
Соедини́тельная ткань — это ткань живого организма, не отвечающая непосредственно за работу какого-либо органа или системы органов, но играющая вспомогательную роль во всех органах, составляя 60—90 % от их массы. Выполняет опорную, защитную и трофическую функции. Соединительная ткань образует опорный каркас (строму) и наружные покровы (дерму) всех органов. Общими свойствами всех соединительных тканей является происхождение из мезенхимы, а также выполнение опорных функций и структурное сходство. Большая часть твёрдой соединительной ткани является фиброзной: состоит из волокон коллагена и эластина. К соединительной ткани относят костную,хрящевую, жировую и другие. К соединительной ткани относят также кровь и лимфу. Поэтому соединительная ткань — единственная ткань, которая присутствует в организме в 4-х видах — волокнистом (связки), твёрдом (кости), гелеобразном (хрящи) и жидком (кровь, лимфа, а также межклеточная, спинномозговая и синовиальная и прочие жидкости). Соединительная ткань состоит из внеклеточного матрикса и нескольких видов клеток. Клетки, относящиеся к соединительной ткани:
· фибробласты — производят коллаген и другие вещества внеклеточного матрикса, способны делиться.
· фиброкласты — клетки, способные поглощать и переваривать межклеточный матрикс; являются зрелыми фибробластами, к делению не способны.
· меланоциты — сильно разветвлённые клетки, содержащие меланин, присутствуют в радужной оболочке глаз и коже (по происхождению — эктодермальные клетки, производныенервного гребня)
· макрофаги — клетки, поглощающие болезнетворные организмы и отмершие клетки ткани (по происхождению моноциты крови)
· эндотелиоциты — окружают кровеносные сосуды, производят внеклеточный матрикс и продуцируют гепарин. Эндотелий по большинству признаков относят к эпителию.
· тучные клетки — продуцируют метахроматические гранулы, которые содержат гепарин и гистамин.
· мезенхимные клетки — клетки эмбриональной соединительной ткани
Коллаген. Характерным компонентом структуры соединительной ткани являются коллагеновые волокна. Они построены в основном из своеобразного белки – коллагена. Коллаген составляет 25–33% от общего количества белка организма взрослого человека, или 6% от массы тела. Видимые в оптическом микроскопе коллагеновые волокна состоят из различимых в электронном микроскопе фибрилл – вытянутых в длину белковых молекул, названных тропоколлагеном. Тропоколлаген – ос- новная структурная единица коллагена. Необходимо четко разграничивать понятия ≪коллагеновые волокна≫ и ≪коллаген≫. Первое понятие по существу является морфологическим и не может быть сведено к биохимическим представлениям о коллагене как о белке. Коллагеновое волокно представляет собой гетерогенное образование и содержит, кроме белка коллагена, другие химические компоненты. Молекула тропоколла - гена – это белок коллаген. Одной из отличительных черт данного белка является то, что 1/3 всех его аминокислотных остатков составляет глицин, 1/3 – пролин и 4-гидроксипролин, около 1% – гидроксилизин; некоторые молекулярные формы коллагена содержат также 3-гидроксипролин, хотя и в весьма ограниченном количестве. Молекулярная масса тропоколлагена около 285000. Тропоколлаген состоит из трех полипептидных цепей одинакового размера, которые сливаются в спиралевидный триплет. Тройная спираль стабилизируется многочисленными межцепочечными поперечными сшивками между лизиновыми и гидроксилизиновыми остатками. Каждая полипептидная цепь тропоколлагена содержит около 1000 аминокислотных остатков. Таким образом, основная структурная единица коллагена имеет очень большие размеры, например в 10 раз больше, чем химотрипсин. Изучение аминокислотного состава и последовательности чередования аминокислот в полипептидных цепях тропоколлагена показало, что существует два типа цепей – цепи α1 и α2, а также четыре разновидности цепи α1: α1 (I), α1 (II), α1 (III) и α1 (IV). В табл. 21.1 представлены данные о структуре коллагенов различных тканей. Как и все белки, коллаген синтезируется клетками из свободных аминокислотных остатков. Аминокислотные остатки, специфичные для молекулы коллагена, гидроксипролин и гидроксилизин не образуются из соответствующих свободных аминокислот. Эти аминокислотные остатки появляются после включения пролина и лизина в полипептидную цепь с участием ферментов пролилгидроксилазы или лизилгидроксилазы и кофактора – аскорбиновой кислоты. Эластин – основной белковый компонент, из которого состоят эластические волокна. Он отличается от коллагена по химическому составу и молекулярной структуре. Общими для эластина и коллагена являются большое содержание глицина и пролина, наличие оксипролина, хотя последнего в эластине примерно в 10 раз меньше, чем в коллагене. Как и в коллагене, в эластине
мало метионина и отсутствуют триптофан и цистеин. В отличие от коллагена в эластине значительно больше валина и аланина и меньше глутаминовой кислоты и аргинина. В целом характерной особенностью первичной структуры эластина является слишком малое содержание полярных аминокислотных остатков. При ферментативном гидролизе эластина в гидролизате обнаруживаются десмозин и изодесмозин. Эти соединения содержатся только в эластине. Эластин вместе с коллагеном, протеогликанами и рядом глико- и мукопротеинов является продуктом биосинтетической деятельности фибробластов. Непосредственным продуктом клеточного биосинтеза считается не
эластин, а его предшественник – тропоэластин (в коллагене – проколлаген). Тропоэластин не содержит поперечных связей, обладает растворимостью. В последующем тропоэластин превращается в зрелый эластин, нерастворимый, содержащий большое количество поперечных связей.
108.Интенсивный обмен всех структур соединительной ткани ребенка. Повышенное содержание коллагена.
109.Межклеточный матрикс соединительной ткани. Глюкозаминогликаны и протеогликаны: характеристика их полисахаридных групп. Гиалуроновая и хондроитинсерная кислоты, их функции. Образование и катаболизм протеогликанов. Роль гиалуронидазы в метаболизме основного вещества соединительной ткани. Нарушения обмена протеогликанов при патологии.
Протеогликаны – высокомолекулярные углеводно-белковые соединения. Они образуют основную субстанцию межклеточного матрикса соединительной ткани. На долю протеогликанов приходится до 30% от сухой
массы соединительной ткани. Полисахаридная группа протеогликанов сначала получила название мукополисахаридов. В дальнейшем эти соединения стали называть гликозаминогликанами. Это название и принято в настоящее время. Гликозаминогликаны (мукополисахариды) Гликозаминогликаны соединительной ткани – это линейные неразветвленные полимеры, построенные из повторяющихся дисахаридных единиц. В организме гликозаминогликаны не встречаются в свободном состоянии, т.е. в виде ≪чистых≫ углеводов. Они всегда связаны с большим или меньшим количеством белка. В их состав обязательно входят остатки мономера либо глюкозамина, либо галактозамина. Второй главный мономер дисахаридных единиц также представлен двумя разновидностями: D-глюкуроновой и L-идуроновой кислотами. В настоящее время четко расшифрована структура шести основных классов гликозаминогликанов. Гиалуроновая кислота впервые была обнаружена в стекловидном теле глаза. Из всех гликозаминогликанов гиалуроновая кислота имеет большую мол. массу (100000–10000000). Доля связанного с гиалуроновой кислотой белка в молекуле (частице) протеогликана составляет не более 1–2% от его общей массы. Считают, что основная функция гиалуроновой кислоты в соединительной ткани – связывание воды. В результате такого связывания межклеточное вещество приобретает характер желеобразного матрикса, способного ≪поддерживать≫ клетки. Важна также роль гиалуроновой кислоты в регуляции проницаемости тканей. Приводим структуру повторяющейся дисахаридной единицы в молекуле гиалуроновой кислоты. Дерматансульфат особенно характерен для дермы (кожи). Он резистентен к действию гиалуронидаз (тестикулярной и бактериальной). В этом одно из отличий дерматансульфата от хондроитинсульфатов. Кроме того, в состав дисахаридной единицы дерматансульфата входит L-идуроновая, а не D-глюкуроновая кислота (в малом количестве D-глюкуроновую кислоту можно обнаружить в повторяющихся единицах дерматансульфата). О биологической роли дерматансульфата почти ничего неизвестно. Роль этого гликозаминогликана не может быть сведена только к стабилизации коллагеновых пучков, так как дерматансульфат обнаруживается и в тканях эктодермального происхождения, не содержащих коллагена. Кератансульфат впервые был выделен из роговой оболочки глаза быка, отсюда и название этого гликозаминогликана. В противоположность всем остальным гликозаминогликанам кератансульфат не содержит ни D-глюкуроновой, ни L-идуроновой кислоты. Установлено, что кератансульфат, выделенный из роговицы глаза (кератансульфат I), и кератансульфат, полученный из хрящевой ткани (кератансульфат II), различаются по степени сульфатированности и строению связи между кератансульфатом и пептидной частью протеогликана. Гепарин известен прежде всего как антикоагулянт. Однако его следует относить к гликозаминогликанам, так как он синтезируется тучными клетками, которые являются разновидностью клеточных элементов соединительной ткани. Он может входить в состав протеогликанов; с гликозаминогликанами его объединяет и химическая. Гепаринсульфат в отличие от гепарина в дисахаридных единицах чаще содержит N-ацетильные группы, чем N-сульфатные. Кроме того, степень О-сульфатирования гепаринсульфата ниже, чем гепарина. Биосинтез гликозаминогликанов. Известно, что синтез глюкозамина и глюкуроновой кислоты, входящих в состав гиалуроновой кислоты, происходит из D-глюкозы. Непосредственные предшественники гиалуро-
новой кислоты – нуклеотидные (уридиндифосфонуклеотидные) производные N-ацетилглюкозамина и глюкуроновой кислоты. Предшественником углеводных остатков сульфатированных гликозаминогликанов, как и у гиалуроновой кислоты, является молекула D-глюкозы. Далее происходит эпимеризация глюкозамина в галактозамин, а глюкуроновой кислоты при синтезе дерматансульфата – в идуроновую кислоту. Нуклеотидные производные этих соединений утилизируются при биосинтезе сульфатированных гликозаминогликанов, при этом сульфат включается в биосинтез гликозаминогликанов в виде 3'-фосфоаденозин-5'- фосфосульфата (ФАФС). В процессе биосинтеза гликозаминогликанов принимает участие большое количество различных ферментов, в том числе трансфераз. Образование и катаболизм протеогликанов В соединительной ткани все гликозаминогликаны находятся в соединении с белками. Термин ≪протеогликан≫ используют для обозначения веществ, в которых полипептидная и полисахаридная части молекулы соединены прочной ковалентной связью. Примером протеогликана может служить гиалуропротеин, выделенный из синовиальной жидкости и содержащий всего 2,2–2,3% белка. У разных протеогликанов белковые компоненты различны; они не имеют ничего общего с фибриллярными белками соединительной ткани – коллагеном и эластином. Считают, что в большинстве случаев остаток серина служит той точкой полипептидной цепи молекулы протеогликанов, к которой присоединяется гликозаминогликан. В соединительной ткани протеогликаны образуют ряд ≪монтажей≫ последовательно возрастающей сложности, своего рода ≪иерархии≫ макро- молекулярных агрегатов. Функции протеогликанов в соединительной ткани во многом определяются свойствами входящих в их состав гликозаминогликанов. Так, ионообменная активность гликозаминогликанов как полианионов обусловливает активную роль протеогликанов в распределении ряда катионов в соединительной ткани.
110. Мукополисахаридоз у детей – наследственная лизосомальная болезнь накопления.
Мукополисахаридозы по характеру возникающих изменений костной системы относятся к заболеваниям, при которых поражаются эпифизы костей. Именно с этим обстоятельством связаны трудности в их распознавании, так как они имеют большое сходство с другими эпифизарными дисплазиями. В некоторых случаях, когда в условиях стационара отсутствуют возможности более полного обследования лиц с имеющейся патологией опорно-двигательного аппарата, возможна постановка неправильного диагноза. Это приводит к неправильному ортопедическому лечению и медико-генетическому консультированию по вопросам дальнейшего деторождения. Все мукополисахаридозы разделяются на две группы в зависимости от возникающих у человека проявлений этой патологии: Гурлер-подобные и Моркио-подобные. Все возможные проявления мукополисахаридозов в Гурлер-подобной группе являются однотипными и различаются между собой в большей степени только по тяжести проявления. В случае такого заболевания дети рождаются абсолютно нормальными, а с течением времени постепенно начинают появляться и прогрессивно нарастают различные костные деформации. Выделяют несколько вариантов: Наиболее тяжело протекает мукополисахаридоз типа 1Н. Первые проявления этого заболевания появляются в первые месяцы жизни ребенка и быстро прогрессируют. Наблюдается резкое снижение умственного развития. К 2—3 годам развивается типичная картина болезни. Но надо помнить, что проявления мукополисахаридоза типа 1Н на первом году жизни очень сходны с проявлениями врожденного гипотиреоза. В случае гипотиреоза у ребенка также отмечается отставание в умственном развитии. Другой тип мукополисахаридоза из Гурлер-подобной группы по картине костных изменений похож на тип 1Н. Отличием является то, что страдают всегда только мальчики, большая часть из которых имеют светлые волосы и темные густые брови. Для этого типа мукополисахаридоза характерно исчезновение координации движений к 2—6 годам. Ребенок при этом начинает часто падать при ходьбе. Поведение детей становится неровным, а в некоторых случаях даже агрессивным. Они плохо едят твердую пищу. Между лопатками у некоторых детей можно увидеть появление узелкового поражения кожи. Черты лица изменяются не столь резко, как при вышеописанной форме мукополисахаридоза.При мукополисахаридозе типа IS, который также относится к этой группе мукополисахаридозов, первые признаки появляются поздно, как правило, в 3—6-летнем возрасте, и развиваются крайне медленно. Полная картина заболевания выявляется к моменту половой зрелости ребенка. В подростковом возрасте довольно часто при осмотре окулистом выявляется помутнение роговицы глаза. Увеличение размеров печени и селезенки бывает редко. Для данного типа мукополисахаридоза типичным является поражение клапана аорты, что проявляется характерными для этого заболевания признаками. Умственное развитие детей снижено не столь значительно, а иногда не страдает вовсе. Поражение костно-суставной системы при этом заболевании по тяжести является самым легким из всех мукополисахаридозов Гурлер-подобного типа. Следующим типом мукополисахаридоза из группы Гурлер-подобного типа является мукополисахаридоз VI типа — синдром Марото—Лами. Первые признаки данного синдрома появляются после 2-летнего возраста и к 7—9 годам становятся очень характерными. Такие дети достигают роста не более 145—155 см. У них также грубые черты лица, но не настолько, как при мукополисахаридозах VI типа, в суставах выражены контрактуры, дети как бы «скованы» при совершении каких-либо движений. Характерной чертой этого типа мукополисахаридоза является то, что, несмотря на резкую выраженность всех основных проявлений, умственное развитие детей никогда не страдает. Последние два рассмотренных типа мукополисахаридоза сопровождаются всеми характерными изменениями скелета, указанными выше.
111.Биохимия мышц. Состав мышечной ткани. Экстративные (миофибриллярные белки). Важнейшие экстративные вещества мышц: креатин и креатинфосфат. Значение миоглобина, регуляторные белки. Биохимические показатели при поражении мышечной системы. Креатинурия.
Мышечный аппарат человека и животных характеризуется полифункциональностью. Однако основной функцией мышц является осуществление двигательного акта, т.е. сокращение и расслабление. При сокращении мышц осуществляется работа, связанная с превращением химической энергии в механическую. В данном разделе в основном рассматривается структурная основа процесса сокращения поперечно-полосатых мышц позвоночных, поскольку этот процесс изучен наиболее полно. Как отмечалось, сократительная система поперечно-полосатой мышцы состоит из перекрывающихся белковых нитей, которые скользят относительно друг друга. Сокращение происходит за счет энергии, освобождающейся пргидролизе АТФ. В поперечно-полосатой мышце сокращение зависит от концентрации ионов Са2+, которая в свою очередь регулируется саркоплазматическим ретикулумом – специализированной системой мембран, накапливающей Са2+ в состоянии покоя и высвобожающей его при воз- действии на мышечное волокно нервного импульса. Источники энергии мышечной деятельности. Прежде всего ресинтез АТФ обеспечивается трансфосфорилированием АДФ с креатинфосфатом. Данная реакция катализируется ферментом креатинкиназой. Креатинкиназный путь ресинтеза АТФ является чрезвычайно быстрым и максимально эффективным (за счет каждой молекулы креатинфосфата образуется молекула АТФ). Именно поэтому долгое время не удавалось установить уменьшение концентрации АТФ и соответственно повышение концентрации АДФ даже при достаточно продолжительном тетанусе. Применив специфический ингибитор креатинкиназы (1-фтор-2,4-динитрофенол), а также с помощью агентов, препятствующих окислительному фосфорилированию АДФ в АТФ, Т. При работе умеренной интенсивности мышца может покрывать свои энергетические затраты за счет аэробного метаболизма. Однако при больших нагрузках, когда возможность снабжения кислородом отстает от потребности в нем, мышца вынуждена использовать гликолитический путь снабжения энергией. При интенсивной мышечной работе скорость расщепления гликогена или глюкозы с образованием молочной кислоты увеличивается в сотни раз. Соответственно содержание молочной кислоты в мышечной ткани может повышаться до 1,0–1,2 г/кг и более. С током крови значительное количество молочной кислоты поступает в печень, где ресинтезируется в глюкозу и гликоген (глюконеогенез) за счет энергии окислительных процессов. Перечисленные механизмы ресинтеза АТФ при мышечной деятельности включаются в строго определенной последовательности. Наиболее экстренным является креатинкиназный механизм, и лишь примерно через 20 с максимально интенсивной работы начинается усиление гликолиза, интенсивность которого достигает максимума через 40–80 с. При более длительной, а следовательно, и менее интенсивной работе все большее значение приобретает аэробный путь ресинтеза АТФ. Содержание АТФ и креатинфосфата в сердечной мышце ниже, чем в скелетной мускулатуре, а расход АТФ велик. В связи с этим ресинтез АТФ в миокарде должен происходить намного интенсивнее, чем в скелетной мускулатуре. Для сердечной мышцы теплокровных животных и человека основным путем образования богатых энергией фосфорных соединений является путь окислительного фосфорилирования, связанный с поглощением кислорода. Регенерация АТФ в процессе анаэробного расщепления углеводов (гликолиз) в сердце человека практического значения не имеет. Именно поэтому сердечная мышца очень чувствительна к недостатку кислорода. Характерной особенностью обмена веществ в сердечной мышце по сравнению со скелетной является также то, что аэробное окисление веществ неуглеводной природы при работе сердечной мышцы имеет большее значение, чем при сокращении скелетной мышцы. Только 30–35% кислорода, поглощаемого сердцем в норме, расходуется на окисление углеводов и продуктов их превращения. Главным субстратом дыхания в сердечной мышце являются жирные кислоты. Окисление неуглеводных веществ обеспечивает около 65–70% потребности миокарда в энергии. Из свободных жирных кислот всердечной мышце особенно легко подвергается окислению олеиновая кислота.
112.Химизм мышечного сокращения. Связь химических процессов в мышце с функцией. Роль кальция в мышечном сокращении. Своеобразие обмена миокарда. Особенности обмена мышечной ткани в состоянии покоя и усиленной работы. Биохимические основы мышечного утомления, значение тренировки мышц.
В настоящее время принято считать, что биохимический цикл мышечного сокращения состоит из 5 стадий: 1) миозиновая ≪головка≫ может гидролизовать АТФ до АДФ и Н3РО4 (Pi), но не обеспечивает освобождения продуктов гидролиза. Поэтому данный процесс носит скорее стехиометрический, чем каталитический, характер; 2) содержащая АДФ и Н3РО4 миозиновая ≪головка≫ может свободно вращаться под большим углом и (при достижении нужного положения) связываться с F-актином, образуя с осью фибриллы угол около 90°; 3) это взаимодействие обеспечивает высвобождение АДФ и Н3РО4 из актин-миозинового комплекса. Актомиозиновая связь имеет наименьшую энергию при величине угла 45°, поэтому изменяется угол миозина с осью фибриллы с 90° на 45° (примерно) и происходит продвижение актина (на 10–15 нм) в направлении центра саркомера; 4) новая молекула АТФ связывается с комплексом миозин–F-актин ; 5) комплекс миозин–АТФ обладает низким сродством к актину, и поэтому происходит отделение миозиновой (АТФ) ≪головки≫ от F-актина - расслабление, которое отчетливо зависит от связывания АТФ с актин-миозиновым комплексом. Затем цикл возобновляется. Регуляция сокращения и расслабления мышц. Сокращение любых мышц происходит по общему механизму, описанному ранее. Мышечные волокна разных органов могут обладать различными молекулярными механизмами регуляции сокращения и расслабления, однако всегда ключевая регуляторная роль принадлежит ионам Са2+ . Установлено, что миофибриллы обладают способностью взаимодействовать с АТФ и сокращаться в его присутствии лишь при наличии в среде определенных концентраций ионов кальция. Наибольшая сократительная активность наблюдается при концентрации ионов Са2+ около 10–6–10–5 М. При понижении концентрации до 10–7 М или ниже мышечные волокна теряют способность к укорочению и развитию напряжения в присутствии АТФ. По современным представлениям, в покоящейся мышце (в миофибриллах и межфибриллярном пространстве) концентрация ионов Са2+ поддерживается ниже пороговой величины в результате связывания их структурами (трубочками и пузырьками) саркоплазматической сети и так называемой Т-системой при участии особого Са2+-связывающего белка, получившего название кальсеквестрина, входящего в состав этих структур. Связывание ионов Са2+ разветвленной сетью трубочек и цистерн саркоплазматической сети не является простой адсорбцией. Это активный физиологический процесс, который осуществляется за счет энергии, освобождающейся при расщеплении АТФ Са2+-зависимой. Возможность пребывания живой мышцы в расслабленном состояниипри наличии в ней достаточно высокой концентрации АТФ объясняется снижением в результате действия кальциевой помпы концентрации ионов Са2+ в среде, окружающей миофибриллы, ниже того предела, при котором еще возможны проявление АТФазной активности и сократимость актомиозиновых структур волокна.
113.Роль креатинфосфата в мышечном сокращении у ребенка. Физиологическая креатинурия. Врожденные энзимопатии (фосфорилаза и фосфоглюкомутаза), приводящие к патологии мышечной системы.
Креатинфосфат — продукт обратимого метаболического N-фосфорилирования креатина, являющийся, подобно АТФ, высокоэнергетическим соединением. Креатинфосфат содержится преимущественно в возбудимых тканях (мышечная и нервная ткани) и его биологической функцией является поддержание постоянной концентрации АТФ за счёт обратимой реакции перефосфорилирования:
креатинфосфат + АДФ ⇔ креатин + АТФ
Эта реакция катализируется цитоплазматическими и митохондриальными ферментами-креатинкиназами; при расходе АТФ, например, при сокращении клеток мышечной ткани, равновесие реакции сдвигается в вправо, что ведёт к восстановлению нормальной концентрации АТФ. В тканях креатинфосфат подвергается самопроизвольному неферментативному гидролизу с циклизацией в креатинин, выводящийся с мочой, уровень выделения креатинина зависит от состояния организма, меняясь при патологических состояниях, и является диагностическим признаком.
114.Биохимия мышечной ткани у детей.
Скелетные мышцы у новорождённого анатомически сформированы и сравнительно хорошо развиты, их общая масса составляет 20-22% массы тела. К 2 годам относительная масса мышц несколько уменьшается (до 16,6%), а затем в связи с нарастанием двигательной активности ребёнка вновь увеличивается и к 6 годам достигает 21,7%, к 8 - 2728%, а к 15 - 3233%. У взрослых она составляет в среднем 40-44% массы тела. Фасции у новорождённого тонкие, рыхлые, легко отделяются от мышц. Мышцы ребёнка характеризуются рядом функциональных особенностей. Так, у детей отмечают повышенную чувствительность мышц к некоторым гуморальным агентам (в частности, к ацетилхолину). Во внутриутробном периоде скелетные мышцы отличаются низкой возбудимостью. Мышца воспроизводит лишь 3-4 сокращения в секунду. С возрастом число сокращений доходит до 60-80 в секунду. Созревание нервномышечного синапса приводит к значительному ускорению перехода возбуждения с нерва на мышцу. У новорождённых мышцы не расслабляются не только во время бодрствования, но и во сне. Постоянную их активность объясняют участием мышц в теплопродукции (так называемый сократительный термогенез) и метаболических процессах организма, стимуляции развития самой мышечной ткани. Мышечный тонус может быть ориентиром при определении гестационного возраста новорождённого. Гипоксия — состояние кислородного голодания как всего организма в целом, так и отдельных органов и тканей, вызванное различными факторами: задержкой дыхания, болезненными состояниями, малым содержанием кислорода в атмосфере. Вследствие гипоксии в жизненно важных органах развиваются необратимые изменения. Наиболее чувствительными к кислородной недостаточности являются центральная нервная система, мышца сердца, ткани почек, печени. Может вызывать появление необъяснимого чувства эйфории, приводит к головокружениям, низкому мышечному тонусу. В общем случае гипоксию можно определить как несоответствие энергопродукции энергетическим потребностям клетки. Основное звено патогенеза — нарушение окислительного фосфорилирования в митохондриях, имеющее 2 последствия:1. Нарушение образования АТФ → энергодефицит → нарушение энергозависимых процессов, а именно: сокращения — контрактура всех сократимых структур, синтеза — белков, липидов, нуклеиновых кислот, активного транспорта — потеря потенциала покоя, поступление в клетку ионов кальция и воды. 2. Накопление молочной кислоты и кислот цикла Кребса → ацидоз, вызывающий: блокаду гликолиза, единственного пути получения АТФ без кислорода; повышение проницаемости плазматической мембраны; активацию лизосомальных ферментов в цитоплазме с последующим аутолизом клетки.
115.Наличие общей тенденции к повышенной активности окислительно-восстановительных ферментов и усиление сопряженности окисления с фосфорилированием в раннем постанальном онтогенезе. Причины этого явления.
116.Особенности химического состава и метаболизма нервной ткани (дыхание, обмен глюкозы и гликогена, обмен макроэргов, липидов, белков и аминокислот). Обмен мозга при гипоксии. Пептиды и болевые реакции.
Дыхание. На долю головного мозга приходится 2–3% от массы тела. В то же время потребление кислорода головным мозгом в состоянии физического покоя достигает 20–25% от общего потребления его всем организмом, а у детей в возрасте до 4 лет мозг потребляет даже 50% кислорода, утилизируемого всем организмом. Во время прохождения через мозг кровь теряет около 8 об.% кислорода. В 1 мин на 100 г мозговой ткани приходится 53–54 мл крови. Следовательно, 100 г мозга потребляет в 1 мин 3,7 мл кислорода, а весь головной мозг (1500 г) – 55,5 мл кислорода. Метаболизм углеводов . Основным субстратом дыхания мозговой ткани является глюкоза. В 1 мин 100 г ткани мозга потребляют в среднем 5 мг глюкозы. Подсчитано, что более 90% утилизируемой глюкозы в ткани мозга окисляется до СО2 и Н2О при участии цикла трикарбоновых кислот. В физиологических условиях роль пентозофосфатного пути окисления глюкозы в мозговой ткани невелика, однако этот путь окисления глюкозы присущ всем клеткам головного мозга. Образующаяся в процессе пентозофосфатного цикла восстановленная форма НАДФ (НАДФН) используется для синтеза жирных кислот и стероидов. Интересно отметить, что в расчете на всю массу головного мозга содержание глюкозы в нем составляет около 750 мг. За 1 мин тканью мозга окисляется 75 мг глюкозы. Следовательно, количество глюкозы, имеющееся в ткани головного мозга, могло бы быть достаточным лишь на 10 мин жизни человека. Метаболизм макроэргов. Интенсивность обновления богатых энергией фосфорных соединений в го- ловном мозге очень велика. Именно этим можно объяснить, что содержание АТФ и креатинфосфата в мозговой ткани характеризуется значитель- ным постоянством. В случае прекращения доступа кислорода мозг может ≪просуществовать≫ немногим более минуты за счет резерва лабильных фосфатов. Метаболизм аминокислот и белков Общее содержание аминокислот в ткани мозга человека в 8 раз превышает концентрацию их в крови. Аминокислотный состав мозга отличается определенной специфичностью. Так, концентрация свободной глутаминовой кислоты в мозге выше, чем в любом другом органе млекопитающих (10 мкмоль/г). На долю глутаминовой кислоты вместе с ее амидом глутамином и трипептидом глутатионом приходится более 50% α-аминоазота головного мозга. Известно, что обмен аминокислот в мозговой ткани протекает в разных направлениях. Прежде всего пул свободных аминокислот используется как источник ≪сырья≫ для синтеза белков и биологически активных аминов. Метаболизм липидов Липиды составляют около половины сухой массы головного мозга. Как отмечалось, в нервных клетках серого вещества особенно много фосфоглицеридов, а в миелиновых оболочках нервных стволов – сфингомиелина. Из фосфоглицеридов серого вещества мозга наиболее интенсивно обновляются фосфатидилхолины и особенно фосфатидилинозитол. Обмен липидов миелиновых оболочек протекает с небольшой скоростью. Холестерин, цереброзиды и сфингомиелины обновляются очень медленно. Ткань головного мозга взрослого человека содержит много холестерина (около 25 г). У новорожденных в головном мозге всего 2 г холестерина; количество его резко возрастает в первый год жизни (примерно в 3 раза), при этом биосинтез холестерина происходит в самой мозговой ткани. У взрослых людей синтез холестерина в головном мозге резко снижается. Основная часть холестерина в зрелом мозге находится в неэтерифици- рованном состоянии, эфиры холестерина обнаруживаются в относительно высокой концентрации в участках активной миелинизации.
117.Химическая основа возникновения и проведения нервного импульса. Механизмы синаптической передачи. Медиаторы: ацетилхолин, катехоламины, серотонин, гаммааминомасляная кислота, гистамин, глутаминовая кислота. Нарушение обмена биогенных аминов.
При определенных условиях резко повышается проницаемость мембраны для ионов Na+. В состоянии покоя внутренняя сторона клеточной мембраны заряжена электроотрицательно по отношению к наружной поверхности. Таким образом, на мембранах, ограничивающих нервные клетки, поддерживается разность электрических потенциалов (трансмембранная разность электрических потенциалов); эти мембраны электрически возбудимы. При возбуждении, вызванном тем или иным агентом, селективно изменяется проницаемость мембраны нервной клетки (аксона): увеличиваетсяизбирательно для ионов Na+ (примерно в 500 раз) и остается без изменения для ионов К+. В результате ионы Na+ устремляются внутрь клетки. Компенсирующий поток ионов К+, направляющийся из клетки, несколько запаздывает. Это приводит к возникновению отрицательного заряда на наружной поверхности клеточной мембраны. Внутренняя поверхность мембраны приобретает положительный заряд; происходит перезарядка клеточной мембраны (в частности, мембраны аксона, т.е. нервного волокна), и возникает потенциал действия, или спайк. Продолжительность спайка не превышает 1 мс. Он имеет восходящую фазу, пик и нисходящую фазу. Нисходящая фаза (падение потенциала) связана с нарастающим преобла- данием выхода ионов К+ над поступлением ионов Na+ – мембранный потенциал возвращается к норме. После проведения импульса в клетке восстанавливается состояние покоя. Некоторые заболевания, например рассеянный склероз, характеризуются демиелинизацией и нарушением проведения нервного импульса. Другим не менее важным процессом для нервной ткани является передача нервного импульса от одной нервной клетки к другой или воздействие на клетки эффекторного органа. Роль медиаторов в передаче нервных импульсов Связь миллиардов нейронов мозга осуществляется посредством медиаторов. Химическое вещество можно отнести к числу медиаторов лишь в том случае, если оно удовлетворяет ряду критериев. В нервных волокнах должны содержаться ферменты, необходимые для синтеза этого вещества. При раздражении нервов это вещество должно выделяться, реагировать со специфическим рецептором на постсинаптической клетке и вызывать биологическую реакцию – ацетилхолин и норадреналин. Содержащие их нервы называют соответственно холинергическими и адренергическими. В соответствии с этим все эфферентные системы делят на холинорецепторы и адренорецепторы. Ряд других химических веществ удовлетворяют многим, но не всем перечисленным критериям. К таким медиаторам относят дофамин, адреналин, серотонин, октопамин, гистамин, ГАМК и др. Обширная группа холинорецепторов весьма неоднородна как в струк- турном, так и в функциональном отношении. Объединяют их медиатор ацетилхолин и общая схема строения синапса. Ацетилхолин - представляет собой сложный эфир уксусной кислоты и холина. Он синтезируется в нервной клетке из холина и активной формы ацетата – ацетилкоэнзима А при помощи специального фермента холинацетилтрансферазы (холинацетилазы). Этот фермент удаляет аминогруппу (—NH2) у норадреналина, серотонина, дофамина и адреналина, тем самым инактивируя указанные медиаторы. Норадреналин быстро исчезает из синаптической щели в результате вторичного поглощения симпатическими нервами; вновь оказавшись в нервном волокне, медиатор, естественно, не может воздействовать на постсинаптические клетки. Адренергическая и холинергическая системы головного мозга тесно взаимодействуют с другими системами мозга, в часто использующими серотонин в качестве медиатора. В основном серотонинсодержащие нейроны сосредоточены в ядрах мозгового ствола. Нейромедиаторная роль серотонина осуществляется в результате взаимодействия серотонина со специфическими серотонинергическими рецепторами. Исследования, проведенные с ингибитором синтеза серотонина n-хлорфенилаланином, а также с другими ингибиторами, дают основания считать, что серотонин влияет на процессы сна. Выявлено также, что торможение кортикостероидами секреторной активности гипофиза оказывается менее эффективным у тех животных, мозг которых беднее серотонином. Важным нейромедиатором, выполняющим тормозные функции, является γ-аминомасляная кислота (ГАМК), количество которой в головном мозге во много раз больше, чем других нейромедиаторов. Так, в гипоталамусе суммарное содержание ацетилхолина, норадреналина, дофамина и серотонина не превышает 10 мкг/г, в то время как ГАМК в этом отделе головного мозга более 600 мкг/г. ГАМК увеличивает проницаемость постсинаптических мембран для ионов К+ и тем самым отдаляет мембранный потенциал от порогового уровня, при котором возникает потенциал действия; таким образом, ГАМК – это тормозной нейромедиатор. ГАМК образуется при декарбоксилировании глутамата в реакции, катализируемой глутаматдекарбоксилазой:
118.Своеобразие химического состава и метаболических процессов мозга плода и у ребенка раннего возраста.
 Серое вещество головного мозга представлено в основном телами нейронов, а белое вещество – аксонами. В связи с этим указанные отделы мозга значительно различаются по своему химическому составу. Эти различия носят прежде всего количественный характер. Содержание воды в сером веществе головного мозга заметно больше, чем в белом. В сером веществе белки составляют половину плотных веществ, а в белом веществе – одну треть. На долю липидов в белом веществе приходится более половины сухого остатка, в сером веществе – лишь около 30%. Масса мозга у плода в 18 нед. равна 67 г, у плода в 24 нед. — 127 г, в 32 нед. — 170 г. В дальнейшем продолжается более быстрое развитие мозга плода и в 40 нед. масса мозга плода составляет 382 г.
Серое вещество головного мозга представлено в основном телами нейронов, а белое вещество – аксонами. В связи с этим указанные отделы мозга значительно различаются по своему химическому составу. Эти различия носят прежде всего количественный характер. Содержание воды в сером веществе головного мозга заметно больше, чем в белом. В сером веществе белки составляют половину плотных веществ, а в белом веществе – одну треть. На долю липидов в белом веществе приходится более половины сухого остатка, в сером веществе – лишь около 30%. Масса мозга у плода в 18 нед. равна 67 г, у плода в 24 нед. — 127 г, в 32 нед. — 170 г. В дальнейшем продолжается более быстрое развитие мозга плода и в 40 нед. масса мозга плода составляет 382 г.
119.Биохимия печени. Структура и химический состав ткани печени. Регуляция углеводного и липидного обменов. Регуляция обмена белков, аминокислот, азотистых оснований, синтеза мочевины. Участие печени в метаболизме витаминов, водно-солевом обмене. Роль печени как депо. Экскреторная функция обезвреживания: реакции конъюгации с таурином и глицином, глюкуроновой и серной кислотами, реакции метилирования. Участие печени в обезвреживании экотоксинов при микросомальном окислении.
У взрослого здорового человека масса печени составляет в среднем 1,5 кг. В печени может содержаться 150–200 г гликогена. Количество железа, меди, марганца, никеля и некоторых других элементов превышает их содержание в других органах и тканях. Основная роль печени в углеводном обмене заключается в обеспечении постоянства концентрации глюкозы в крови. Синтез гликогена из глюкозы обеспечивает в норме временный резерв углеводов, необходимый для поддержания концентрации глюкозы в крови в тех случаях, если ее содержание значительно уменьшается (например, у человека это происходит при недостаточном поступлении углеводов с пищей или в период ночного ≪голодания≫). Ферментные системы печени способны катализировать все реакции или значительное большинство реакций метаболизма липидов. Совокупность этих реакций лежит в основе таких процессов, как синтез высших жирных кислот, триглицеридов, фосфолипидов, холестерина и его эфиров, а также липолиз триглицеридов, окисление жирных кислот, образование ацетоновых (кетоновых) тел и т.д. При высоком содержании жирных кислот в плазме их поглощение печенью возрастает, усиливается синтез триглицеридов, а также окисление жирных кислот, что может привести к повышенному образованию кетоновых тел. Печень играет центральную роль в обмене белков. Она выполняет следующие основные функции: синтез специфических белков плазмы; образование мочевины и мочевой кислоты; синтез холина и креатина; трансаминирование и дезаминирование аминокислот, что весьма важно для взаимных превращений аминокислот, а также для процесса глюконеогенеза и образования кетоновых тел. В организме образование мочевины в основном происходит в печени. Детоксикация различных веществ в печени. Чужеродные вещества (ксенобиотики) в печени нередко превращаются в менее токсичные и даже индифферентные вещества. Происходит это путем окисления, восстановления, метилирования, ацетилирования и конъюгации с теми или иными веществами. Необходимо отметить, что в печени окисление, восстановление и гидролиз чужеродных соединений осуществляют в основном микросомальные ферменты. Наряду с микросомальным в печени существует также пероксисомальное окисление. Пероксисомы – микротельца, обнаруженные в гепатоцитах; их можно рассматривать как специализированные окислительные органеллы. Эти микротельца содержат оксидазу мочевой кислоты, лактатоксидазу, оксидазу D-аминокислот, а также каталазу. Последняя катализирует расщепление перекиси водорода, которая образуется при действии указанных оксидаз; отсюда и название этих микротелец – пероксисомы.
120.Важность определения функционального состояния печени в детском возрасте.
Печень у детей относительно большая, у новорожденных она составляет около 4 % массы тела (у взрослых — 2 % массы тела). У детей раннего возраста желчеобразование менее интенсивное, чем у детей более старшего возраста. Желчь детей бедна желчными кислотами, холестерином, лецитином, солями и щелочью, но богата водой, муцином, пигментами и мочевиной, а также больше содержит таурохолевой, чем гликохолевой кислоты. Важно отметить, что таурохолевая кислота является антисептиком. Желчь нейтрализует кислую пищевую кашицу, что делает возможной деятельность поджелудочного и кишечного секретов. Кроме того, желчь активирует панкреатическую липазу, эмульгирует жиры, растворяет жирные кислоты, превращая их в мыла, усиливает перистальтику толстого отдела кишечника. Таким образом, система органов пищеварения у детей отличается рядом анатомо-физиологических особенностей, которые отражаются на функциональной способности этих органов. У ребенка на первом году жизни потребность в пище относительно большая, чем у детей старшего возраста. Хотя у ребенка имеются все необходимые пищеварительные ферменты, функциональная способность органов пищеварения ограничена и может быть достаточной только при условии, если ребенок получает физиологическую пищу, а именно женское молоко. Даже небольшие отклонения в количестве и качестве пищи могут вызвать у грудного ребенка расстройства пищеварения (особенно часты они на 1-м году жизни) и в конечном итоге привести к отставанию физического развития.








