6. Обратные процессы десорбции и массопереноса продуктов реакции.
Кинетика электродных процессов. Поляризация и перенапряжение.
Скорость и механизм протекания электрохимических реакций изучает электрохимическая кинетика.
Электрохимические процессы - это специфическая разновидность химических процессов, в которой одним из реагентов или продуктов химической реакции являются свободные электроны. И именно количество электронов, участвующих в каждом элементарном акте реакции в единицу времени, определяет ее скорость. При этом электрохимические процессы - это процессы в гетерогенных системах на границе раздела фаз «электролит-электрод».
Определяющей характеристикой для скорости электрохимических реакций является величина плотности тока i:
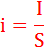
где I – ток, протекающий в электрохимической системе, S – площадь электрода.
Скорости анодного и катодного процессов могут различаться из-за разности площадей анода и катода.
Гетерогенный электрохимический процесс является последовательным процессом, состоящим из нескольких стадий:
1. Массоперенос реагентов из объема электролита к границе двойного электрического слоя электродов;
2. Переход реагентов через двойной электрический слой к межфазной границе электролит-электрод;
3. Сорбция реагентов на поверхности электрода;
4. Переход заряженных частиц (электронов и ионов) через межфазную границу электрод-электролит (непосредственно электрохимическая стадия);
5. Фазовые превращения, сопровождающие образование твердых веществ, а также газообразных продуктов реакции;
6. Обратные процессы десорбции и массопереноса продуктов реакции.
В более упрощенном варианте:
- Подвод реагентов к электроду
- Электрохимическая стадия разряда-ионизации, включающая и химические реакции
- Отвод продуктов реакции от электрода
Равновесные потенциалы электродов могут быть определены при отсутствии тока в цепи.
При протекании тока каждая из стадий гетерогенного электрохимического процесса требует энергозатрат на свое осуществление, поэтому возникает явление поляризации электродов – изменения потенциала электрода по сравнению с равновесным при протекании тока.
ΔE = Ei – E,
ΔE – поляризация; Ei – потенциал электрода при прохождении тока; E – равновесный потенциал.
В зависимости от концентрации, температуры, плотности тока и ряда других факторов, стадии гетерогенного электрохимического процесса оказывают различное сопротивление движению реагентов и продуктов реакции. Поэтому каждая из них при определенных условиях может стать лимитирующей.
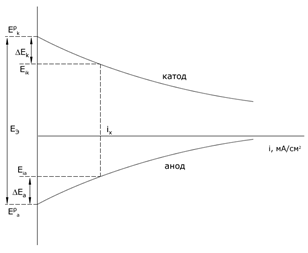
Для экспериментального определения поляризации строят кривую зависимости потенциала электрода от протекающего через электрод тока. Графическую зависимость потенциала электрода от плотности тока называют поляризационной кривой.
| 
|
| гальванический элемент | электролизер |
Величину поляризации электрода можно определить по разности между потенциалом при прохождении тока и равновесным потенциалом. Различают анодную и катодную поляризацию. При одной и той же плотности тока анодная и катодная поляризация может быть различна.
В работающем ГЭ при прохождении тока I напряжение U меньше ЭДС из-за явления поляризации катода (DEК) и анода (DЕА) и омического падения напряжения на сопротивлении r1 в проводниках с электронной проводимостью (проводниках первого рода) и на сопротивлении r2 в электролите (проводнике второго рода):
U = EЭ - ΔEk – ΔEa - I(r1 + r2)
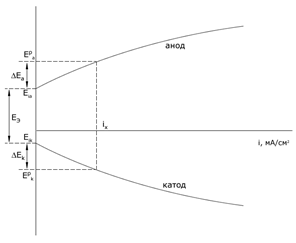
На работающем электролизере разность потенциалов электродов больше минимальной разности равновесных потенциалов Up – напряжения разложения:
U = Up + ΔEk + ΔEa + I(r1 + r2)
Скорость электрохимической реакции обусловлена скоростью самой медленной стадии.
Концентрационная поляризация – изменение потенциала электрода вследствие изменения концентрации реагентов в приэлектродном слое при прохождении тока. По уравнению Нернста потенциал электрода пропорционален логарифму активностей (концентраций в разбавленных растворах) ионов, значит концентрационная поляризация пропорциональна разности логарифмов активностей (концентраций) ионов в приэлектродном слое и в объеме раствора:
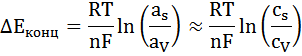
Плотность тока i, проходящего через электрод, определяется коэффициентом диффузии D, толщиной слоя раствора около поверхности электрода, в котором происходит изменение концентрации реагента только путем диффузии δ (диффузионного слоя), а также концентрацией реагента у поверхности электрода cs и в объеме cV:
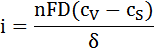
Если концентрация у поверхности электрода cs близка к нулю, то выражение для максимальной предельно возможной плотности тока iпр, который проходит через электрод:
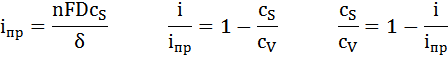
Отсюда
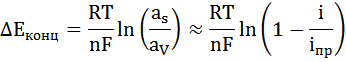
Концентрационная поляризация растет с увеличением плотности тока, снижается при выравнивании концентраций реагента в объеме и у поверхности электрода, т.е. с уменьшением толщины диффузионного слоя δ, т.е. при перемешивании.
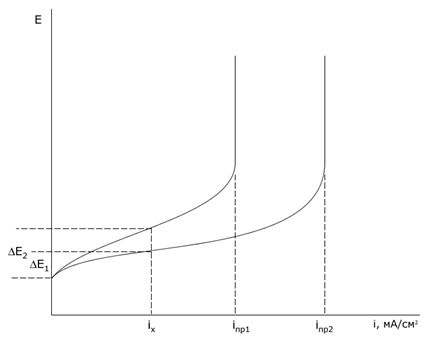
Электрохимическая поляризация (перенапряжение) – изменение потенциала, обусловленное замедленностью электрохимических стадий реакции. Замедленность электрохимических стадий объясняется перестройкой структуры реагирующих частиц в ходе реакции. Как и другие химические реакции, электрохимические реакции происходят, только при условии, что частицы обладают достаточной энергией, которая больше или равна энергии активации.
Скорость электрохимической реакции может быть увеличена применением катализатора и повышением температуры. Энергия электрохимической реакции может быть снижена при изменении потенциала электрода по сравнению с его равновесным потенциалом, т.е. при поляризации. Чем больше энергия активации, тем большая поляризация требуется для обеспечения определенной скорости электрохимического процесса (плотности тока).
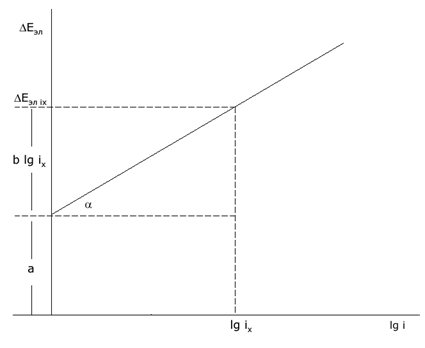
Связь между электрохимическим перенапряжением ΔEэл и плотностью тока i выражается уравнением Тафеля:
ΔEэл = a + b lgi
Константа b зависит от природы реакции и температуры, при 298 К обычно имеет значение 0,03-0,15. Константа a зависит от природы реакции, материала электрода, состава раствора и температуры. При i = 1 поляризация ΔEэл = a. Константы a и b уравнения Тафеля определяют из графика зависимости поляризации электрода от логарифма плотности тока.
Электрохимическое перенапряжение может быть снижено применением электрокатализаторов, например, водородное перенапряжение можно снизить использованием платиновых, палладиевых электродов, или электродов, сделанных из металлов группы железа.
Электрохимическое перенапряжение снижается с увеличением температуры, концентрации реагента, площади электрода и не зависит от перемешивания раствора.
Электролиз.
На прошлой лекции мы говорили, что в электрохимических системах могут протекать два вида процессов – самопроизвольные и под действием внешнего источника электрического тока.
Гальваническим элементом (ГЭ) называется электрохимическая система, в которой химическая энергия самопроизвольно превращается в электрическую.
Электролиз – процессы, происходящие на электродах под действием тока, подаваемого от внешнего источника. При электролизе происходит электрической работы в химическую.
Ячейка для электролиза называется электролизером и состоит из двух электродов, электролита. Внешняя цепь включает источник тока, вольтметр и амперметр.
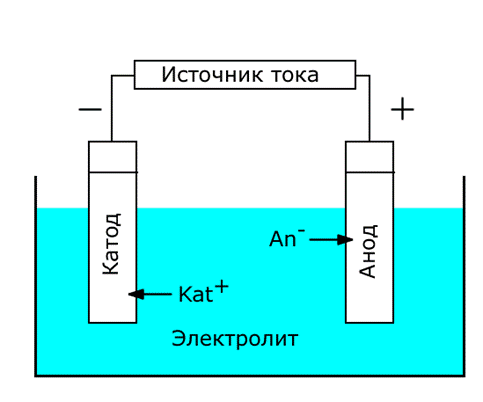
!!!!!! Под действием электрического поля беспорядочное движение ионов в электролите превращается в направленное: положительно заряженные ионы (катионы) перемещаются к отрицательному электроду – катоду, отрицательно заряженные ионы (анионы) движутся к положительному электроду – аноду.
На катоде происходят процессы восстановления: положительные ионы или нейтральные молекулы принимают электроны и переходят в восстановленную форму. На катоде в первую очередь идут процессы, характеризующиеся более положительным потенциалом, т.е. восстанавливаются более сильные окислители.
На аноде могут окисляться анионы, нейтральные молекулы и сам материал анода. Анод может быть растворимым, т.е. окисляться в условиях электролиза, и инертным, нерастворимым, т.е. не участвовать в анодном процессе. К растворимым или частично растворимым анодам относятся Zn, Cu, Fe, Cd, Ag, Ni, Co и т.д., к нерастворимым – Pt, Pd и некоторые другие благородные металлы в определенных условиях, а также графит С. На аноде в первую очередь окисляются более сильные восстановители, т.е. идут процессы, характеризующиеся более отрицательным потенциалом.
Электролиз подчиняется законам Фарадея и кинетическим законам. Для принудительного процесса (не протекающего самопроизвольно в прямом направлении):
1) Масса или количество вещества, претерпевшего превращение на электроде при протекании постоянного тока, прямо пропорционально количеству прошедшего электричества.
2) Массы веществ, прореагировавших на электродах при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов. Для электрохимического превращения 1 моль эквивалента вещества требуется одинаковое количество электричества F, называемое числом Фарадея.
Из второго закона следует, что при превращении на электроде одного моля эквивалентов любого вещества через электрод проходит 96500 Кл. Эта величина называется постоянной Фарадея F.
Для количественных расчетов процессов в электрохимических системах используют объединение двух законов Фарадея:
Для массы вещества
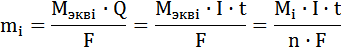
Для объема газообразных веществ
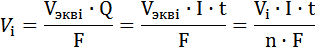
mi – масса i-го вещества, прореагировавшего на электроде, г;
Vi – объем газообразного вещества, прореагировавшего на электроде, л;
Mэквi – молярная масса эквивалентов i-го вещества, г/моль, Mэквi = M/n
Vэквi – объем моль-эквивалента газа, л/моль, Vэквi = V/n
Q – количество прошедшего электричества, Кл, Q = I·t, I – сила тока, А, t – время, с
При нормальных условиях (н.у.) 1 моль любого газа занимает объем 22,4 л, поэтому объем 1 моля эквивалента водорода при н.у. составляет V0эквH2=11,2 л, а кислорода - V0эквО2=5,6 л
Количество моль-эквивалентов веществ, испытавших электрохимические превращения на катоде и аноде, выраженные в моль-эквивалентах, равны между собой nКэкв = nАэкв.
На практике при протекании на электроде нескольких параллельных реакций фактическая масса превращенного i-го вещества miфакт меньше, чем рассчитанная mi, т.к. на превращение i-го вещества тратится только доля общего количества электричества, называемая выходом по току:
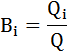
или
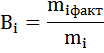
Qi – количество электричества, израсходованное на превращение i-го вещества.
Если на электроде протекает только одна реакция, то выход по току превращенного вещества I равнее 1.
В случае, когда Bi < 1
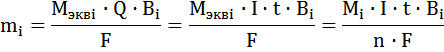
Зная количество затраченного электричества, можно рассчитать количество (массу, объем) вещества, превращенного на электроде и наоборот, зная количество превращенного вещества можно рассчитать количество электричества, которое прошло через электрохимическую систему.
Минимальная работа, приложенная к системе при электролизе равна изменению энергии Гиббса:
Amin = ΔG
ΔG = nFUmin
Umin = ЕЭ = EA - EK
Потенциал разложения или выделения: минимальное напряжение, при котором процесс электролиза становится возможным.
При прохождении тока изменяются потенциалы электродов, т.е. возникает электродная поляризация. Вследствие катодной поляризации потенциал катода становится более отрицательным, а из-за анодной – потенциал анода становится более положительным. Разность потенциалов электродов при прохождении тока больше разности равновесных потенциалов: (EiA - EiK) > (EA - EK).
Клемовое напряжение (напряжение электролизера) вследствие поляризации и омических потерь увеличивается:
U = Up + ΔEk + ΔEa + I·(r1 + r2)
Для уменьшения напряжения на клеммах электролизера (снижения энергопотребления) необходимо снижать омические потери, концентрационную и электрохимическую поляризацию.
Для снижения омических потерь:
- используют электролит с максимальной удельной электропроводностью;
- уменьшаю расстояние между электродами;
- увеличивают температуру;
- увеличивают площадь электродов;
- снижают концентрацию реагента.
Для снижения концентрационной поляризации и электрохимической поляризации:
- увеличивают площадь реагента;
- увеличивают температуру;
- увеличивают концентрацию реагента;
- используют перемешивание;
- используют электроды с каталитическим покрытием;
- снижают ток.
Электролиз расплавов и растворов электролитов.
При плавлении происходит термическая диссоциация солей:
NaCl → Na+ + Cl-
Если опустить в расплав нерастворимые электроды и подключить к ним внешний источник тока, то в расплаве начнется направленное движение ионов к соответствующим электродам.
На катоде будет протекать процесс восстановления ионов натрия:
Катод (-): Na+ + e → Na
На аноде – окисление хлорид-ионов до газообразного хлора:
Анод (+): Cl- - e → 1/2Cl2
Электроны с анода поступают во внешнюю цепь.
Если расплав имеет более сложный состав, т.е. в нем присутствуют катионы и/или анионы разных видов, необходимо уметь определять порядок разрядки анионов и катионов. В растворах электролитов, кроме катиона и аниона соли присутствуют ионы H+ и OH-, которые могут принимать участие в электродных процессах.
Чтобы правильно определить процессы электролиза, необходимо:
1) рассмотреть ионный состав электролита;
2) распределить ионы по электродам;
3) определить равновесные потенциалы возможных процессов. Для расчета равновесных потенциалов возможных процессов, используется уравнение Нернста. Если не указаны конкретные условия, то для оценочной характеристики процессов используются стандартные потенциалы материала анода E0Mn+/M, анионов E0An/Anm- и катионов E0Katn+/Kat.
4) Записать электродные процессы после сравнения электродных потенциалов. При относительно малом отличии равновесных потенциалов (менее 0,8¸1,0 В) на электродах возможно параллельное протекание нескольких процессов. Если на электроде идут одновременно несколько процессов, то доля количества электричества, пошедшего на каждый из процессов, называется выходом по току (Вj):
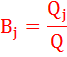
где Qj – количество электричества, пошедшее на конкретный процесс; Q – общее количество электричества, прошедшее через электрохимическую систему.
На катоде происходит восстановление окислителя, т.е. в первую очередь восстанавливаться будут наиболее сильные окислители. На катоде протекает реакция с наиболее положительным потенциалом. Для катодного восстановления при электролизе водного раствора электролита все окислители можно разделить на три группы.
1. Ионы металлов, потенциалы которых существенно более отрицательны, чем потенциал водородного электрода. К ним относятся ионы щелочных, щелочноземельных и других металлов, стоящих в ряду стандартных электродных потенциалов выше алюминия. В водных растворах разряд этих ионов практически не происходит, т.к. на катоде выделяется водород:
2H+ + 2e → H2
Данные металлы могут быть получены электролизом из расплавов солей, в которых отсутствует H+.
2. Окислители, потенциал которых более положителен, чем потенциал водородного электрода. К ним относятся ионы Cu2+, Ag+, Hg2+, Au3+, ионы платиновых металлов, кислород, галогены, диоксид свинца, перманганат-ион. При наличии в растворе этих окислителей они восстанавливаются в первую очередь, разряд ионов H+ не происходит.
3. Ионы, потенциал которых относительно мало отличается (менее 0,8¸1,0 В) от потенциала водородного электрода. К ним относятся ионы Sn2+, Pb2+, Ni2+, Co2+, Zn2+, Cd2+ и других металлов, находящихся в ряду стандартных электродных потенциалов между алюминием и водородом.
Стандартный потенциал водородного электрода равен 0 при активности ионов H+ и относительном давлении равном 1. В других условиях необходимо учитывать зависимость потенциала водородного электрода от давления и рН.
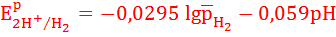
При относительном давлении р=1
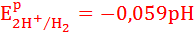
Например, при рН=5, 298 К и относительном давлении 1, потенциал водородного электрода равен: EP2H+/H2 = - 0,295 В. При это потенциал металлического электрода не зависит от рН:
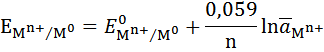
При рН = 5,0 потенциал водородного электрода становится отрицательнее стандартных потенциалов олова, свинца, кобальта и никеля.
На величину перенапряжения водорода влияют как материал электрода, так и плотность тока. Влияние материала электрода (катода) и катодной плотности тока на величину перенапряжения водорода.
| Материал электрода | Перенапряжение выделения водорода (В) | |
| 0,001 А/см2 | 0,1 А/см2 | |
| Свинец | 1,05 | 1,24 |
| Ртуть | 1,06 | - |
| Кадмий | 0,51 | 0,93 |
| Цинк | 0,83 | 1,17 |
| Медь | 0,48 | 0,74 |
| Железо | 0,36 | 0,60 |
| Олово | 0,63 | 0,83 |
| Платина (гладкая) | 0,1 | 0 |
| Платина (черная) | 0 | 0 |
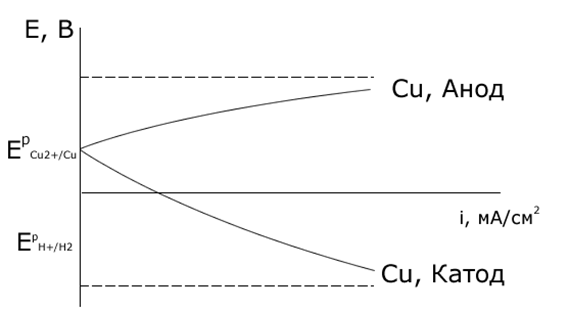
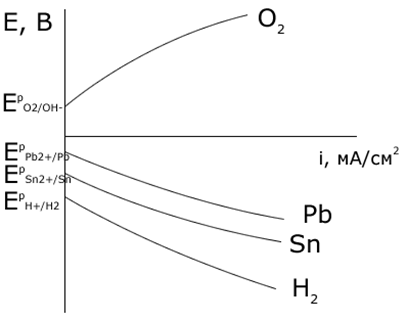
При некоторой плотности тока потенциал выделения водорода становится отрицательнее, чем потенциал выделения металла. На рисунке равновесный потенциал цинкового электрода отрицательнее, чем потенциал водородного электрода. Поэтому при малых плотностях тока на катоде выделяется только водород. Но водородное перенапряжение электрода больше, чем перенапряжение цинкового электрода, поэтому при повышении плотности тока начинает выделяться цинк.
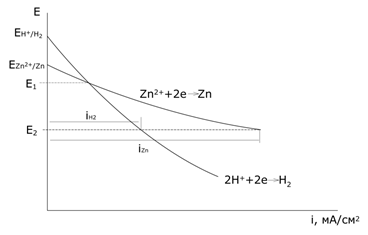
При потенциале E1 плотности тока выделения водорода и цинка одинаковы, а при потенциале E2 на электроде выделяется в основном цинк iZn>>iH2. Выход по току цинка растет с увеличением катодной поляризации. Вследствие этого из водных растворов удается выделять на катоде марганец, цинк, хром, железо, кадмий, кобальт, никель, олово и др.
На аноде протекают реакции окисления восстановителей, поэтому в первую очередь на аноде реагируют наиболее сильные восстановители – вещества, имеющие наиболее отрицательный потенциал. На аноде при электролизе водных растворов может протекать несколько процессов:
- растворение металла (анода):
M – ne → Mn+
- окисление ионов OH-:
2OH- + 2e → 1/2O2 + H2O
- окисление других восстановителей:
Red – ne → Ox
Если потенциал металлического анода имеет более отрицательное значение, чем потенциал окисления ионов OH- или других веществ, присутствующих в растворе, в газовой фазе около электрода или на электроде, то происходит растворение металла. Это называется электролизом с растворимым анодом.
Если потенциал металлического анода или другого проводника первого рода намного положительнее потенциалов окисления других веществ, то протекает электролиз с нерастворимым анодом. Нерастворимыми анодами могут служить золото, металлы платиновой группы, диоксид свинца, оксид рутения, графит и др., имеющие положительные значения равновесных потенциалов.
Если потенциал окисления металлического анода близок к потенциалу других возможных анодных процессов (разница < 1В), то наряду с растворением металла на аноде протекают и другие процессы, например разряд ионов OH-. Происходит электролиз с растворимым анодом, с учетом других анодных процессов.
Некоторые металлы практически не растворяются из-за пассивации, т.е. образования оксидной пленки. Например, никель и железо в щелочном растворе, свинец в серной кислоте, титан, тантал, нержавеющая сталь.
При электролизе с нерастворимым анодом на электроде окисляются ионы OH- и другие ионы, либо недиссоциированные молекулы восстановителей, присутствующих в растворе.
Стандартный потенциал кислородного электрода зависит от pH и давления.
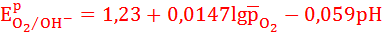
При относительном давлении р=1:
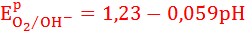
Потенциал кислородного электрода зависит от материала анода и плотности тока.
| Материал электрода | Перенапряжение выделения кислорода (В) |
| 0,001 А/см2 | |
| Свинец | 1,20 |
| Ртуть | 1,38 |
| Кадмий | 1,16 |
| Цинк | 1,51 |
| Медь | 0,81 |
| Железо | 0,85 |
| Олово | - |
| Платина (гладкая) | 0,39 |
| Платина (черная) | 0,26 |
Из рисунка видно, то потенциал кислородного электрода в широкой области рН отрицательнее потенциалов галогенид-ионов (за исключением иона иода).
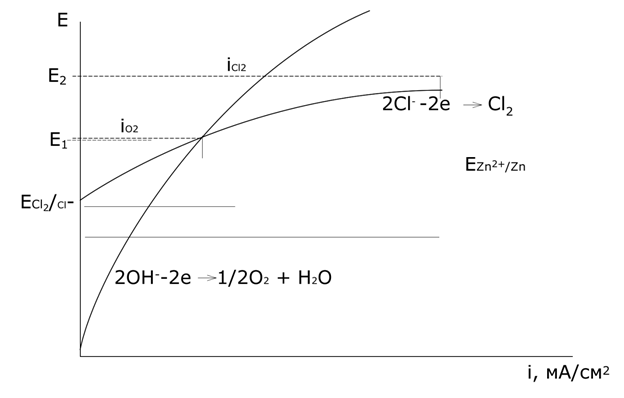
Равновесный потенциал кислородного электрода отрицательнее равновесного потенциала хлорного электрода. При этом выделение кислорода протекает со значительно более высокой поляризацией, чем выделение хлора, поэтому при малых плотностях тока выделяется только кислород, при потенциале E1 токи на выделение хлора и кислорода становятся равны, а при потенциале E2 выделяется в основном хлор.
При наличии в растворе ионов иода и брома, вследствие высокой поляризации реакции выделения кислорода на аноде в первую очередь выделяется иод, затем бром. При наличии в растворе ионов хлора при малых плотностях тока идет выделение кислорода, при высоких плотностях тока наряду с этой реакцией идет окисление ионов хлора и выделение газообразного хлора. Фтор из-за положительного значения потенциала не может быть выделен из водных растворов на аноде, его получают электролизом расплавов фторидов.
!!!!! На аноде не окисляются также ионы SO42-, PO43-, NO3-, поэтому в их присутствии в растворе на нерастворимом аноде протекает только реакция выделения кислорода.
Задача.
Рассмотрите электролиз расплава соли хлорида калия KCl на нерастворимых Pt-электродах. Напишите уравнения электродных процессов. Рассчитайте минимальную разность потенциалов Umin электролиза.
Решение.
1) Запишем ионный состав электролита:
КCl → К+ + Cl-
Стандартные потенциалы электродных процессов:
Катод (-): E0K+/K = -2,925 В
Aнод (+): E0Cl2/Cl = + 1,36 В
Электродные процессы:
Kатод (-): К+ + e→ К
Анод (+): 2Cl- → Cl2 + e.
Данный электролиз можно использовать для получения калия и хлора.
Umin =Е = Е0Cl-/Cl2 - Е0К+/К =1.36В – (-2.925В) = 4.285В
Задача.
Определите минимальную разность потенциалов Umin , которую необходимо подать на Pt-электроды для проведения электролиза водного раствора KOH, рН = 12. Напишите уравнения процессов электролиза. Рассчитайте объемы газов (приведенные к нормальным условиям), которые образуются на электродах за 10 часов при токе 5А.
Решение.
С целью определения ионного состава электролита запишем уравнения диссоциации раствора электролита:
КОН → К+ + ОН-;
H2O ↔ H+ + OH-
Распределение ионов по электродам:
Катод (-): ( К+, H+)
Анод (+): (OH-),
Равновесные потенциалы возможных электродных процессов:
Катод (-):
E0K+/K = -2,925 В
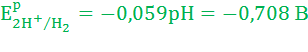
Анод (+):
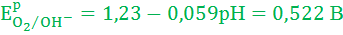
Так как E0K+/K значительно отрицательнее Ep2H+/H2, то на катоде будет протекать только процесс восстановления ионов Н+, а на аноде – процесс окисления ионов ОН-:
Катод (-): 2Н2О + 2е → Н2 + 2ОН-,
Анод (+): 2ОН- - 2е → 1/2О2 + Н2О.
Минимальная разность потенциалов для электролиза данного раствора (противоЭДС):
Umin = EpO2/OH- - Ep2H+/H2 = 0,522 – (-0,708) = 1,23 В
Объем газов, выделившихся на электродах, рассчитаем по закону Фарадея (условия нормальные):
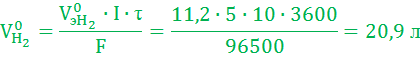
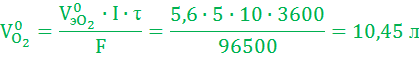
Электролиз водного раствора гидроксида калия широко применяется для электрохимического получения водорода.
Задача.
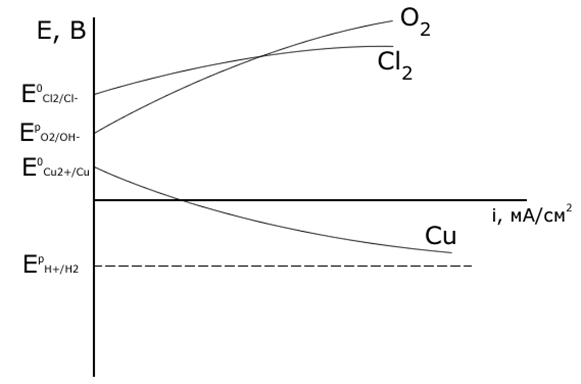
Рассмотрите электролиз водного раствора CuCl2 на графитовых (нерастворимых) электродах. Напишите электродные процессы, покажите ход поляризационных кривых. Рассчитайте массу меди, образовавшейся на катоде, если за это же время на аноде выделилось 5,6 мл Cl2 и 5,6 мл O2.
Решение.
Ионный состав раствора электролита и оценим водородный показатель среды. Запишем уравнения диссоциации молекул соли и воды:
CuCl2 → Cu2+ + 2Cl-
H2O ↔ H+ + OH-.
Соль CuCl2 образована слабым основанием Cu(OH)2 и сильной кислотой HCl, следовательно, при ее растворении в воде будет протекать процесс гидролиза с образованием избытка ионов Н+, раствор электролита будет иметь слабокислую реакцию среды (примем рН = 5).
Потенциалы возможных процессов на аноде и катоде и запишем уравнения электродных процессов:
Катод (-): E0Cu2+/Cu = + 0,337 В
EpH+/H2 = - 0,059·рН = - 0,295 В
т.к. E0Cu2+/Cu более положителен, чем EpH+/H2, то на катоде будет протекать только процесс восстановления ионов меди Сu2+ из раствора электролита.
Aнод (+): E0Cl2/Cl- = + 1,36 В,
EpO2/OH- = 1,23 - 0,059·рН = + 0,935 В
Поскольку EpO2/OH-более отрицателен, чем E0Cl2/Cl-, то в первую очередь на аноде будет идти процесс окисления ионов ОН-. Однако, вследствие поляризации при больших плотностях тока потенциалы процессов выделения кислорода и хлора достаточно близки, поэтому на аноде будет идти также процесс окисления ионов Cl– из раствора электролита. Таким образом, на электродах протекают следующие процессы:
Катод (-): Cu2+ + 2e → Cu
Анод (+): 2H2O → O2 + 4H+ + 4e
2Cl- → Cl2 + 2e
Электролиз данного раствора можно проводить для нанесения медного покрытия на изделие, а также для получения газообразных кислорода и хлора.
Массу меди, образовавшейся на катоде, для чего сначала рассчитаем объемы моль эквивалентов газов при н.у. и массу моля эквивалента меди:
V0эO2 = 22,4/4 = 5,6 л/моль
V0эCl2 = 22,4/2 = 11,2 л/моль
MЭCu = 64,4/2 = 32,2 г/моль
По закону Фарадея определим количество электричества, необходимое для выделения заданных объемов кислорода и хлора на аноде (н.у.):
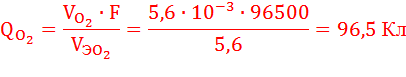
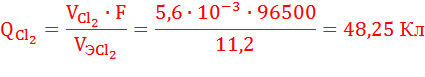
Суммарное количество электричества, прошедшее через анод, равно:
QA = QO2 + QCl2 = 114,75 Кл
Такое же количество электричества на катоде (QК = QА) пойдет только на один процесс образования меди. По закону Фарадея определим массу выделившейся меди:
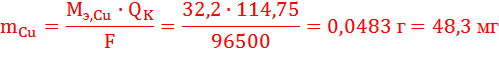
Определим выход по току (Bj) для всех процессов электролиза:
BCu = 100 % (т.к. на катоде идет один процесс)
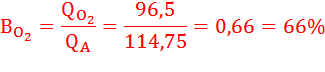
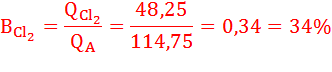
Задача
Рассмотрите электролиз водного раствора CuCl2 на медных электродах. Напишите уравнения электродных процессов, покажите ход поляризационных кривых. Чем отличается ход поляризационных кривых в данном варианте от варианта, рассмотренного выше примера?
Решение.
Ионный состав раствора электролита таков же, как в предыдущей задаче, поэтому на катоде, как и в случае с электролизом на нерастворимых электродах, пойдет только процесс восстановления ионов меди.
Потенциалы возможных процессов на аноде:
EрO2/OH- = + 0,935 В
E0Cl2/Cl- = + 1,36 В
Потенциал материала анода E0Cu2+/Cu = + 0,337 В. Так как равновесный потенциал окисления меди значительно отрицательнее равновесных потенциалов выделения кислорода и хлора, то на аноде в первую очередь пойдет процесс окисления медного электрода. Если при электролизе на катоде и аноде не будут достигнуты равновесные потенциалы систем EрO2/OH- и EрH+/H2 (небольшие поляризации DЕК, DЕА и плотности тока i), то электродные процессы будут следующие:
Kатод (-): Cu2+ + 2e → Cu
Aнод (+): Cu → Cu2+ + 2e .
При больших напряжениях электролизера U , могут быть достигнуты EрO2/OH-, E0Cl2/Cl- и EрH+/H2, тогда начнется газовыделение и к указанным уравнениям электродных процессов добавятся уравнения из предыдущей задачи
Благодаря растворению под действием тока медного анода запас ионов Cu2+ в растворе электролита будет восполняться, и процесс образования медного покрытия на катоде будет идти более интенсивно, чем в случае использования инертных электродов (предыдущая задача).
Задача.
Рассмотрите электролиз водного раствора смеси солей Pb(NO3)2 и Sn(NO3)2 на графитовых (нерастворимых) электродах. Напишите уравнения электродных процессов. Рассчитайте выход по току веществ, если на катоде одновременно образовалось 30г Sn, 52г Pb и 2,8л Н2 (условия нормальные).
Решение.
Определим ионный состав раствора электролита и оценим водородный показатель среды. Запишем уравнения диссоциации молекул соли и воды:
Pb(NO3)2 → Pb2+ + 2NO3-
Sn(NO3)2 → Sn2+ + 2NO3-
H2O ↔ H+ + OH- .
Соли Sn(NO3)2 и Pb(NO3)2 образованы слабыми основаниями и сильной кислотой, следовательно, при их растворении в воде будет протекать процесс гидролиза с образованием избытка ионов Н+, раствор электролита будет иметь слабокислую реакцию среды (примем рН ≈ 5).
Равновесные потенциалы возможных процессов на аноде и катоде:
Катод (-): E0Sn2+/Sn = -0,136 В
E0Pb2+/Pb = -0,126 В
EpH+/H2 = - 0,059·рН = - 0,295 В
Поскольку E0Sn2+/Sn, E0Pb2+/Pb, EpH+/H2 имеют близкое значение, то на катоде будут параллельно протекать процессы восстановления ионов Pb2+, Sn2+ и Н+ из раствора электролита. На аноде ионы NO3-, как сложные кислородсодержащие ионы, окисляться не будут, и в данном растворе электролита на нерастворимом аноде будет идти только процесс окисления ионов ОН-.
Таким образом, на электродах протекают следующие процессы:
Kатод (-): Pb+ + 2e → Pb
Sn2+ + 2e → Sn
2H+ + 2e → H2
Анод (+): H2O → O2 + 4H+ + 4e.
Запишем массы и объем (при нормальных условиях) моль эквивалентов веществ, образовавшихся на катоде:
MэSn = 59,3 г/моль, МэPb = 103,6 г/моль, V0эH2 =11,2 л/моль (н.у.)
По закону Фарадея определим количество электричества, необходимое для получения на катоде заданного количества вещества (н.у.):
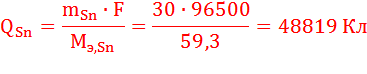
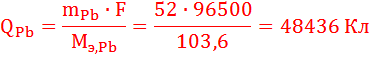
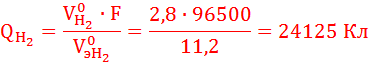
Суммарное количество электричества, прошедшее через катод:
QK = QSn + QPb + QH2 = 121380 Кл
Определим выход по току (Bj) для всех процессов электролиза:
BO2 = 100 % (т.к. на аноде идет один процесс);
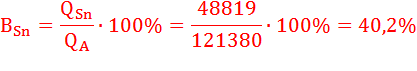
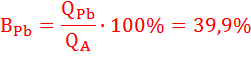
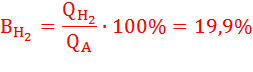
Применение электролиза.
Металлургия, химическая промышленность, гальванотехника, электрохимическая обработка металлом (размерная обработка, анодирование и др.).
Металлургия.
Электролизом водных растворов солей получают чистые металлы – медь, цинк, кадмий, никель, кобальт, марганец и т.д. Некоторые металлы невозможно получить электролизом водных растворов, поэтому проводят электролиз расплавов. Электролизом расплавов получают алюминий, магний, натрий, литий, бериллий, кальций и сплавы некоторых металлов.
Рафинирование – очистка металлов от примесей. Рафинированием очищают медь, серебро, золото, свинец, олово и т.д.
Анодом служит очищаемый металл и примеси. Примеси, имеющие более положительный потенциал, не растворяются и выпадают в осадок (шлам). На катоде в первую очередь выделяется металл, имеющий наиболее положительный потенциал. Поскольку потенциалы золота, меди, серебра, свинца и олова положительнее, чем потенциалы других металлов (примесей), они в восстанавливаются на катоде, а примеси остаются в растворе.
Например, основной металл – Со; примеси – Zn и Cu. Как провести очистку в растворе H2SO4?
Ионный состав раствора:
H2SO4 → H+ + SO42-
H2O ↔ H+ + OH- рН=1
Выписываем все потенциалы
Е0Н+/Н2= 0 В (т.к. рН=1)
ЕрО2/ОН- =1,23-0,059рН = +1,17В;
Е0Co2+/Co = - 0,277В
Е0Zn2+/Zn = -0,76В;
Е0Сu2+/Cu = + 0,337В
На аноде: SO42-, OH-, Со, Zn, Cu
Анод (+):
Zn0 → Zn2+ + 2е (в первую очередь, т.к. Е0Zn2+/Zn< Е0Co2+/Co)
Co0 → Co2+ + 2е
Медь не растворяется и выпадает в шлам, а затем ее собирают со дна.
На катоде: H+; Co2+; Zn2+
Катод (-):
Сначала, пока концентрация ионов кобальта в электролите равна 0.
2Н+ + 2е → Н2(г)
Далее
Cо2+ + 2е → Cо0
Ионы Zn2+ остаются в растворе
Задача.
Рассмотрите процесс рафинирования Ni, содержащего примеси Zn и Cu в растворе H2SO4. Какие процессы будут протекать на катоде и аноде? Какое время нужно для проведения рафинирования при токе 500 А для выделения 5 кг никеля при выходе по току 98%?
Решение.
Ионный состав раствора:
H2SO4 → H+ + SO42-
H2O ↔ H+ + OH- рН=2
Потенциалы возможных электродных процессов
ЕрО2/ОН- =1,23-0,059рН = +1,112В;
ЕрН+/Н2 = -0,059рН = -0,118В
Е0Ni2+/Ni = - 0,250В
Е0Zn2+/Zn = -0,76В;
Е0Сu2+/Cu = + 0,337В
Поскольку Е0Zn2+/Zn<Е0Ni2+/Ni<Е0Cu2+/Cu<EpO2/OH- то первым на аноде окисляется Zn, затем очищаемый металл – Ni, примеси Cu не растворяются, а выпадают в осадок (шлам).
Т.к. Е0Ni2+/Ni > Е0Zn2+/Zn и потенциал ионов Ni2+ выше, чем ионов Zn2+, то на катоде осаждается чистый никель.
В начале процесса в растворе отсутствуют ионы Ni2+ и на катоде выделяется Н2.
Анод (+):
Zn0 → Zn2+ + 2е
Ni0 → Ni2+ + 2е
Катод (-):
2Н+ + 2е → Н2(г)
Ni2+ + 2е → Ni0
Время для рафинирования по закону Фарадея (Мэ,Ni=29,5 г/моль):
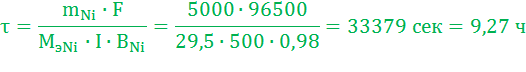
Химическая промышленность.
К наиболее крупномасштабному электролитическому процессу в химической промышленности относится электролиз раствора NaCl с получением газообразного хлора на аноде, водорода на катоде и раствора щелочи в катодном пространстве.
Еще одним крупномасштабным процессом является электролиз водных растворов щелочи, при котором на аноде выделяется кислород, а на катоде – водород. Водород, полученный таким способом, используется в энергетике, металлургии, пищевой, стекольной промышленности и т.д.
Электролизом получают фтор из расплава смеси HF и NaF, диоксид марганца из раствора MnSO4, окислители – пероксид водорода, перманганат калия, гипохлорит, хлораты, хроматы и т.д.
Гальванотехника.
Гальванотехника - набор технологических приёмов, режимных параметров и оборудования, применяемого при электрохимическом осаждении каких-либо металлов на заданной подложке.
Гальванопластика - применяется для получения металлических копий предметов методами электролиза. Этот термин может использоваться и в качестве названия металлических предметов, полученных методом гальванопластики. Толщина металлических осадков, наносимых при гальванопластике, составляет 0.25-2 мм.
Гальваностегия — электролитическое осаждение тонкого слоя металла на поверхности какого-либо металлического предмета, детали. Гальванические покрытия применяют для:
- защиты от коррозии
- получения защитно-декоративных покрытий
- повышения электропроводности
- повышения твердости и износостойкости
- получения магнитных пленок
- уменьшения коэффициента трения
- улучшения способности к пайке
- улучшение отражательной способности поверхности
Покрываемая деталь служит катодом, металл покрытия – анодом, электролит содержит ионы металла-покрытия. Толщина покрытия составляет от 1 до 100 мкм.
Часто в состав электролита вводят буферные растворы для поддержания рН среды, блескообразователи, добавки, активирующие анодный процесс или электропроводность электролита.
Наиболее распространены: никелирование, меднение, хромирование, цинкование.
Задача
Рассчитайте толщину никелевого покрытия на стальном изделии поверхностью 1 м2 и изменение толщины Ni анода поверхностью 1 м2 при э/х никелировании в течение 1 ч из водного раствора на основе Ni2SO4, если катодная плотность тока – 100 А/м2, а анодная – 50 А/м2. Выход по току Ni на катоде – 0,8, а на аноде – 0,9. Плотность Ni ρ=8,9 г/см3. (Гидролизом пренебречь, рН=7).
Решение.
Сравнивая значения электродных потенциалов, записываем последовательность возможных электродных процессов:
Kатод (-):
Ni2+ + 2e → Ni
2Н+ + 2е → Н2(г)
Анод, Ni (+):
Ni → Ni2+ + 2e
4ОН- → О2(г) + 2Н2О + 4е
По закону Фарадея:
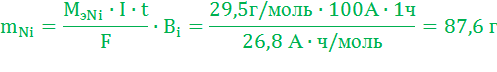
Толщина Ni покрытия на изделии равна:
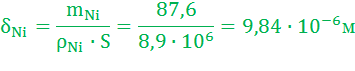
Масса растворившегося никелевого анода:
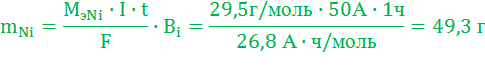
Изменение толщины Ni анода:
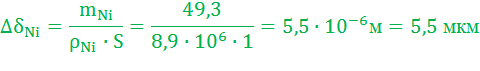
Электрохимическая обработка металлов (ЭХОМ). Для изменения размеров и формы, а также состояния поверхности металлических изделий используют электрохимические способы обработки, при которых производится электроокисление металлических изделий: электрохимическая размерная обработка, анодирование и др.
Размерная обработка
Используется для изменения размеров и форм, шлифования, полирования твердых металлов и сплавов, например, лопаток турбин, пресс-фом, изделий из тугоплавких металлов, заточки инструмента.
Преимущества:
- позволяет обрабатывать детали сложной формы, которые механически или вообще не могут быть обработаны (например, очень твердые металлы и сплавы)
- инструмент (катод) не изнашивается
- структура металла изделия не нарушается.
Недостатки:
- значительное энергопотребление.
Анод, изделие (+): Ме – ne → Меn+р-р
Катод (-): 2Н+р-р + 2e → Н2(г)
Особенность – высокая скорость растворения металла, высокая плотность тока при относительно небольших напряжениях. Для этого при необходимо снижать поляризацию и сопротивление электролита. Зазор между инструментом (катодом) и поверхностью изделия составляет 0,1 мм, используются растворы с высокой электропроводностью. Для снижения поляризации и предотвращения пассивации анода (детали) принудительно под высоким давлением подают электролит, который выносит из зоны обработки продукты анодного растворения материала изделия и образующийся на катоде водород.
Анодирование – анодная обработка металлов и сплавов. Обработка металлов в специальных электролитах для повышения коррозионной стойкости, износостойкости, создания изолирующих слоев на поверхности. Анодированию подвергают алюминий, медь, магний, титан.
При анодировании алюминиевого изделия, оно играет роль анода. Электролитом служит раствор серной, ортофосфорной, хромовой, борной или щавелевой кислот. Катодом является металл или сплав, не реагирующий с электролитом, например, нержавеющая сталь или свинец.
В результате анодирования на поверхности изделия образуется тонкая прочная, достаточно эластичная пористая пленка оксида алюминия. Пористость оксидной пленки позволяет пропитывать ее антикоррозионными, антифрикционными или декоративно-защитными составами, которые позволяют повысить эксплуатационные свойства изделия.
Химические источники тока.
Химические источники тока – это устройства, предназначенные для преобразования химической энергии в электрическую. К их преимуществам можно отнести высокий КПД, бесшумность, возможность использования под водой и в условиях невесомости, в переносных устройствах, на транспорте.
Химические источники тока:
- первичные элементы одноразового действия (ГЭ)
- аккумуляторы или аккумуляторные батареи (АКБ)
- топливные элементы (ТЭ)
Первичные элементы одноразового действия (ГЭ), после израсходования запаса реагентов они теряют работоспособность.
Гальванический элемент Вольта и Якоби-Даниэля. Разобран на предыдущей лекции
Схема элемента Якоби – Даниэля:
Анод (-) Zn / ZnSO4 // CuSO4 / Cu (+) Катод
Токообразующая реакция (ТОР): Zn + Cu2+ = Cu + Zn2+.
На цинковой пластине идёт процесс окисления: Zn – 2e- = Zn2+, а на медной – восстановление: Cu2+ + 2e- = Cu.
Марганцево-цинковый элемент.
Схема
Анод Zn / NH4Cl / MnO2 Катод
На катоде:
MnO2 + H2O + e- = MnOOH + OH-
На аноде: Zn – 2e- = Zn2+.
Перешедшие в электролит катионы цинка образуют гидроксид:
Zn2+ + 2 OH- = Zn(OH)2.
2Zn(OH)2 + 4 NH4Cl = [Zn(NH3)4 ]Cl2 + ZnCl2 + 4H2O.
Суммарный анодный процесс:
2Zn + 4 NH4Cl + 4 OH- = 4e- + [Zn(NH3)4 ]Cl2 + ZnCl2.
ТОР:
2Zn + 4 NH4Cl + 4 MnO2 = 4MnOOH + [Zn(NH3)4 ]Cl2 + ZnCl2.
Щелочной марганцово-цинковый и медноокисный элементы.
Схема марганцово-цинкового элемента:
А (-) Zn / KOH, K2Zn(OH)4 / MnO2 (+)
Е0 MnO2/Mn2+ = 0,17 В; Е0 Zn/Zn2+ = - 1,22 В. ЭДС = 0,17 – ( -1,22) = 1,39 В.
Схема щелочного меднооксидного элемента:
А(-) Zn / KOH / CuO, Cu (+) К
Анодный процесс: Zn – 2e- + 2 KOH = K2ZnO2 + 2H+;
Катодный процесс: CuO + 2e- + 2H+ = Cu + H2O.
Суммарный процесс: Zn + CuO + 2 KOH = K2ZnO2 + Cu + H2O.
Аккумуляторы или аккумуляторные батареи (АКБ) - элементы многоразового действия, перезаряжаемые, вторичные или обратимые. Аккумуляторы - ХИТ в которых электрическая энергия превращается в химическую, а химическая – снова в электрическую.
Аккумулятор состоит из двух электродов (отрицательного заряженного анода и положительного заряженного катода) и электролита (ионного проводника) между ними.
Свинцовые аккумуляторы
Электрохимическая схема:
Анод (-) Pb / H2SO4 / PbO2 (+) Катод
Электроды погружены в электролит – 25-30% раствор серной кислоты с плотностью 1,18 – 1,22 г/см3. Кроме электролита, решётки электродов разделяются пористыми сепараторами.
Суммарная (ТОР) реакция в аккумуляторе:
2 PbSO4 + 2 H2O ↔ Pb + PbO2 + 2H2SO4.
При зарядке аккумулятора протекают следующие реакции:
На аноде Pb+2SO4 + 2H2O – 2e- = Pb+4O2 + H2SO4,
На катоде Pb+2SO4 + 2e- = Pb0 + SO42-.
При разрядке аккумулятора (во время его работы):
На аноде Pb+4O2 + 2H2SO4 + 2e- = Pb+2SO4 + 2H2O + SO42-;
На катоде Pb0 + SO42- - 2e- = Pb+2SO4.
Щелочные аккумуляторы
Среди аккумуляторов с щелочным электролитом наиболее распространены никель-кадмиевые (Ni-Cd) и никель-железные (Ni-Fe) аккумуляторы. Здесь положительный электрод содержит гидроксид никеля (III) Ni(OH)3 (или NiOOH), а отрицательный – соответственно кадмий или железо. В качестве электролита используется 20-23% раствор гидроксида калия КОН, с плотностью 1,21 г/см3. Так, при работе Ni-Fe аккумулятора суммарное уравнение
Fe + 2Ni(OH)3 ↔ Fe(OH)2 + 2Ni(OH)2.
При разрядке на аноде Fe – 2e- = Fe2+ ,
на катоде Ni(OH)3 + e- = Ni(OH)2 + OH-.
Аккумуляторы с расплавленным и твёрдым электролитом
Хлор-литиевый аккумулятор. На графитовом стержне адсорбирован газообразный хлор:
(–) Li / LiCl, KCl / Cl2, C (+)
Суммарный электрохимический процесс: 2Li + Cl2 ↔ 2 LiCl.
Преимущества такого аккумулятора – высокая удельная энергия (до 400 Вт*ч/кг) и мощность (до 2000 Вт/кг). Недостатки – высокая коррозионная активность электролита, токсичность хлора, взрывоопасность.
Топливные элементы (ТЭ) – это химические источники тока, в которых окислитель и восстановитель хранятся вне элемента и в процессе работы подаются к электродам, которые не расходуются. В топливных элементах химическая энергия восстановителя (топлива) и окислителя, непосредственно превращается в электрическую энергию. В топливных элементах используют жидкие и газообразные восстановители (водород, метанол, метан) и окислители, обычно кислород воздуха.
Превращение химической энергии в электрическую происходит при протекании реакции 2Н2+О2=2Н2О. При этом генерируется постоянный ток. К аноду подводится топливо (Н2), к катоду – окислитель (О2 или воздух). Между электродами находится электролит – например, твердополимерный или раствор щелочи (в основном КОН):
Схема:
А (-) Н2, М/КОН/ М, О2 (+) К
М – катализатор (проводник первого рода).
Анодный процесс: Н2 + 2 ОН- - 2е = 2 Н2О;
Катодный процесс: О2 + 2 Н2О + 4е- = 4 ОН-.
Суммарный процесс: 2 Н2 + О2 = 2 Н2О.
Во внешней цепи происходит движение электронов от анода к катоду, а в растворе – движение ионов от катода к аноду.
Электрохимические характеристики ХИТ
1. ЭДС (электродвижущая сила) – максимальная разность потенциалов между положительным и отрицательным электродом.
ЭДС=φ(+) – φ(–),
где φ(+) и φ(–) – равновесные потенциалы положительного и отрицательного электродов соответственно, В. ЭДС зависит от природы и концентрации электролита, от состава и природы активных масс, температуры.
· Разрядное напряжение. При подключении к гальваническому элементу внешней цепи через него протекает гальванический ток. Зависимость между ЭДС и током, протекающим в цепи, выражается формулой:
Up = ЭДС – η(+) - η(–) - J·Rом,
где Up – разрядное напряжение, В; η(+) , η(–) – величина поляризации катода и анода, В; I·Rом – падение напряжения в гальваническом элементе, Rом – внутреннее сопротивление элемента.
· Ёмкость гальванического элемента Q – количество электричества, которое может отдать элемент при разряде. Q = I·t (А·ч), где I – сила тока, А; t – длительность разряда, час.
Номинальная ёмкость – ёмкость, которую должен отдать элемент в режиме разряда, указанном в технических условиях.
Остаточная ёмкость – ёмкость, которую отдаёт элемент после хранения. Ёмкость зависит от массы активных веществ, их природы, силы тока, температуры, продолжительности хранения, условий эксплуатации.
· Мощность – энергия, отдаваемая источником тока в единицу времени (Вт). N = Iср·Uср, где N – мощность, Вт; Iср – средняя сила тока, А; Uср – среднее напряжение при разряде, В.
· Удельная энергия: Am = A/m = Q·Uср/m, где Am – удельная энергия, Вт·час/кг; A – энергия источника тока, Вт·час; m – масса источника, кг; Uср - среднее напряжение, В.
Удельная ёмкость Qm = Q/m, где Qm – удельная ёмкость, А·час/кг; Q – ёмкость, А·час; m – масса источника, кг.








