Бумажная хроматография
ЛАБОРАТОРНАЯ РАБОТА № 1
Бумажная хроматография
Разделение и обнаружение катионов VI аналитической группы
Горизонтальная или радиальная хроматография
Хроматографией называют метод разделения веществ, в котором разделяемые вещества распределяются между неподвижной (стационарной) и подвижной фазами. Неподвижной фазой может бить твердое вещество, жидкость на твердом носителе или гель; подвижной фазой - жидкость или газ.
По агрегатному состоянию подвижной фазы хроматография подразделяется на жидкостную и газовую. Жидкостная хроматография может быть нескольких видов; ионообменная, в которой подвижная фаза - обычно жидкая, а стационарная фаза - нерастворимый полимер, содержащий ионные группы; адсорбционная, в которой стационарная фаза - твердое вещество с большой поверхностью; распределительная, в которой стационарная фаза - обычно тонкая пленка из несмешивающейся жидкости, нанесенной на твердый носитель.
Хроматографические методы с жидкой подвижной фазой на практике различают по форме и виду применяемой стационарной фазы или твердого носителя для стационарной жидкой фазы, а именно хроматография на колонке (колоночная хроматография); хроматография в тонком слое (тонкослойная хроматография); хроматография на бумаге (бумажная хроматография).
Бумажная хроматография
Бумажная хроматография - это жидкостно-жидкостная распреде-лительная хроматография, в основе разделения которой лежит различие в коэффициентах распределения анализируемого компонента между неподвижной и подвижной фазами (2-мя несмешивающимися жидкостями) . В бумажном варианте хроматографии в качестве неподвижного твердого носителя используется специальная бумага, способная удержать в своих порах значительные количества жидкости, являющейся неподвижной фазой.
Выпускаемая промышленностью бумага для хроматографии состоит из пучков волокон целлюлозы, молекулы которой соединены между собой водородными связями. В волокнах целлюлозы содержится незначительное количество связанной воды, в то время как в промежутках между волокнами находится до 20 % влаги, которая и выполняют рольнеподвижной жидкой фазы. В качестве подвижной жидкой фазы используют органические растворители, смешанные с водой или с водными растворами электролитов.
Подвижная фаза. Для разделения неорганических веществ в качестве подвижной фазы часто применяют растворы минеральных кислот в полярных органических растворителях (спирты; эфиры; кетоны, напр. ацетон). Подвижная фаза играет двоякую роль - она является подвижным элюирующим компонентом и переводит разделяемое соединение в определенные химические формы с разными коэффициентами распределения. Следует иметь в виду, что добавляемая к растворителям минеральная кислота должна иметь тот же анион, что и анион хроматографируемого соединения, так как иначе может произойти размывание зон.
Виды бумажной xроматографии
Различают следующие виды хроматограмм: восходящую, нисходящую, горизонтальную или радиальную в зависимости от движения подвижное фазы. В горизонтальной или радиальной хроматографии растворитель (подвижная фаза) подводится к центру бумажного диска, куда нанесена капля анализируемого раствора.
Радиальную хроматограмму получают в камере, состоящей из двух крышек или двух оснований чашек Петри равного диаметра, между которыми помещают бумажный диск несколько большего диаметра. В нижнюю часть камеры наливают смесь (7 : 1) ацетона и 2 М раствора HCI. Предварительно к бумажному диску пришивают одним-двумя стежками к центру диска бумажный жгутик из полоски бумаги шириной 4-5 мм ("фитилек").
Нанесение образца на бумажный диск. В центр бумажного диска с "фитильком” наносят каплю анализируемого раствора и подсушивают получившееся пятно над плиткой. Если концентрация ионов в растворе мала, наносят на высушенное пятно еще одну каплю анализируемого раствора, и снова подсушивают.
Получение хроматограммы. Помещают диск в камеру, опустив "фитилек” в растворитель. Время хроматографирования – 30 мин. Бумажный диск сушат (над плиткой). Разделяемые ионы располагаются вокруг центра диска кольцами разного диаметр.
Обнаружение катионов
Для обнаружения катионов используют следующие реагенты: NН4SCN, К4[Fе(СN)6], Na2S, диметилглиоксим, дифенилкарбазид.
Для проявления хроматограммы проводят капиллярами с соответствующими реагентами из центра диска по радиусу. Можно разрезать диск на секторы и обработать каждый сектор одним реагентом.
При выполнении реакции на кобальт следует учитывать, что комплекс Со(SСN)42- неустойчив. Поэтому рекомендуется вводить большой избыток реагента. Для проявления зоны, содержащей кобальт, на определенный участок хроматографической полоски наносят каплю насыщенного раствора NН4SCN и каплю ацетона. Образуется пятно синего цвета. Оно более устойчиво, если хроматограмму поместить в камеру.
При обработке раствором Na2S кадмий проявляется в виде желтой полосы. Ион ртути (II) проявляется на фронте растворителя при обработке дифенилкарбазидом в виде слабой узкой фиолетовой полоски или в виде черной полоски при обработке Na2S . Узкая черная полоска располагается точно по фронту растворителя. Если присутствует кадмий, то узкая черная полоска наблюдается после желтой полосы сульфида кадмия. Ион меди обнаруживают по размытой красно-бурой полосе, появляющейся при обработке К4[Fе(СN)6]. Подтверждением присутствия меди являются голубая полоса аммиаката меди, черная полоска сульфида меди или две узкие полоски при обработке дифенилкарбазидом на концентрическом кольце, принадлежащем меди.
Следует иметь ввиду, что в хроматографической бумаге и в подвижной фазе (HCI) содержатся следы железа, которые проявляются при обработке хроматограммы по ходу анализа растворами КSCN(розоватое окрашивание), K4[Fe(CN)6] (синяя полоска), Na2S (черная полоска).
При выполнении анализа смеси катионов IV-VI групп по кислотно-щелочной схеме в центр бумажного диска наносят аммиачный раствор катионов VI группы после отделения осадка гидроксидов катионов V группы. Раствор наносят 2-3 раза, поскольку концентрация его может оказаться недостаточной для обнаружения катионов указанными реагентами.
КЛАССИФИКАЦИЯ КАТИОНОВ ПО КИСЛОТНО-ОСНОВНОЙ СХЕМЕ АНАЛИЗА
| № группы | Катионы | Групповой реагент | Образующиеся соединения | Характеристика группы |
| I растворимая | K+, Na+, NH4+ | Нет группового реагента | Группового реагента нет | Хлориды, сульфаты, гидроксиды растворимы в воде |
| II сульфатная | Ba2+, Sr2+, Ca2+ | 2M H2SO4 | Осадок: BaSO4, SrSO4, CaSO4 | Образование малорастворимых в воде и кислотах сульфатов |
| III хлоридная | Ag+, Pb2+, Hg22+ | 2M HCl | Осадок: AgCl, Hg2Cl2,PbCl2 | Образование малорастворимых хлоридов |
| IV амфолитная | Al3+, Cr3+, Zn2+, Sn(III), Sn(IV), As(III), As(V) | 2M NaOH и 3% H2O2 | Раствор: [Al(OH)4]-, [Zn(OH)4]2-, [AsO(OH) 4]-, CrO42-, [Sn(OH) 6]2- | Гидроксиды растворимы в избытке щелочи |
| V гидроксид-ная | Fe2+, Fe3+, Mn2+, Mg2+, Bi3+, Sb3+, Sb5+ | Избыток водного раствора аммиака и 3% H2O2 | Осадок:Fe(OH)3, Bi(OH)3, MnO(OH)2, H3SbO4 | Гидроксиды нерастворимы в избытке щелочи |
| VI аммиакатная | Cu2+, Cd2+, Co2+, Ni2+, Hg2+ | Избыток водного раствора аммиака и 3% H2O2 | Раствор: [Cd(NH3)4]2+, [Cu(NH3)4]2+, [Hg(NH3)4]2+, [Co(NH3)6]3+, [Ni(NH3)6]2+ | Гидроксиды растворимы в избытке аммиака с образованием аммиач-ных комплексных соединений. Гидроксиды Mg растворимы в солях аммония. |
ДЕЙСТВИЕ ГРУППОВЫХ РЕАГЕНТОВ
Группа II: групповой реагент - H2SO4
Ba2+ + SO42– → BaSO4↓ белый осадок
Sr2+ + SO42– → SrSO4↓ белый осадок
Ca2+ + SO42– → CaSO4↓ белый осадок
Группа III: групповой реагент - HCl
Ag+ + Cl– → AgCl↓ белый осадок
Рb2+ + 2Cl– → PbСl2↓ белый осадок
Hg22+ + 2Cl– → Hg2Cl2↓ белый осадок
Группа IV: групповой реагент - избыток NaOH и H2O2
Аl3+ + 3ОН– → Аl(ОН)3↓ белый осадок
Аl(ОН)3 + ОН– → [Аl(ОН)4] –
Zn2+ + 2ОН– → Zn(OH)2↓ белый осадок
Zn(ОН)2↓ + 2ОН– → [Zn(ОН)4] 2–
Cr3+ в щелочной среде присутствует в виде CrО2–
2CrО2– + 3H2O2 + 2OH– → 2CrО42– + 4H2O раствор желтого цвета
Группа V: групповой реагент - избыток водного раствора аммиака и H2O2
2Fe2+ + 4NH4OH + H2O2 → 2Fe(OH)3↓ + 4NH4+
бурый осадок
Fe3+ + 3NH4OH + H2O2 → Fe(OH)3↓ + 3NH4+
бурый осадок
Mn2+ + 2NH4OH + H2O2 → MnO(OH)2↓ + H2O + 2NH4+
темно-коричневый осадок
Bi3+ + NH4OH → Bi(OH)3↓ + NH4+
белый осадок
Группа VI: групповой реагент - избыток водного раствора аммиака и H2O2
Co2+ + 6NH4OH + H2O2 → [Co(NH3)2]3+ + 2OH– + 6Н2О
красный
Ni2+ + 8NH4OH → [Ni(NH3)6]2+ + 2OH– + 2NH4+ + 6Н2О
синий
Cu2+ + 4NH4OH → [Cu(NH3)4]2+ + 2OH– + 2NH4+ + 4Н2О
синий
Hg2+ + 6NH4OH → [Hg(NH3)4]2+ + 2OH– + 2NH4+ + 4Н2О
бесцветный
Cd2+ + 6NH4OH → [Cd(NH3)4]2+ + 2OH– + 2NH4+ + 4Н2О
бесцветный
КЛАССИФИКАЦИЯ АНИОНОВ ПО КИСЛОТНО-ОСНОВНОЙ СХЕМЕ АНАЛИЗА
| № группы | Анионы | Групповой реагент | Характеристика группы |
| I | SO42-, SO32- , СO32-, РO43-, S2O32- SiO32- | Хлорид бария ВаСl2 в нейтральном или слабощелочном растворе | Соли бария практически нерастворимы в воде |
| II | Сl- , Вг- , I-, S2- | Нитрат серебра AgNO3 в присутствии HNO3 | Соли серебра практически нерастворимы в воде и разбавленной кислоте |
| III | NO3-, NO2-, CH3COO- | Группового реагента нет | Соли бария и серебра растворимы в воде |
Реакции обнаружения катионов.
| Первая группа катионов: K + , Na + , NH 4 + | |||||
| Катион | Реагент | Уравнение реакции | Наблюдение | Условия проведения реакции | Примечание |
| K+ | Реакция с кобольти- нитритом натрия Na3[Co(NO2)6] | 2KCl+Na3[Co(NO2)6]→2NaCl+K2NaCo(NO2)6↓ 2K++Na++[Co(NO2)6]3-→K2NaCo(NO2)6↓ K2NaCo(NO2)6↓+6H+→6HNO2+Na++2K++Co3+ 2Co3++HNO2+H2O→2Co2++NO3-+3H+ [Co(NO2)6]3-+3OH-→Co(OH)3↓+6NO2- | Осадок ярко-желтого цвета растворимый в минеральных кислотах, нерастворим в уксусной кислоте. | рН=4-5, Свежеприготовленный раствор. | Мешают ионы NH4+. Реагент розовеет при стоянии (разлагается) и буреет под действием щелочи. |
| Na2PbCu(NO2)6 | 2KCl+Na2PbCu(NO2)6→2NaCl+K2PbCu(NO2)6↓ 2K++Pb++Cu2++6NO2-→K2PbCu(NO2)6↓ | Образуются кубические кристаллы черного цвета. | Микрокристал-лоскопическая реакция. | Мешают ионы NH4+. | |
| Na+ | Zn[(UO2)3(CH3COO)8] цинкуранилацетат | NaCl+ Zn[(UO2)3(CH3COO)8]+ CH3COOH+9H2O→ Na[Zn(UO2)3(CH3COO)9]∙9H2O+HCl | Желтый кристаллический осадок. | Микрокристал-лоскопическая реакция. Нейтральная среда | Мешают ионы Mg2+, т.к. выпадают кристаллы соли. |
| NH4+ | NaOH, KOH | NH4Cl+NaOH→NaCl+NH3↑+H2O NH4++OH-→NH3↑+H2O | Выделяется NH3↑, лакмус ( оранжевый). | Нагревание. | Мешают ионы К+. |
| Реакция с раствором Несслера K2[HgI4]+KOH | NH4Cl+4KOH+2K2[HgI4]→[NH4Hg2O]I↓+7KI+ +KCl+3H2O NH4++4OH-+2HgI4-→[NH4Hg2O]I↓+7I-+3H2O | Красно-бурый аморфный осадок. | NaOH конц., в газовой камере. | Мешают ионы К+, Hg(II). | |
| Вторая группа катионов: Ba 2+ , Sr 2+ , Ca 2+ | |||||
| Ba2+ | K2Cr2O7 | Cr2O72-+H2O↔2CrO42-↓+2H+ 2Ba2++2CrO42-+H2O→2BaCrO4↓ 2Ba2++Cr2O72-+H2O↔2BaCrO4↓+2H+ | Желтый осадок. | рН=3-5, ацетатный буферный раствор. | Нерастворим в CH3COOH. Мешает большая концентрация ионов H+ |
| H2SO4 | BaCl2+H2SO4→BaSO4↓+2HCl Ba2++SO42-→BaSO4↓ | Белый осадок. | рН=5, полное осаждение в CH3COOH. | Мешают ионы Sr(II), Ca(II). | |
| Sr2+ | Насыщенный водный раствор гипса CaSO4∙2H2O | SrCl2+CaSO4∙2H2O→SrSO4↓+CaCl2+2H2O Sr2++CaSO4∙2H2O→SrSO4↓+Ca2++2H2O | Белый осадок. (муть) | Нагревание раствора, ускоряет появление мути. | Мешают ионы Ba2+. |
| Ca2+ | Оксалат аммония (NH4)2C2O4 | CaCl2+(NH4)2C2O4→CaC2O4↓+2NH4Cl Ca2++C2O42-→CaC2O4↓ | Белый осадок. | Нагревание, рН<7 подкисленный CH3COOH до рН=6-7 | Мешают ионы Ba2+, Sr2+. |
| H2SO4 | CaCl2+H2SO4→CaSO4↓+2HCl Ca2++SO42-→CaSO4↓ | Белые игольчатые кристаллы. | Микрокристал- лоскопическая реакция. | Мешают Be(III), Sr(II). | |
| Третья группа катионов: Ag + , [ Hg 2 ]2+, Pb 2+ | |||||
| Ag+ | HCl | AgNO3+HCl→AgCl↓+HNO3 Ag++Cl-→AgCl↓ | Белый творожистый осадок, на свету фиолетовый или чернеет (разложение). | Разбавленный раствор HCl, т.к. Ag+ может образовать растворимый хлоридный комплекс. | |
| Br-, I- | AgNO3+KBr→AgBr↓+KNO3 Ag++Br-→AgBr↓ AgNO3+KI→AgI↓+KNO3 Ag++I-→ AgI↓ | Бледно-желтый осадок. Желтый осадок. | Необходима большая концентрация реагента с целью избежать растворения осадка. | Мешают ионы [Hg2]2+. | |
| [Hg2]2+ | HCl | 2HCl+2Hg2(NO3)2→Hg2Cl2↓+2HNO3 2Cl-+[Hg2]2+→Hg2Cl2↓ | Белый осадок, растворим в избытке HCl | 2М HCl, не добавлять избыток HCl т. к. осадок растворяется. | |
| NH4OH | Hg2Cl2↓+2NH4OH→[NH2Hg2]Cl↓+NH4+Cl-+2H2O [NH2Hg2Cl↓→NH2HgCl↓+Hg↓ [Hg2]2+→Hg2++Hg↓ | Осадок Hg2Cl2 белого цвета, несколько растворим в избытке НСl с образованием комплекса; чернеет при действии NH4OH. При этом вначале образуется комплексное соединение ртути (1). | Это важнейшая реакция иона [Hg2]2+, которую обычно используют для обнаружения HgI | ||
| Pb2+ | К2CrO4 К2Cr2O7 | Pb(NO3)2+К2CrO4→PbCrO4↓+КNO3 Pb2++CrO42-→PbCrO4↓ 2PbCl2+К2Cr2O7+H2O→2PbCrO4↓+2КCl+2HCl 2Pb2++Cr2O72-+H2O→2PbCrO4↓+2H+ | Образование мало растворимого PbCrO4↓ желтого цвета. | рН<7 | Наиболее важная реакция для Pb2+. |
| KI | PbCl2+2KI→PbI2↓+2KCl Pb2++2I-→PbI2↓ | Золотые кристаллы. | Необходимо нагревание, затем охлаждение. | ||
| Четвертая группа катионов: Al 3+ , Cr 3+ , Zn 2+ , Sn ( II ), Sn ( IV ) | |||||
| Al3+ | NaOH, KOH | AlCl3+NaOH→Al(OH)3↓+NaCl Al3++OH-→Al(OH)3↓ Al(OH)3↓+OH--→[Al(OH)4]- Al(OH)3↓+6H+-→Al3++3H2O | Белый осадок, амфотерная гидроокись. | рН=5 | |
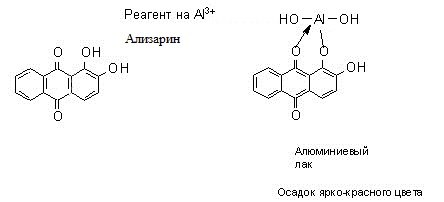
| Ализарин | Малорастворимое соединение ярко-красного цвета. | Капельная реакция. | Мешают ионы Fe3+. | ||
| Алюмин | Соединения красного цвета, красные хлопья | Нагревание на водяной бане. | |||
| Cr3+ | Окисление Cr(III) до Cr(VI) | 2KCrO2+2KOH+3H2O2→2K2CrO4+4H2O 2CrO2-+2OH-+3H2O2→2CrO42-+4H2O 2KCrO2+3Br2+8KOH→2K2CrO4+6KBr+4H2O 2CrO2-+3Br2+8OH-+→2CrO42-+6Br-+4H2O Cr2(SO4)3+3(NH4)2S2O8+7H2O→(NH4)2Cr2O7+ +(NH4)2SO4∙7H2SO4 2Cr3++3S2O82-+7H2O→Cr2O72-+ +6SO42-+14H+ | Переход ярко-зеленого окраски, в желтую. | Нагревание. | |
| Бензидин | Синего цвета. | Капельная реакция. | |||
| Комплексон III | Образование внутри комплексного соединения Cr3+ Фиолетового цвета. | рН=5-7,7, избыток комплексона, нагревание на водяной бане. | Мешают ионы Fe3+, Co2+, Ni2+. | ||
| Zn2+ | NaOH, KOH | ZnCl2+NaOH→Zn(OH)2↓+2NaCl Zn2++2OH-→Zn(OH)2↓ Zn(OH)2↓+OH-→[Zn(OH)4]- Zn(OH)2↓+H+-→Zn2++3H2O | Белый осадок, растворимый в кислотах и щелочах (амфотерность). | рН>7 | |
| Дитизон | Образование внутрикомплексной соли малинового цвета. | Капельная реакция. | |||
| Sn (II) | Bi | 3Na2SnO2+2Bi(OH)3→2Bi↓+3Na2SnO3+3H2O 3SnO22-+2Bi(OH)3→2Bi↓+3SnO33-+3H2O | Черный осадок. | Проводится на холоду, 2М раствора NaOH | |
| Sn (IV) | NH4+ | Na2[SnCl6]+2NH4OH→(NH4)2[SnCl6]+2NaOH SnCl4+2NH4Cl→(NH4)2SnCl6 | Бесцветные кристаллы, октаэдры. | Микрокристал-лоскопическая реакция. | |
| Пятая группа катионов: Fe 2+ , Fe 3+ , Mn 2+ , Bi 3+ , Sb 3+ , Sb 5+ | |||||
| Fe2+ | K3[Fe(CN)6] | 2K3[Fe(CN)6]+3FeSO4→Fe3[Fe(CN)6]2↓+K2SO4 2[Fe(CN)6]3-+3Fe2+→Fe3[Fe(CN)6]2↓ | Синий осадок «турнбулевой сини», осадок нерастворим в кислотах, но разлагается щелочами. | ||
| Диметилглиоксим (реактив Чугаева) | Раствор красного цвета. | Диметилглиоксим важный реагент на Ni2+ | |||
| Fe3+ | K4[Fe(CN)6] | 3K4[Fe(CN)6]+4FeCl3→Fe4[Fe(CN)6]↓+12KCl 3[Fe(CN)6]4-+4Fe3+→Fe4[Fe(CN)6]↓ | Темно-синий осадок «берлинской лазури». | Умеренно подкисленный раствор. | |
| NH4CNS роданид аммония | Fe2SO4+6NH4CNS→2Fe(CNS)3+3(NH4)2SO4 Fe3++SCN-→[FeSCN]2+ Fe3++2SCN-→[Fe(SCN)2]+ Fe3++3SCN-→[Fe(SCN)3] Fe3++6SCN-→[Fe(SCN)6]3- Fe(SCN)3+6F-→[FeF6]3-+3SCN- | NH4CNS дает с Fe3+ роданиды железа комплексные соединения, окрашенные в кроваво-красный цвет. | Реакция обратима, добавление избытка реактива усиливает окраску. | Фториды мешают появлению окраски т.к. F- образует с Fe3+ прочный бесцветный комплекс, мешают H3PO4 соли щавелевой и винной кислот. | |
| Mn2+ | Окисление Mn2+ до MnO42- | MnSO4+5PbO2+4HNO3→2HMnO4+2PbSO4+ +3Pb(NO3)2+2H2O Mn2++5PbO2+4H+→2MnO4-+5Pb2++2H2O 2MnO4-+3Mn2++7H2O→5MnO(OH)2+4H+ | Раствор окрашен в малиново-фиолетовый цвет. | рН<7 | Реакция не должна содержать никаких других восстановителей и в частности Cl- |
| Bi3+ | Гидролиз | BiCl3+2H2O→Bi(OH)2Cl↓+2HCl Bi(OH)2Cl↓→BiOCl↓+H2O Bi3++Cl-+H2O→BiOCl↓+2H+ | Белый осадок. | При добавлении к BiOCl кислоты и нагревании осадок растворяется. | |
| K2SnO2 Na2SnO2 | SnCl2+2NaOH→Sn(OH)2+2NaCl H2SnO2+2NaOH→Na2SnO2+2H2O H2SnO2+2OH-→SnO22-+2H2O 2Bi(OH)3↓+3SnO22-→2Bi↓+3SnO32-+3H2O | Черный осадок. | Избегать нагревания ( на холоду разлагается). | ||
| KI | Bi(SO4)3+6KI→2BiI3↓+3H2SO4 Bi3++3I-→BiI3↓ BiI3+I-→[BiI4]- [BiI4]-→BiI3+I- | Черный осадок, BiI3 растворимый в избытке KI | Концентрированный раствор. | ||
| Sb3+ Sb5+ | Гидролиз | Na3[SbCl6]+H2O→SbOCl↓+3NaCl+2HCl [SbCl6]-+2H2O→SbOCl+5Cl-+4H+ | Белый осадок. | Соль сильно разбавлена H2O | |
| Восстанов- ление оловом | 2Na[SbCl6]+3Sn→2Sb↓+3SnCl2+12NaCl 2Na[SbCl6]+3Sn→2Sb↓+3Sn2++12Cl- | Черный осадок, металлической Sb. | |||
| Шестая группа катионов: Cu 2+ , С d 2+ , Hg 2+ , Co 2+ , Ni 2+ , Mg 2+ | |||||
| Cu2+ | Водный раствор NH4OH | 2CuSO4+2NH4OH→(CuOH)2SO4↓+(NH4)2SO4 2Cu2++2NH4OH→(CuOH)2SO4↓+2NH4+ (CuOH)2SO4↓+8NH4OH→[Cu(NH3)4](OH)2+ +Cu(NH3)4SO4+8H2O | Образуется аммиачный комплекс меди ярко-синего цвета. | рН>9 | |
| K4[Fe(CN)6] | 2CuCl2+K4[Fe(CN)6]→Cu2[Fe(CN)6]↓+4KCl 2Cu2++[Fe(CN)6]4-→Cu2[Fe(CN)6]↓ | Красно-бурый осадок, нерастворимый в разбавленных кислотах. | рН≤7 | Осадок разлагается при действие щелочей. | |
| Сd2+ | Сульфиды | CdCl2+H2S→CdS↓+2HCl Cd2++S2-→CdS↓ CdS↓+4HCl→CdCl2+H2S | Желтый осадок, нерастворим в щелочах. | рН≈0,5 | Галогениды мешают протенизациюэтой реакции. |
| Hg2+ | KI | HgSO4+KI→HgI2↓+K2SO4 Hg2++I-→HgI2↓ HgI2+KI→K2[HgI4] HgI2+I-→[HgI4]2- | Оранжево-красный осадок, растворимый в избытке KI с образованием бесцветного комплексного иона [HgI4]2- | В избытке реагента осадок растворяется, образуя устойчивый комплекс. | |
| Реакция восстановления Hg2+ до [Hg2]2+ и метал- лической Hg | 2HgCl2+SnCl2→Hg2Cl2↓+SnCl4 2HgCl2+Sn2+→Hg2Cl2↓+Sn4++2Cl- Hg2Cl2↓+SnCl2→2Hg↓+SnCl4 Hg2Cl2↓+Sn2+→2Hg↓+Sn4++2Cl- HgCl2+Cu↓→Hg↓+CuCl2 Hg2++Cu↓→Hg↓+Cu2+ | Сначала образуется белый осадок Hg2Cl2↓, который в избытке постепенно сереет, восстанавливаясь до металлической Hg | |||
| Реакция с дифенилкарба- зидом | Фиолетового или синего цвета | Мешают хлориды, которые затрудняют обнаружению Hg2+ , так как образуется HgCl2 | |||
| Co2+ | NH4CNS Роданид аммония | CoSO4+4NH4CNS↔[NH4]2[Co(CNS)4]+(NH4)2SO4 Co2++4CNS-↔[Co(CNS)4]2- | Роданид аммония образует с Co2+ комплексную соль синего цвета. | Слабокислый раствор, необходимо понизить диссоциацию комплекса на ионы Co2+ и CNS-, вводя большой избыток CNS--ионов. | Мешают ионы Fe3+. |
| Реакция с α-нитрозо- β-нафтолом (реактив Ильинского) | Красно-бурый осадок. | Мешают ионы Fe3+, образующего с реагентом буровато-черный осадок. | |||
| Ni2+ | Реакция с диметил- глиоксимом (реактив Чугаева) | Красный осадок, внутрикомплексной соли. | Слабоаммиачная среда. | Мешают ионы Fe2+, которые дают с ди-метилглиок-симом внутри-комплексную соль красного цвета, маски-руют фтори-дом натрия. | |
| Mg2+ | Na2HPO4 | MgSO4+Na2HPO4+NH4OH→MgNH4PO4↓+2NaSO4++H2O Mg2++HPO42-+NH4OH→MgNH4PO4↓+H2O | Белый кристаллический осадок. | В слабощелочной среде, прибавляя по каплям NH4OH | |
| Реакция с органическими красителями (магнезон I, магнезон II) | Адсорбционные соединения синего цвета. | Щелочная среда. | Не мешают Ba2+, Ca2+,Al3+ | ||
|
Реакции обнаружения анионов. | |||||
| Первая группа анионов :SO42-, SO32-, S2O32-, CO32-, PO43- | |||||
| SO42- | BaCl2 | CaSO4+BaCl2→BaSO4↓+CaCl2 SO42-+Ba2+→BaSO4↓ S2O32-+2H+→S↓+SO2↑+H2O 2S-2+SO32-+6H+→3S↓+3H2O | Белый осадок, не растворим в кислотах | рН≈7-9 | Присутствуют S2O32- или смеси SO32- и S-2 мешают, т.к. в обоих случаях при подкислении выделяется белый осадок. |
| Ca2+ | MgSO4+Ca(NO3)2+2H2O→Mg(NO3)2+CaSO4∙2H2O SO42-+Ca2++2H2O→CaSO4∙2H2O | Образуются кристаллы гипса. | Нагревают до появления камней. | ||
| SO32- | Реакция с минеральными кислотами и раствором иода или KMnO4 | BaSO3+2HCl→BaCl2+SO2↑+H2O SO32-+2H+→SO2↑+H2O SO2+I2+H2O→H2SO2+2HI SO2+I2+H2O→2H++SO22-+2I- SO2+2KMnO4+2H2O→K2SO4+2MnSO4+2H2SO4 SO2+MnO42-+2H2O→5SO42-+2Mn2++4H+ | Минеральные кислоты разлагают все сульфиты с выделением SO2↑ | Очень разбавленный раствор иода и KMnO4 | |
| S2O32- | AgNO3 | 2AgNO3+Na2S2O3→Ag2S2O3↓+2NaNO3 2Ag++S2O32-→Ag2S2O3↓ Ag2S2O3+H2O→AgS2↓+H2SO4 Ag2S2O3+H2O→AgS2↓+2H++SO42- | Белый осадок, который быстро желтеет и в конце становится черный AgS2↓ | Избыток иона Ag+ | |
| Кислоты | Na2S2O3+2HCl→H2S2O3+2NaCl S2O32-+2H+→H2S2O3 | Образуется кислота, которая разлагается S, SO2↑, H2O. | |||
| Раствор иода | 2Na2S2O3+I2→Na2S4O6+2NaI 2S2O32-+I2→S4O62-+2I- | Раствор обесцвечивается. | |||
| CO32- | Кислоты | Na2CO3+2HCl→H2CO3+2NaCl CO32-+2H+→H2CO3 H2CO3→CO2+H2O | Выделяется CO2 , вызывает помутнение известковой воды. | рН≈11, известковая вода должна быть свеже-приготовленная. | |
| PO43- | Магнезиальная смесь | MgSO4+Na2HPO4+NH4OH→MgNH4PO4↓+2NaSO4++H2O Mg2++HPO42-+NH4OH→MgNH4PO4↓+H2O | Белый осадок. | Реагент может быть прибавлен в большом избытке, нагревание от (40-50°). | |
| Реакция с молибденовой жидкостью | H3PO4+12H2MoO4+3NH4NO3→(NH3)4[PMo12O40]+ +3HNO3+12H2O PO42-+2H++3NH3+→(NH3)4[PMo12O40]+12H2O | Желтый кристаллический осадок. | |||
| Вторая группа анионов: Cl - , Br - , I - | |||||
| Cl- | AgNO3 | CaCl2+2AgNO3→2AgCl↓+Ca(NO3)2 2Cl-+2Ag+→2AgCl↓ AgCl+2NH4OH→[Ag(NH3)2]+Cl-+2H2O | Белый творожистый осадок, на свету серо-фиолетовый, затем чернеет. | Нерастворимый в кислотах, но растворим NH4OH, KCN. | |
| Br- | AgNO3 | NaBr+AgNO3→AgBr↓+NaNO3 Br-+Ag+→AgBr↓ | Бледно-желтый оса-док, нерастворим НNO3, плохо раство-рим в NH4OH и прак-тически нерастворим в (NH4)2СO3 и в аммиачном растворе AgNO3. | Раствор бромидов. | |
| Хлорная вода | Cl2+H2O→HCl+HClO HClO+2HBr→Br2+HCl+H2O HClO+2H++2Br-→Br2+Cl-+H2O | Раствор буреет, выделяется Br2. | |||
| I- | AgNO3 | NaI+AgNO3→AgI↓+NaNO3 I-+Ag+→AgI↓ | Желтый осадок, нерастворим в НNO3, в аммиачном растворе Na2S2O3 и KCN, разлагается при действии Zn, в присутствии H2O или 2М растворе H2SO4 | ||
| Хлорная вода | HClO+2HI→I2+HCl+H2O HClO+2H++2I-→I2+Cl-+H2O | Желтый цвет. | Свежеприготовлен-ный раствор. | ||
| Третья группа анионов: NO 3 - , NO 2 - , CH 3 COO - | |||||
| NO3- | Дифениламин | Интенсивно синяя окраска. | |||
| Реакция с нитроном | Выпадают характерные пучки. | Микрокристал-лоскопическая реакция. | |||
| NO2- | KI | 2HNO2+2KI+H2SO4→I2↓+K2SO4+2NO↑+2H2O 2NO2-+I-+4H+→I2↓+2NO↑+2H2O | Реакция буреет вследствие свободного I2↓ про добавление нескольких капель крахмала, появляется синяя окраска. | ||
| Сульфаниловая кислота и α-нафтиламин | Красного цвета. | ||||
| CH3COO- | H2SO4 | CH3COONa+H2SO4→CH3COOH+Na2SO4 CH3COO-+2H+→CH3COOH | При нагревании обнаруживают по запаху. | ||
| FeCl3 | CH3COONa+FeCl3→Fe(CH3COO)3+3NaCl CH3COO-+Fe3+→Fe(CH3COO)3 Fe(CH3COO)3+H2O→Fe(OH)2CH3COO+2CH3COOH | Красно-бурая окраска. | Нейтральный раствор. | Мешают ионы SO32-, CO32, PO43-, SCN-, I- [Fe(CN)6]4-, | |