23. степень диссациации показывает число молекул электролита,распавшихся на ионы.
14.Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении
15. эффективная концентрация с учетом электростатического взаимодействия между ионами в растворе
19. Осмотическое давление раствора неэлектролита:
р = С*R*T
20. Осмотическое давление раствора электролита Росм = iCRT
23. степень диссациации показывает число молекул электролита,распавшихся на ионы.
· 25. Буферная ёмкость раствора — способность раствора сохранять постоянной концентрацию определённых ионов (обычно применяется к ионам H+).
26. Кислотные буферные системы представляют собой смесь слабой кислоты (донор протона) и ее соли
27. Основные буферные системы представляют собой смесь слабого основания (акцептор протона) и его соли (донор протона)
28. Ацетатный буферный раствор состоит из уксусной кислоты (рК = 4,8) и ацетата натрия
29. Бикарбонатный буферный раствор состоит из сильной кислоты и гидрокарбоната натрия.
30.Фосфатный буфер Состоит из слабой кислоты Н2РО4Ї сопряженного основания НРО2Ї.
31. Аммиачная буферная система: смесь слабого основания NH3•H2O (акцептор протона) и его соли - сильного электролита NH4+
Удельная электропроводность – это электрическая проводимость объема раствора, заключенного между двумя параллельными электродами площадью по 1 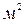 , расположенными на расстоянии 1
, расположенными на расстоянии 1 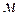 .
.
38. Удельная электропроводность зависит от(концентрации, температуры, природы растворителя)
– концентрации электролита;
– вязкости и диэлектрической проницаемости растворителя;
– температуры;
39. При увеличении концентрации электролита удельная электропроводность сначала увеличивается, а затем уменьшается
40. С повышением температуры электропроводность растворов электролитов увеличивается
переход растворителя через мембрану из раствора с меньшей, в раствор с большей концентрации называется:
1. Диффузия
2. Парциональное давление
3. Осмос
4. Обратный осмос
2. Укажите свойства растворов:
1. Парциональное давление над раствором меньше чем над чистым растворителем.
2. Температура кипения растворов больше чем, температура кипения растворителя
3. Температура кипения растворов меньше чем, температура кипения растворителя
4. Температура замерзания больше чем, температура замерзания растворителя
5. Температура замерзания меньше чем, температура замерзания растворителя
(3 правильных ответа)
3. Обратный осмос происходит при:
1. Атмосферном давлении
2. Давление ниже Росм
3. Давление выше Росм
4. Разбавлении раствора
4. При избавление раствора , температура замерзания:
1. Уменьшается
2. Увеличивается
3. Остается постоянной
5. При избавление раствора , температура кипения:
1. Уменьшается
2. Увеличивается
3. Остается постоянной
6.В нейтральной среде:
1.Избыток Н˟
2.Избыток ОНˉ
3.( Н˟)= (ОНˉ)
4. рН˃7
5. рН˂7
6.рН≈7
7. В щелочной среде:
1.Избыток Н˟
2.Избыток ОНˉ
3.( Н˟)= (ОНˉ)
4. рН˃7
5. рН˂7
6.рН≈7
8. В кислой среде:
1.Избыток Н˟
2.Избыток ОНˉ
3.Избыток SO
4. рН˃7
5. рН˂7
6.рН≈7
9.Размерность молярной концентрации:
1.Моль/кг
2.г/моль
3. Моль/л
4.%
10. Размерность моляльной концентрации:
1.Моль/кг
2.г/моль
3. Моль/л
4.%
11.Водородный показатель рассчитывают по формуле:
1. рН=lg(Н˟)
2. рН= -lg(Н˟)
3. рOН=lg(Н˟)
12. Осмотическое давление зависит от:
1. Атмосферного давления
2. Температура
3. Концентрации
4. Объема
13. Константа диссоциации:
1.Характеризует способность электролита диссоцировать на ионы
2.показывает долю диссоциированных молекул
3. Зависит концентрации
4. Применима к малорастворимым электролитам
14.Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении
15. Активность (ионов) — эффективная концентрация с учетом электростатического взаимодействия между ионами в растворе
16. Изотонические растворы — растворы, имеющие одинаковое осмотическое давление.
17. Гипертонические растворы- растворы, осмотическое давление которых выше осмотического давления в растительных или животных клетках и тканях
18. Гипотонические растворы - различные растворы, осмотическое давление которых ниже, чем в клетках растительных или животных тканей
19. Осмотическое давление раствора неэлектролита:
р = С*R*T
20. Осмотическое давление раствора электролита Росм = iCRT
21. Раствор — однофазная система переменного состава, состоящая из двух или более компонентов
22. Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора
23. Степень диссациации показывает число молекул электролита,распавшихся на ионы
24. Буферными растворами называют растворы, содержащие одновременно какую-либо слабую кислоту и ее соль или какое-либо слабое основание и его соль, оказывающие буферное действие,
25. Буферная ёмкость раствора — способность раствора сохранять постоянной концентрацию определённых ионов (обычно применяется к ионам H+).
26. Кислотные буферные системы представляют собой смесь слабой кислоты (донор протона) и ее соли
27. Основные буферные системы представляют собой смесь слабого основания (акцептор протона) и его соли (донор протона)
28. Ацетатный буферный раствор состоит из уксусной кислоты (рК = 4,8) и ацетата натрия








