Магнію сульфат (Magnesii sulfas); MgSO4∙7H2O
Властивості. Безбарвні призматичні кристали, які вивітрюються на повітрі, гірко-солоні на смак. Розчинні в 1 частині води, 0,3 частинах киплячої води, практично нерозчинні в спирті.
Застосування. Заспокійливий, спазмолітичний, проносний засіб. Дія залежить від способу введення й дози.
Одержання. Розчиненням магнезиту в гарячій розведеній сульфатній кислоті:
MgCO3 +H2SO4 → MgSO4 +CO2↑ +H2O
Розчин фільтрують і концентрують при випарюванні до кристалізації. Сульфатна кислота береться в надлишку для попередження гідролізу магнію сульфату з утворенням основної солі.
Ідентифікація
1. Реакція на іони Mg2+.
 MgCl2 + Na2HPO4 + NH4OH NH4Cl MgNH4PO45 + 2NaCl + H2O
MgCl2 + Na2HPO4 + NH4OH NH4Cl MgNH4PO45 + 2NaCl + H2O
2. Реакція на іони SO42–:
MgSO4 + BaCl2 → BaSO4↓ +MgCl2
Специфічна домішка. Марганець. Присутній у природному карбонаті магнію. Наважку речовини нагрівають з концентрованою сульфатною кислотою та аргентуму нітратом (каталізатор), а потім додають амонію персульфат і знову нагрівають до кипіння; паралельно проводять контрольний дослід. У разі присутності домішки марганцю з’являється червоно-фіолетове забарвлення (перманганат-іон).
 2Mn2+ + 5S2O82– + 8H2O AgNO3 2MnO4– + 10SO42– + 16H+
2Mn2+ + 5S2O82– + 8H2O AgNO3 2MnO4– + 10SO42– + 16H+
У пробірку з контрольним розчином додають 0,01М розчин калію перманганату до тих пір, доки забарвлення не порівняється із забарвленням досліджуваного розчину.
Кількісне визначення. Комплексонометрія, пряме титрування у присутності аміачного буфера, індикатор - кислотний хром чорний спеціальний, Е = М. м. = 246,47
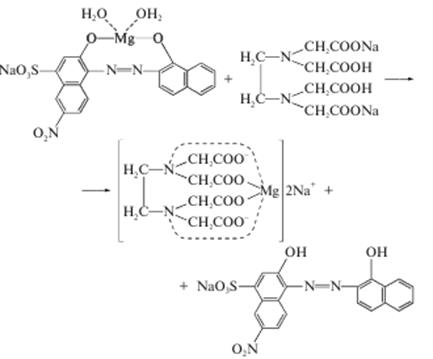
В точці еквівалентності сполука магнію з індикатором руйнується і червоно-фіолетове забарвлення переходить у синє.
Формула розрахунку кількісного вмісту:
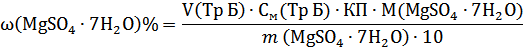
115. Наведіть рівняння реакцій, що лежать в основі одержання срібла нітрату, його фармакологічну дію. Запропонуйте можливі методи ідентифікації, де це можливо, приведіть рівняння хімічних реакцій. Охарактеризуйте тіоціанатометричний метод кількісного визначення срібла нітрату. Наведіть рівняння реакцій, формулу розрахунку кількісного вмісту, зазначте молярну масу еквівалентів.
Відповідь
Срібла нітрат ( Argenti nitras ) AgNO 3, М.м. 169,9
Препарат має містити не менше 99,0% і не більше 100,5% AgNO3. Кристалічний білий порошок або прозорі безбарвні кристали. Дуже легкорозчинні у воді, розчинний у спирті.
Добування
Розчиненням мідно-срібного сплаву в нітратній кислоті при нагріванні:
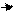 Ag∙Cu + 4HNO3 t° AgNO3 + Cu(NO3)2 +NO↑ +2H2O
Ag∙Cu + 4HNO3 t° AgNO3 + Cu(NO3)2 +NO↑ +2H2O
Застосування. Антисептичний, припікаючий засіб.
Тотожність. 1. Реакція на іони Ag+:
розчин лікарської речовини з хлороводневою кислотою утворює білий осад, розчинний у розчині амоніаку:
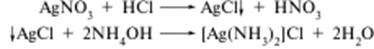
2. Реакція на нітрат-іони.
Дія нітробензену С6Н5NO2.
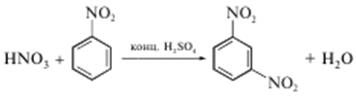
Реакцію виконують сухим способом. Якщо до суміші нітробензену та концентрованої сульфатної кислоти додати сіль нітратної кислоти, через 5 хв охолодити суміш у льодяній воді та повільно, при перемішуванні додати 10-кратний надлишок (за об’ємом) води, ту ж кількість розчину 10 моль/дм3 NaOH і ацетону, збовтати, то верхній (органічний) шар набуде темно-фіолетового забарвлення. Хімізм процесу остаточно не з’ясований. Вірогідно, спочатку завдяки реакції нітрування утворюється м-динітробензен.
У лужному розчині ацетон в енольній формі реагує з м-динітробензеном з утворенням забарвленої сполуки:
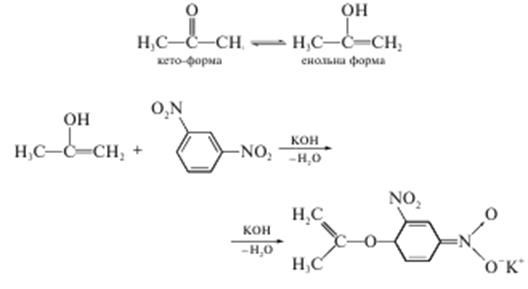
Кількісне визначення
Тіоціанатометрія, пряме титрування, індикатор - залізоамонієвий галун, Е = М. м. = :
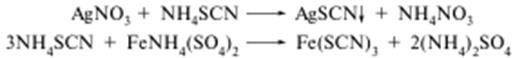
Титрування проводять у середовищі розбавленої нітратної кислоти.
Формула розрахунку кулькісного вмісту:
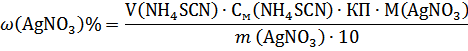
136. За методами функціонального аналізу визначити якість лікарських засобів, що містить фрагмент –СНО як альдегідну функціональну групу на прикладі наступних препаратів: розчин формальдегіду, хлоралгідрат, альдегіди у спирті етиловому та у ефірі для наркозу, глюкоза.
Відповідь
Альдегіди характеризуються високою реакційною здатністю. Для них характерні реакції приєднання, заміщення, окиснення-відновлення та полімеризації.
1. Реакції заміщення оксигену:
а) з первинними ароматичними амінами — утворюються забарвлені основи Шиффа;
б) з гідразинами утворюються гідразони, які ідентифікують за
температурою плавлення або забарвленням;
2. Реакції окиснення-відновлення:
а) з реактивом Толленса (реакція «срібного дзеркала»):
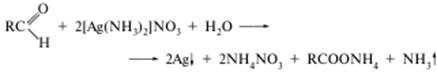
Утворюється сірий осад або наліт металічного срібла на стінках пробірки. Реакцію дають усі альдегіди;
б) з реактивом Фелінга (для аліфатичних альдегідів):
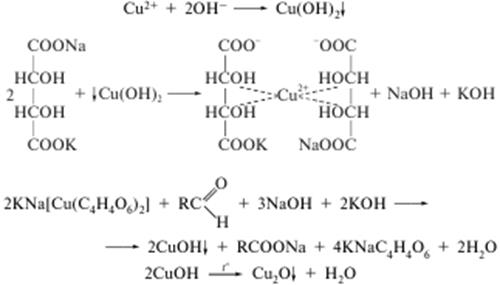
При нагріванні утворюється червоний осад. Реакція часто використовується в аналізі вуглеводів;
г) з реактивом Несслера утворюється темний осад:
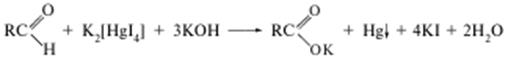
Відповідно за характерними властивостями альдегідної групи можна ідентифікувати приведені в завданні альдегіди.








