21. На какой диаграмме распределение массовых долей элементов соответствует ?

Пояснение.
Молярная масса 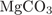 : M = 24 + 12 + 16·3 = 84, поэтому
: M = 24 + 12 + 16·3 = 84, поэтому
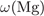 = 24·100/84 = 28,6%,
= 24·100/84 = 28,6%,
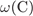 = 12·100/84 = 14,3%,
= 12·100/84 = 14,3%,
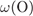 = 100 -
= 100 - 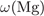 -
- 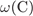 = 57,1%.
= 57,1%.
Кислорода больше 50%, подходит только вариант № 3.
Правильный ответ указан под номером 3.
Ответ: 3
571
3
Источник: Диагностические работы по химии. В. В. Еремин — 2013, вариант 2.
22. Массовая доля азота в нитрате алюминия равна
1) 14,0%
2) 19,7%
3) 6,6%
4) 21,3%
Пояснение.
Формула нитратa алюминия:  . Его молярная масса: M = 27 + 14·3 + 16·9 =213, поэтому
. Его молярная масса: M = 27 + 14·3 + 16·9 =213, поэтому
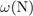 = 14·3·100/213 = 19,7%.
= 14·3·100/213 = 19,7%.
Правильный ответ указан под номером 2.
Ответ: 2
367
2
Источник: Типовые тестовые задания по химии. А. С. Корощенко, Ю. Н. Медведев — 2013, вариант 3.
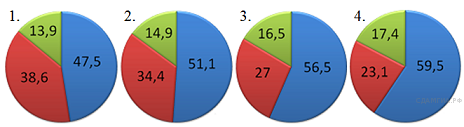
23. На какой диаграмме распределение массовых долей элементов соответствует количественному составу нитрата калия?
Пояснение.
Формула нитрата калия: 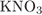 . Его молярная масса: M = 39 + 14 + 16·3 = 101, поэтому
. Его молярная масса: M = 39 + 14 + 16·3 = 101, поэтому
 = 39·100/101 = 38,6%,
= 39·100/101 = 38,6%,
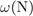 = 14·100/101 = 13,9%,
= 14·100/101 = 13,9%,
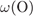 = 100 -
= 100 -  -
- 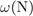 = 47,5%.
= 47,5%.
Правильный ответ указан под номером 1.
Ответ: 1
191
1
Источник: ГИА по химии. Основная волна. Центр. Вариант 1320.
24. Массовая доля серы в сульфатe железа(III) равна
1) 24,0%
2) 32,0%
3) 8,0%
4) 33,3%
Пояснение.
Формула сульфатa железа(III): 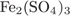 . Его молярная масса: M = 56·2 + 32·3 + 16·12 = 400, поэтому
. Его молярная масса: M = 56·2 + 32·3 + 16·12 = 400, поэтому
 = 32·3·100/400 = 24%.
= 32·3·100/400 = 24%.
Правильный ответ указан под номером 1.
Ответ: 1
411
1
Источник: Типовые тестовые задания по химии. А. С. Корощенко, Ю. Н. Медведев — 2013, вариант 5.
25. На какой диаграмме распределение массовых долей элементов соответствует 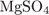 ?
?

Пояснение.
Молярная масса 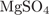 : M = 24 + 32 + 16·4 = 120, поэтому
: M = 24 + 32 + 16·4 = 120, поэтому
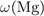 = 24·100/120 = 20%,
= 24·100/120 = 20%,
 = 32·100/120 = 26,7%,
= 32·100/120 = 26,7%,
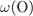 = 100 -
= 100 - 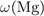 -
-  = 53,3%.
= 53,3%.
Кислорода больше 50%, подходит только вариант № 3.
Правильный ответ указан под номером 3.
Ответ: 3
546
3
Источник: Диагностические работы по химии. В. В. Еремин — 2013, вариант 1.
26. Массовая доля кислорода в сульфате меди(II) равна
1) 10,0%
2) 32,0%
3) 16,0%
4) 40,0%
Пояснение.
Формула сульфатa меди(II): 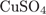 . Его молярная масса: M = 64 + 32 + 16·4 =160, поэтому
. Его молярная масса: M = 64 + 32 + 16·4 =160, поэтому
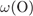 = 16·4·100/160 = 40%.
= 16·4·100/160 = 40%.
Правильный ответ указан под номером: 4.
Ответ: 4
345
4
Источник: Типовые тестовые задания по химии. А. С. Корощенко, Ю. Н. Медведев — 2013, вариант 2.
27. Пояснение.
Формула нитрата аммония: 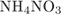 . Его молярная масса: M = 4 + 14·2 + 16·3 = 80, поэтому
. Его молярная масса: M = 4 + 14·2 + 16·3 = 80, поэтому
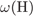 = 4·100/80 = 5%,
= 4·100/80 = 5%,
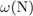 = 14·2·100/80 = 35%,
= 14·2·100/80 = 35%,
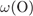 = 100 -
= 100 - 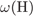 -
- 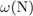 = 60%.
= 60%.
Правильный ответ указан под номером 1.
Ответ: 1
169
1
Источник: ГИА по химии. Основная волна. Центр. Вариант 1319.
На какой диаграмме распределение массовых долей элементов соответствует 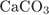 ?
?
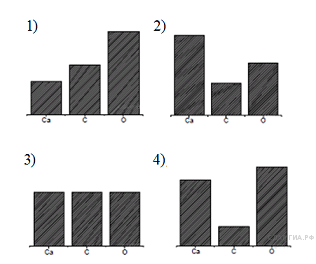
Пояснение.
Формула карбоната кальция: 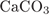 . Его молярная масса: M = 40 + 12 + 16·3 = 100, поэтому
. Его молярная масса: M = 40 + 12 + 16·3 = 100, поэтому
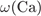 =40·100/100 = 40%,
=40·100/100 = 40%,
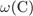 = 12·100/100 = 12%,
= 12·100/100 = 12%,
 = 100 -
= 100 - 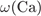 -
- 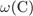 = 48%.
= 48%.
Видно что больше всего кислорода, затем идет кальций, затем углерод, поэтому верна диаграмма №4.
Ответ: 4
830
4
Источник: МИОО: Тренировочная работа по химии 09.10.2013 вариант ХИ9102.
Пояснение.
Формула фосфата аммония: 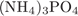 . Его молярная масса: M = 1·4·3 + 14·3 + 31 + 16·4 = 149, поэтому
. Его молярная масса: M = 1·4·3 + 14·3 + 31 + 16·4 = 149, поэтому
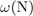 = 14·3·100/149 = 28%,
= 14·3·100/149 = 28%,
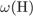 = 12·100/149 = 8%,
= 12·100/149 = 8%,
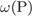 = 31·100/149 = 21%,
= 31·100/149 = 21%,
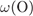 = 100 -
= 100 - 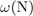 -
- 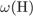 -
- 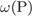 = 43%.
= 43%.
Правильный ответ указан под номером 4.
Ответ: 4
1043
4
Источник: Демонстрационная версия ГИА—2015.
28. На какой диаграмме правильно показаны массовые доли элементов в  ?
?
Пояснение.
Формула сульфата железа(II): 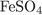 . Его молярная масса: M = 56+ 32 + 16·4 = 152, поэтому
. Его молярная масса: M = 56+ 32 + 16·4 = 152, поэтому
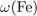 = 56·100/152=36,8%,
= 56·100/152=36,8%,
 = 32·100/152=21,1%,
= 32·100/152=21,1%,
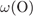 = 100 -
= 100 - 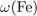 -
-  = 42,1%.
= 42,1%.
Видно что больше всего кислорода, затем идет железо, затем сера, поэтому верна диаграмма №2.
Ответ: 2
852
2
Источник: МИОО: Тренировочная работа по химии 13.02.2014 вариант ХИ90501.
Пояснение.
1) Составим уравнение реакции:
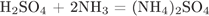
2) Рассчитаем количество вещества сульфита натрия, вступившего в реакцию:
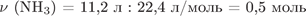 .
.
3) Определим количество, массу серной кислоты, массу исходного раствора:
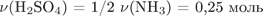 .
.

Источник: МИОО: Тренировочная работа по химии 09.10.2013 вариант ХИ9102.
30. Вычислите массу осадка, который образуется при действии раствора избытка хлорида меди (II) на 80 г 10 %-ного раствора гидроксида натрия.
Пояснение.
1) Составим уравнение реакции:

2) рассчитаем массу и количество вещества гидроксида натрия в растворе:
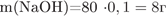
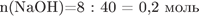
3) Определим массу осадка:
по уравнению реакции 
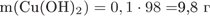
Источник: СтатГрад: Тренировочная работа по химии 13.03.2015 Вариант ХИ90401.
31. Рассчитайте массу осадка, который выпадет при сливании 500 г 2%-ного раствора иодида калия с избытком раствора нитрата свинца.
Пояснение.
1) Составлено уравнение реакции:

2) Рассчитана масса и количество вещества иодида калия и иодида свинца:
 ;
;
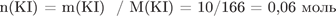 ;
;
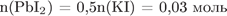 .
.
3) Определена масса осадка иодида калия:
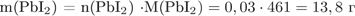 .
.
Ответ: 13,8 г.
Источник: Типовые тестовые задания по химии. А. С. Корощенко, Ю. Н. Медведев — 2013, вариант 9.
32. В 73 г соляной кислоты с массовой долей 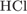 5% поместили избыток цинка. Вычислите объём выделившегося газа (н. у.).
5% поместили избыток цинка. Вычислите объём выделившегося газа (н. у.).
Пояснение.
1) Составим уравнение реакции:

2) Рассчитаем массу и количество вещества соляной кислоты, содержащейся в растворе:
 ;
;
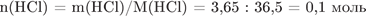 .
.
3) Определим объём газа, выделившегося в реакции:
по уравнению реакции  ;
;
 .
.
Ответ: 1,12 л.
Источник: Тренировочные варианты экзаменационных работ по химии. Д. Ю. ДОБРОТИН, А. А. КАВЕРИНА — 2013, вариант 4.
33. При взаимодействии 7,1 г оксида фосфора(V) с избытком раствора гидроксида натрия получили 164 г раствора средней соли. Вычислите массовую долю соли в полученном растворе.








