Дисульфидті байланыс, ол бір немесе екі полипептид тізбектерінің әр
түрлі аймақтарында орналасқан екі цистеиндегі тио (сульфгидрил)
топтарының күкірт атомдарының арасындағы байланыс, бұл байланыс
нәтижесінде цистин түзіледі.
Ковалентті емес байланыстар – оңай үзілетін әлсіз байланыстар.
Ковалентті емес байланыстардың энергиясы аз, олар екі түрлі қызмет
атқарады:
1. Ӛздерінің кӛптігіне байланысты олар белок молекуласының
конформациялық тұрақтылығын қамтамасыз етеді;
2.Екі молекуладан функционалды комплекстердің түзілуіне қатысады. Бұл
белгілі бір құрылымдық комплементарлықты талап етеді. Мысалы, антиген-
антидене, фермент-субстрат жұптарын алуға болады. Әлсіз байланыстар
ферменттердің қатысуынсыз пайда болады, үзіледі. Ковалентті емес
байланыстарға сутектік, иондық, гидрофобтық байланыстар жатады.
Сутектік байланыстар – полипептид тізбектерінің жеке бӛлімдерінің
тұрақтылығын қамтамасыз етеді. Олар бір немесе екі полипептид
тізбектеріндегі жақын орналасқан карбонил тобындағы біршама теріс заряды
бар оттегі мен амин тобындағы біршама оң заряды бар сутегінің арасында
түзіледі (3а сурет). Амин қышқылдарының (серин, треонин) бүйір
тізбектерінде сутек атомдары (серин, треонин) гистидин азотындағы,
карбониль тобындағы оттегі атомы, α-амин тобы сияқты электрондарға бай
атомдармен сутектік байланыстар түзуге қабілетті.
Иондық байланыстар әр түрлі зарядтары бар функционалды топтардың
электростатикалық әрекеттесуі нәтижесінде пайда болады. Мысалы:
моноаминодикарбон қышқылының СОО- қалдығы, диаминомонокарбон
қышқылының NН3
+ тобы (сурет. 3.б). Сутектік және иондық байланыс
полярлық сипатқа ие, олардың түзілуінде су маңызды орын алады.
2. Фосфопротеидтер – молекула құрамында жай белоктан және
простетикалық топ - фосфор қышқылының қалдықтарынан тұратын күрделі
белок. Фосфор қышқылы күрделі эфирлік байланыспен гидроксил тобы бар
амин қышқылдарына жалғасады. Сернин, треонин, тирозин амин
қышқылдарына бір немесе бірнеше фосфор қышқылдарының қалдықтары
қосылуы мүмкін. Фосфопротеидтер, негізінен қышқыл, құнды белок,
алмастырылмайтын амин қышқылдары мен фосфор қышқылдарының кӛзі
ретінде маңызы зор. Сондықтан фосфопротеидтер дамып келе жатқан организм
үшін энергиялық, пластикалық материалдың кӛзі, фосфолипидтердің синтезінге
жұмсалады. Фосфолипидтер жасушалық мембраналардың түзілуіне қажет.
Фосфопротеидтер фосфорлану және фосфорсыздану реакциялары үшін фосфор
қышқылының кӛзі, әрі осы процестер арқылы кейбір ферменттердің
активтенеді және ингибирленуі жүреді. Фосфопротеидтер нуклеин
қышқылыдарының синтезіне қолданылады. Фосфопротеидтердің ӛкілдеріне:
сүттің казеиногені, жұмыртқаның сары уызында кездесетін фосвитин және
вителлин, балық уылдырығында кездесетін ихтуллин жатады. Осы белоктардың
барлығы қайнатқанда ұйымайды, суда ерімейтін құнды белоктар.
3. Матрицалы РНҚ жасушадағы жалпы РНҚ-ның 2-3% құрайды. Бірінші
ретті құрылымы ДНҚ молекуласындағы құрылымға ұқсас келеді.
Айырмашылығы: нуклеотидтер құрамында. Оның қатаң түрдегі арнайы екінші
реттік құрылымы жоқ. Жалғыз полинуклетид тізбегі иілген ілмектер түзеді. Бұл
ілмектер ерітіндінің иондық күшіне қарай ӛзінің түрі мен кӛлемін ӛзгертіп
отырады. Жұмыс істемеген кезде мРНК шумақталып, белокпен байланысқан
түрде болады. Ал жұмыс істеген кезде мРНК-ның шумағы ширатылады.
М-РНҚ жасушаның ядросында ДНК-да синтезделеді. Бұл үрдіс
транскрипция деп аталады. М-РНҚ белоктың құрамына кіретін амин
қышқылдары туралы хабарды тасымалдайды.
Синтезделген белоктағы әрбір амин қышқылдарының орналасу тәртібі м-
РНҚ тізбегіндегі нуклеотидтердің орналасуымен қамтамасыз етіледі. Бұны
генетикалық код деп атайды.
Кодтың қасиеті оның әмбебаптығы. Барлық вирустарда, ӛсімдіктер
мен жануарларда бір амин қышқылы бірдей триплетпен шифрланады.
Код – үздіксіз оқылады. Ешқандай тыныс белгілерімен үзілмейді.
Кодтың оқылуы әр жерден емес, бір жерден басталуы керек, код
Қиылыспайды
4. Аминотрансферазалар қайта аминдену(трансаминдену) реакцияларын
тездетеді. Амин тобын амин қышқылдарынан кетоқышқылдарға тасы-
малдайды. Коферменті пиридоксальфосфат( В1 витамині + 2Н3РО4) болатын
екі компонентті фермент.
14-билет
1. Белоктың қасиеттері:
Элементтік құрамының біркелкі болуы. Белоктар молекуласының құрамына
енетін элементтер мӛлшері жағынан негізінен біркелкі: С-53%, О-22%, N-16%, Н-
7%, S-2%. Белоктардағы азоттың мӛлшері ӛте тұрақты болады.
Жоғары молекулалық массасы. Белоктардың молекулалық массасы 6000 дальтоннан (Д) ондаған млн. дальтонға дейін жетеді.
Белок молекуласының өлшемі мен пішіні. Глобулярлы және фибрилярлы.
Гидролиз өнімдерінің ұқсастығы. Белок-полипептид-пептид-АҚ
Амфоктерлік қасиет. Амфоктерлік қасиет олардың молекуласындағы диссоциациялануға қабілетті.
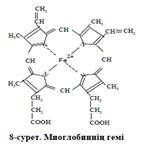
2. Гемоглобин (Нb) молекуласы жай белок глобиннен және
простетикалық топ тӛрт гемнен құралған. Глобин белогы 4 мономерден: екі α -
тізбектен (әр бір тізбекте 141 амин қышқылының қалдығы бар) және екі β-
тізбектен (әрбір тізбекте 146 амин қышқылының қалдығы бар) құралған.
Гемоглобиннің молекулалық массасы 70000 Д.
Түр ерекшелігі глобин белогының құрамына кіретін амин қышқылдарының
сапасымен анықталады. Мысалы, адамның глобин белогында изолейцин амин
қышқылы болмайды, ал басқа жануарлардың глобинінің құрамында бұл амин
қышқылы кездеседі. Барлық жануарларда кездесетін гемоглобиннің гемінің
құрылысы бірдей. Гемоглобиннің құрамына кіретін бӛліктері бір-біріне әсерін
тигізеді. Глобин белогы суда нашар еритін, химиялық инертті гемді суда жақсы
еритін, оттегімен байланысатын белсенді гемге айналдырады.
Гем- құрамында темірі бар порфиннің туындысы. Порфиннің β-кӛміртегінде
орынбасушы радикалдар болса, ол порфирин деп аталады. Порфириндердің бір
бірінен айырмашылығы орын басушы радикалдардың ерекшелігімен сипатталады.
Гемде келесі орын басушы радикалдар бар: С1, С3, С5, С8 – метил топтары, С2, С4 –
винил радикалдары, С6, С7 – пропион қышқылының қалдығы. Осы аталған
радикалдар жалғасса, онда протопорфирин деп аталады. Осы протопорфиринге
темір (Fе2+) ионы қосылса, гем түзіледі. Темір екінші және тӛртінші пиррол
сақинасындағы азот атомымен ковалентті байланыс арқылы байланысады,
ал бірінші және үшінші сақинадағы азот атомымен ковалентті емес
(координациялық) байланыспен байланысқан (с. 10).
Гемдегі темір ионы полипептид тізбегімен олардың құрамындағы гистидиннің
имидазол сақинасындағы азот атомымен екі координациялық байланыспен
байланысқан. Бұл байланыстың біреуі тұрақты, ал екіншісі гемоглобинге оттегі
қосылғанда үзіліп кетеді.
15билет
Ақуыздардың мынадай белгілеріне қарап жіктейді:
▪ күрделілік дәрежесіне (қарапайым және күрделі), қарапайым протеиндер тек қана аминқышқылдары қалдықтарынан тұрады, күрделі протеидтер құрамына ақуызды заттардан басқа қосылыстардың қалдықтары кіреді;
▪ молекула пішініне (шар тәрізді және жіп тәрізді);
▪ кейбір еріткіштерде еру қабілетіне қарай (суда еритіндер, әлсіз түз ерітінділерінде еритіндер - альбуминдер, спиртте еритіндер — проламиндер, сұйытылған қышқыл және сілті ерітінділерінде еритіндер глутелиндер);
▪ атқаратын қызметтеріне қарай (мысалы, корға жиналатын ақуыздар, тірек қызметін атқаратын ақуыздар
Миоглобин (мио және глобин – гемоглобиннің ақуызды бөлігі) – күрделі ақуыз; омыртқалы жануарлар мен адамның бұлшық еттерінде оттекті тасымалдайтын глобулярлы ақуыз. Ет тінінде молекулалық оттекті жасушалардың тотықтыру жүйесіне тасымалдайды. Миоглобинның молекуласы бір полипептидтік тізбектен (153 амин қышқылдары қалдықтары бар) және гемнен (2 валентті темірі бар порфириннің кешенді қосылысы) тұрады. Оның молекулалық массасы 17000. Ет тіні жиырылғанда капилляр қан тамырларының жиырылуы нәтижесінде оттектің парциалды қысымы кенет төмендеген кезде Миоглобиннен жұмыс істеп тұрған бұлшық етке қажетті оттек бөлініп шығады. Миоглобин, әсіресе, теңіз сүтқоректілерінің (әсіресе, су астында ұзақ уақыт тіршілік ететін) – дельфиндер (3,5%) мен итбалықтардың (7,7%) бұлшық еттері Миоглобинге бай болады. Миоглобиннің үш өлшемді құрылымы рентгендік құрылымдық талдау әдісімен анықталған бірінші ақуыз (1957 – 60 жылдары
Миоглобин цитоплазманың митохондрияға жақын жерінде кездеседі, ол гемоглобиннен оттегін тыныс алу ферменттеріне тасымалдайды. Миоглобин гемоглобинге қарағанда оттегімен жақсы байланысқан. Сондықтан да суда жүретін жануарлардың бұлшық етінде миоглобин көп болады. Адамдарда миоглобин қандағы оксигемоглобинмен әрекеттесіп, оксимиоглобин түзеді. Шыныққан адамдардың бұлшық етінде оксимиоглобиннің мөлшері көп болады.
Миоглобин бұлшық еттің арнайы белогы, сондықтан қанның сары суында оның кездесуі бұлшық еттің жарақаттанғандығын көрсетеді. Миоглобинді анықтаудың диагностикалық маңызы зор. Миокард инфаркты кеселінің дамуының екінші сағатында қанда көп мөлшерде миоглобин пайда болады. Сондықтан миоглобинді қанда табу миокард инфаркты кеселін жылдам және дәл анықтауға мүмкіндік береді
Изоферменттер (мысалдар), диагностикалық маңызы. Изоферменттер, рөлдері, биологиялық негіздері.
Изоферменттер – бір ферменттің молекулалық түр өзгерісі. Олардың коферменттері бірдей, апоферменттері әртүрлі. Бір типті реакциялар-дың жылдамдықтарын арттырады, бір субстратқа бірақ әртүрлі жағ-дайда әсер етеді, ағзалық арнайылықтары болады, оны клиникада диагностикалық - жеке бөліктерге бөле анықтау тесттеріне пайдаланады.
Ферменттердің жалпы қасиеттері сонымен қатар олардың бейорганика-лық катализаторлардан айырмашылықтарын да көрсетеді.
- ферменттердің табиғаты белоктық болғандықтан, олар белоктың он түрлі қасиеттерін көрсетеді;
- ферменттердің құрылысы өте күрделі;
- ферменттер өте жоғары субстраттық және абсолюттік арнайылықты көрсетеді;
- ферменттер өте жоғары биологиялық белсенділікті көрсетеді, ол ферменттің субстратқа деген ынтықтығынан туады және олар активтену энергиясын өте қатты төмендетеді. ферменттің белсенділі-гінің өлшем бірлігі – катал;
- ферменттер өте жайлы жағдайда әсер етеді;
- ферменттер – белсенділіктері реттелетін катализаторлар.
Амин қышқылдарының декабоксилазалары. В6 витаминінің құрылысы және коферменттік функциясы. Катализдейтін реакциялары, биогенді аминдер туралы түсінік.
Аминқышқылдарының декарбоксилазалары, өкілдері, құрылысы, коферментінің химиялық табиғаты, каталитикалық әсері.
Аминқышқылдарының декарбоксилазалары- коферменті пиридок-сальфосфат( В1 витамині + 2Н3РО4) болатын екі компонентті фермент, олар амин қышқылдарының декарбоксилденуін, биогендік аминдердің түзілуін(гистамин, серотонин, брадикинин) тездетеді, шіру процесіне қа-тысады








