Основною причиною розвитку РДС є дефіцит сурфактанту, що виникає внаслідок невідповідності між його споживанням та продукцією (рис. 15).
Сурфактантна недостатність зумовлена, насамперед, незрілістю альвеолоцитів II типу, що характерно для новонароджених дітей гестаційним віком менше 34 тиж. Чинниками ризику недостатньої продукції або інактивації сурфактанту також уважаються діабет у матері, народження без пологової діяльності (кесарський розтин), гіпотермія, гіпоксемія, ацидоз, гіповолемія (гіпоперфузія легень), вдихання високих концентрацій кисню, механічне ушкодження легень (баро-, волюм- або ателектотравма). Недостатня кількість сурфактанту в легенях таких новонароджених не може забезпечити формування потрібної функціональної залишкової ємності легень, спричинює розвиток ателектазів, зменшення активної альвеолярної поверхні та податливості легень. Прогресивному розвиткові ателектазів сприяють відносно висока податливість грудної клітки, а також загальна структурна незрілість легеневої тканини.
Первинний дефіцит сурфактанту може бути пов’язаним не лише з передчасним народженням немовляти, але і з негативним впливом перинатальних чинників ризику, перш за все, перинатальної гіпоксії, що призводить до ацидозу, ішемії легень й ураження клітин, які продукують сурфактант.
Синтез сурфактанту може порушуватись також внаслідок перенесених новонародженим холодового стресу і гіповолемії будь-якого походження. Сучасні дані свідчать, що певну роль у виникненні цього захворювання можуть відігравати генетичні фактори. Утворення гіалінових мембран, що відбувається внаслідок потрапляння білків на поверхню альвеол, є радше маркером, ніж суттєвою патологічною ознакою хвороби.
G bQUwXCN2iXlHZplueQeFUN86QSB1fW2W92lWLX5G3aiyQ9HgygzbaoC2XBMUehWErk96BRMQ2qw0 c+Qb2jaN2bWB/ilBKKif3EC/TEXGsWCzAIq68ESgbDP6wKtF3TlFFrHVxTknw0h/iooMLIHbLg7b grr82zIqdsnqOqoj+T28PhSLGOe7PF3H5Yf/AwAA//8DAFBLAwQUAAYACAAAACEAKyl6pd0AAAAH AQAADwAAAGRycy9kb3ducmV2LnhtbEyPQUvDQBSE74L/YXmCN7tJS6ON2ZRS1FMRbAXx9pq8JqHZ tyG7TdJ/7/Okx2GGmW+y9WRbNVDvG8cG4lkEirhwZcOVgc/D68MTKB+QS2wdk4EreVjntzcZpqUb +YOGfaiUlLBP0UAdQpdq7YuaLPqZ64jFO7neYhDZV7rscZRy2+p5FCXaYsOyUGNH25qK8/5iDbyN OG4W8cuwO5+21+/D8v1rF5Mx93fT5hlUoCn8heEXX9AhF6aju3DpVSt6LkEDCzkk7nKVxKCOBh6T ZAU6z/R//vwHAAD//wMAUEsBAi0AFAAGAAgAAAAhALaDOJL+AAAA4QEAABMAAAAAAAAAAAAAAAAA AAAAAFtDb250ZW50X1R5cGVzXS54bWxQSwECLQAUAAYACAAAACEAOP0h/9YAAACUAQAACwAAAAAA AAAAAAAAAAAvAQAAX3JlbHMvLnJlbHNQSwECLQAUAAYACAAAACEAh5+7orMMAACspgAADgAAAAAA AAAAAAAAAAAuAgAAZHJzL2Uyb0RvYy54bWxQSwECLQAUAAYACAAAACEAKyl6pd0AAAAHAQAADwAA AAAAAAAAAAAAAAANDwAAZHJzL2Rvd25yZXYueG1sUEsFBgAAAAAEAAQA8wAAABcQAAAAAA== ">
| Прогресивні ателектази, ¯ альвеолярна вентиляція |
| Недоношеність |
| Функціональна і структурна незрілість дихальної системи |
| Дефіцит сурфактанту (кількісний і /або якісний) |
| Порушення клітинного метаболізму |
| Альвеолярного поверхневого натягу |
| Екстравазація білків |
| ¯ Податливість легень, ФЗЄЛ, дихальний об’єм |
| Легенева гіпоперфузія |
| Гіповентиляція і порушення V/Q співвідношень** |
| П®Л шунт* |
| ВАП |
| ВОВ |
| Легені |
| Асфіксія Гіпотермія |
| Гіпоксія, гіперкапнія, ацидоз |
| Системна гіпотензія |
| Легенева вазоконстрикція |
| Підсилене руйнування сурфактанту |
| ¯ Продукція сурфактанту |
* - шунт справа наліво через відкриті артеріальну протоку (ВАП), овальне вікно (ВОВ), а також на рівні легень; ** VQ - вентиляційно-перфузійних.
Рис. 15. Головні ланки патогенезу РДС.
Цей процес не є специфічним для неонатального РДС і може супроводжувати розвиток пневмоній, гострого, серцевої недостатності, ревматичних захворювань, уремії, а також трапляється у випадках отруєнь токсичними газами, радіаційних ураженнях тощо.
4.1.1. Клінічна картина
Про можливий розвиток РДС свідчать ДР, які з’являються і прогресують відразу або невдовзі після народження. Характерним є «легеневий» тип цих розладів – тахіпное (> 60/хв.)/диспное, ретракції, експіраторний стогін, парадоксальне дихання, роздування крил носа, а також центральний ціаноз під час дихання повітрям. Крім того, можуть виявлятись артеріальна гіпотензія, периферичні набряки, олігурія. Під час аускультації легенів спочатку вислуховується ослаблене дихання, пізніше – розсіяні крепітуючі та дрібноміхурцеві хрипи. Типовими є сплощена грудна клітка та дещо збільшений в об’ємі живіт. У неважких випадках через 2-3 дні наступає позитивна динаміка, - зменшується вияв ознак ДР, зростає діурез, зменшуються набряки, підвищуються м’язовий тонус і рухова активність.
4.1.2. Діагноз
Дані анамнезу. Передчасні пологи (насамперед, пологи при терміні вагітності < 34 тиж), асфіксія новонародженого, діабет у матері, кровотечі в 3-му триместрі вагітності, артеріальна гіпотензія у матері, попередні випадки народження дітей з РДС, чоловіча стать дитини.
Результати антенатального визначення зрілості сурфактантної системи плода (співвідношення лецитин/сфінгомієлін < 2, відсутній фосфатидилгліцерол в амніотичній рідині свідчать про á ризик виникнення РДС). Крім цих показників в амніотичній рідині можна визначати також співвідношення сурфактант-альбумін, питому кількість ламелярних тілець тощо. Однак, жоден з цих методів не використовується рутинно в Україні і вони все рідше використовуються у світі.
Позитивний результат постнатального «пінного» тесту свідчить про зрілість легень (відразу після народження набирають у пробірку 0,5 мл шлункового вмісту дитини, додають 0,5 мл фізіологічного розчину і 1,0 мл 95 % етилового спирту, після чого струшують 15 с.; результат оцінюють на фоні темного паперу за умови доброго освітлення ® щільне кільце міхурців на поверхні рідини свідчить про позитивний результат). Негативний результат цього тесту можна використати для визначення немовлят, яким потрібне профілактичне введення сурфактанту. Однак, у сучасних умовах тест втратив своє практичне значення і реально не використовується.
Клінічні дані. ДР виникають в перші 6 год. життя дитини і підсилюються в динаміці протягом наступних 3 днів.
Лабораторні дані. Порушення газообміну (артеріальна гіпоксемія з рО2 < 60 мм рт. ст.), гіперкапнія (рСО2 > 45 мм рт. ст.), метаболічний/ змішаний ацидоз (рН Ј 7,2).
Рентгенографія органів грудної клітки (рис. 16). Залежно від важкості виявлених рентгенологічних змін розрізняють 4 стадії РДС:
I стадія дрібна зернистість з повітряними бронхограмами, що не виходять за межі тіні серця; границі серця чітко визначаються;
II стадія з'являється типовий дифузний сітчасто-зернистий рисунок з помірно зниженою прозорістю легеневих полів; повітряні бронхограми виходять за межі тіней серця та вилочкової залози;
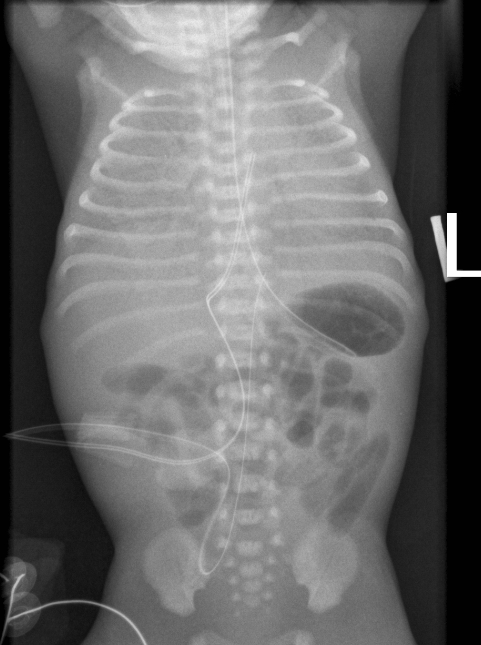
| Рис. 16. РДС, 3 стадія. Видно повітряні бронхограми. Зонд у шлунку. Судинний катетер в аорті, введений через артерію пуповини. |
III стадія зливні затемнення, утворені численними сітчасто-зернистими тінями; повітряні бронхограми доходять до розгалужень 2-го і 3-го порядку; продовжує знижуватись загальна прозорість легеневих полів;
IV стадія «білі легені», повне затемнення всіх легеневих полів; відсутні повітряні бронхограми; тінь серця не контурується.
Додаткове обстеження новонародженої дитини з РДС здійснюється відповідно до вимог, зазначених у пп. 4.4.1 (табл. 6).
4.1.3. Диференціальний діагноз
Включає природжену пневмонію, транзиторне тахіпное новонародженого (ТТН), аспіраційні синдроми, набряк легень, природжені аномалії легень тощо.
4.1.4. Профілактика
Запобігання виникненню передчасних пологів слід вважати основним заходом профілактики РДС, але реальне виконання цього завдання є проблематичним. Покращити кінцеві результати надання допомоги новонародженому можна, забезпечивши своєчасну госпіталізацію вагітної (роділлі) в акушерську установу найвищого рівня.
Найважливіше практичне значення у профілактиці РДС відіграє призначення вагітним із загрозою передчасних пологів ліків, які прискорюють дозрівання легень та інших органів плода. Стандартом такої профілактики у даний час є кортикостероїди (виключно дексаметазон або бетаметазон).
Профілактичне призначення потрібне всім вагітним з терміном від 24 до 34 тиж, які мають загрозу виникнення передчасних пологів або потребують передчасного переривання вагітності. Одночасно можуть призначатись токолітики, які тимчасово зупиняють пологову діяльність і забезпечують досягнення ефекту стероїдної профілактики.
Профілактичний курс складається з 2-х доз (12 мг кожна) бетаметазону, які вводять ЛИШЕ внутрішньом’язово через 24 год. або з 4-х доз дексаметазону (6 мг кожна), які вводять внутрішньом’язово через 12 год. Ефект призначення стероїдів є максимальним через 48 год., однак наявний вже через 24 год. від початку курсу і зберігається 7 днів.
Через потенційно шкідливі ефекти стероїдів для матері і плода повторні курси у даний час не рекомендуються.
Оскільки профілактичне застосування кортикостероїдів тривалістю менше 48 год. також зменшує смертність новонароджених від РДС і внутрішньошлуночкових крововиливів (ВШК), призначати стероїди слід у всіх випадках за винятком загрози негайних пологів.
Встановлено, що клінічна ефективність зазначеної вище схеми антенатального призначення кортикостероїдів відповідній категорії вагітних значно перевищує потенційний ризик, пов’язаний з їх застосуванням, оскільки ефект включає не лише профілактику РДС, але й загальне зниження неонатальної смертності та кількості випадків ВШК.
Не рекомендується використовувати кортикостероїди у разі наявності клінічних симптомів хоріоамніоніту, важких системних інфекцій та імунодефіцитів.
4.1.5. Лікування
Враховуючи, що РДС є транзиторним захворюванням, основним завданням його лікування слід вважати підтримку життєвих функцій, профілактику розвитку позалегеневих ускладнень і вторинного легеневого ураження до моменту початку адекватної продукції власного сурфактанту.
1. Допомога в пологовому залі. Своєчасні й ефективні первинна стабілізація стану і реанімаційна допомога мають принципове значення у разі передчасного народження дитини, насамперед, щодо профілактики ураження легень (див. тему «Асфіксія новонароджених»). Важливо залучити до первинної допомоги кожному недоношеному новонародженому найбільш кваліфікований персонал (неонатолога і неонатальних медсестер).
2. Тепловий захист. Слід пам’ятати, що на додаток до заходів теплового захисту під час надання первинної допомоги в пологовому залі (операційній), новонароджені з ранньою появою ДР потребують перебування в умовах постійного термонейтрального середовища, що забезпечуються у інкубаторі або під джерелом променевого тепла на реанімаційному столику. Переохолодження дитини з ДР будь-якої етіології гальмує синтез сурфактанту і призводить до прогресивного погіршення загального стану дитини.
3. Ендотрахеальне введення екзогенного сурфактанту. Важливий лікувальний, а також ефективний профілактичний захід.
Використання сурфактанту зменшує важкість перебігу РДС, частоту ускладнень і летальність, пов’язану з цим захворюванням.
Перевагу надають натуральним сурфактантам порівняно з синтетичними (в Україні зараз зареєстровані лише натуральні сурфактанти – Куросурф® [80 мг фосфоліпідів/мл], Сурванта® [25 мг/мл], Інфасурф® [35 мг/мл] і Неосурф® [25 мг/мл]).
Препарат сурфактанту вводять якомога скоріше після визначення наявних показань.
Терапію екзогенним сурфактантом здійснюють за умови суворого і чіткого дотримання вимог стерильності на всіх етапах процедури.
Препарат уводять ендотрахеально інстиляцією через зонд, уведений до ендотрахеальної трубки, або через додатковий порт спеціальної ендотрахеальної трубки. Кінець зонда має ледь виступати за край трубки і знаходитись над біфуркацією трахеї. Перед уведенням до ендотрахеальної трубки зонд укорочують, щоб запобігти потраплянню сурфактанту до одного з головних бронхів.
Разова доза сурфактанту становить 100 мг фосфоліпідів (3,0-4,0 мл емульсії) на кг маси тіла дитини. Лише лікувальна доза Куросурфу® є більшою (200 мг/кг фосфоліпідів). Потрібну кількість сурфактанту в більшості випадків вводять у 2 напівдозах через 30 с, змінюючи положення новонародженого (після кожного введення повертають спочатку на один, а потім на інший бік, штучно вентилюючи легені). Можливим є й одномоментне введення повної дози.
· Профілактичне введення сурфактанту (протягом 15-30 хв. після народження, після стабілізації стану дитини) в пологовій кімнаті (операційній) потрібно передбачити в таких випадках:
1) новонародженим з терміном гестації < 28 тиж гестації;
2) новонародженим з терміном гестації 28-30 тиж, якщо вони потребують інтубації трахеї після народження або матір не отримала курсу стероїдної профілактики;
3) рутинне профілактичне введення сурфактанту більше не рекомендується (раннє використання СРАР забезпечує досягнення кращого результату, ніж профілактичне введення сурфактанту).
· Введення сурфактанту з метою лікування РДС
1) новонародженим з клінічними і (або) рентгенологічними ознаками РДС, яким сурфактант не вводили профілактично; першу лікувальну дозу препарату потрібно ввести якомога скоріше (оптимально - в перші 2 год. життя дитини) після встановлення неефективності СРАР (потреба у додатковому кисні понад 30-40%).
2) другу, а інколи і третю, дозу сурфактанту (через 6-12 год. після попередньої), призначають, якщо:
- дитина продовжує потребувати високих концентрацій кисню (> 40 %) або ШВЛ;
- після введення першої дози сурфактанту дитина на СРАР з позитивним тиском на видиху ³ 6 см Н2О потребує ³ 50 % кисню у дихальній суміші;
- стан дитини на СРАР-терапії погіршується, і виникають показання до ШВЛ.
4. Дихальна підтримка і киснева терапія, призначення рідини, харчування, неспецифічні заходи (див. попередню тему)
5. Призначення антибіотиків . Оскільки проведення диференціального діагнозу між РДС і бактеріальною пневмонією не завжди можливе, всім новонародженим з клінічно явними ДР рекомендується призначати антибіотики (див. попередню тему).
4.2. Неонатальна пневмонія
Інфекційне ураження легень в новонароджених може спричинюватись бактеріями , вірусами , мікоплазмами , спірохетами , найпростішими і грибами. Спектр потенційних збудників неонатальної пневмонії, як правило, відповідає спектру інфекційних агентів,що спричинюють сепсис новонароджених.
У разі розвитку природженої пневмонії інфекційний процес виникає внутрішньоутробно і дитина народжується з відповідними клінічними ознаками. Якщо передача збудника відбувається трансплацентарно, природжена пневмонія є одним з компонентів генералізованої внутрішньоутробної інфекції. Однак, найпоширенішою причиною захворювання є аспірація або заковтування інфікованих навколоплідних вод.
Таким чином, за моментом інфікування розрізняють природжену (шляхи інфікування - трансплацентарний або висхідний/ низхідний), набуту під час пологів (шлях інфікування – контамінаційний) і постнатальну (нозокоміальну) пневмонію новонароджених.
У випадку аспірації інфікованих навколоплідних вод безпосередньо перед або під час пологів у перші години після народження можуть домінувати ознаки аспіраційного синдрому, і лише через 1-2 доби з’являються ознаки інфекційного захворювання загалом і ураження легень зокрема.
Рентгенологічно розрізняють дрібновогнищеву, вогнищеву, зливну, моно- і полісегментарну, а також інтерстиціальну форми пневмоній новонароджених, однак однозначно визначити кожну з них у конкретної дитини дуже складно (рис. 16).
Окрім часу виникнення і форми, класифікація пневмоній в новонароджених передбачає також визначення важкості (важка, середньої важкості або легка), тривалості (гострий перебіг – 2-6 тиж, підгострий – 7-11 тиж, затяжний – > 12 тиж), а також особливостей (з ускладненнями чи без ускладнень) їх перебігу.
Недоношені немовлята загалом вразливіші до інфекції, ніж доношені новонароджені. За даними різних авторів, від 15 до 40 % мертвонароджених дітей мають ознаки природженої пневмонії на автопсії.
4.2.1. Діагноз
Загалом діагноз пневмонії у новонароджених є достатньо складним з огляду на неспецифічність клінічних й інструментальних даних, а також через проблемність диференціації від неонатального сепсису.
Анамнез. Немовлята, хворі на природжену пневмонію, часто народжуються передчасно, у критичному стані і потребують реанімації. Важливе значення мають інфекційні чинники ризику в анамнезі матері: смерть попередньо народжених дітей від інфекцій, хронічна інфекційна патологія, перш за все, сечовидільної і статевої систем, гострі інфекційні захворювання під час вагітності, хоріоамніоніт, передчасний розрив оболонок, тривалий безводний період тощо.
Клінічні дані. Включають симптоми гіпоксично-ішемічного ураження (природжена пневмонія) і ДР; у легенях на фоні ослабленого дихання практично завжди вислуховуються вологі хрипи; часто також виявляються інші вогнища інфекції і/ або прояви системного інфекційного процесу - пригнічення, температурна нестабільність, апное, знижені апетит і толерантність до ентерального харчування, порушення гемодинаміки, жовтяниця, брудно-сірий відтінок шкіри, геморагічний синдром тощо.
Лабораторні дані
· У загальному аналізі крові можуть виявлятися лейкопенія (< 4 х 109/л) або лейкоцитоз (> 20 х 109/л після першої доби життя), збільшення абсолютної кількості паличкоядерних нейтрофілів (> 1,5 x 109/л), підвищення лейкоцитарного індексу (співвідношення між кількістю незрілих і загальною кількістю нейтрофілів) > 0,2, тромбоцитопенія (< 150 х 109/л). Слід пам’ятати, що зсув лейкоцитарної формули вліво може спричинюватись також асфіксією, важким пологовим стресом, прееклампсією, підвищенням температури тіла матері тощо.
· Мікроскопія (фарбування за Ґрамом) і бактеріологічне дослідження трахеального аспірату, отриманого за допомогою прямої ларингоскопії, можуть допомогти з’ясувати етіологію пневмонії. Водночас, виділені збудники можуть лише колонізувати слизову оболонку дихальних шляхів і не мати відношення до інфекційного процесу.
· Дослідження крові на стерильність допоможе виявити бактеріємію, що часто супроводжує розвиток пневмонії, а також неонатального сепсису. У разі наявності клінічних симптомів генералізованої інфекції показаними є люмбальна пункція, бактеріологічне дослідження, загальний і біохімічний аналізи ліквору. Слід пам’ятати, що безпосередньо перед проведенням пункції потрібно визначити рівень глюкози в крові дитини.
· Газовий склад крові, показники кислотно-лужної рівноваги та/або безперервний моніторний контроль (пульсоксиметрія) за станом оксигенації крові потрібні для діагностики відповідних порушень і контролю за дихальною терапією, що проводиться.
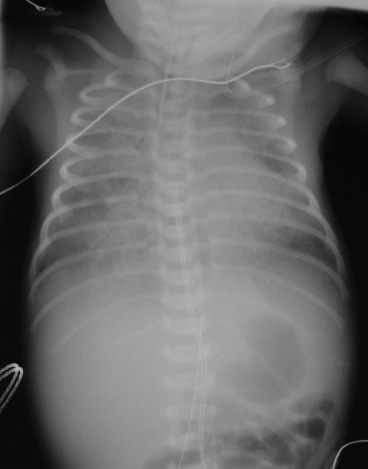
| Рис. 17. Пневмонія, спричинена лістерією, у недоношеної дитини. |
Рентгенологічні дані можуть бути ідентичними до тих, що виявляються у дітей з РДС, неспецифічними (лінійні тіні або зливні затемнення) або специфічними (інфільтративні тіні, абсцедування).
Диференціальний діагноз включає, перш за все, РДС, транзиторне тахіпное новонародженого (ТТН), синдроми аспірації, гіпоплазію легень, набряк легень, легеневу кровотечу, а також природжені аномалії серця.
4.2.2. Профілактика
1. Санація хронічних вогнищ інфекції у жінок фертильного віку.
2. Призначення антибіотиків матері в пологах за наявності таких чинників ризику:
- смерть попередньо народженої дитини від бактеріальної інфекції (особливо ранньої);
- тривалість безводного періоду > 18 год.;
- фебрильна температура під час пологів;
- передчасні пологи;
- передчасний розрив оболонок плода;
- хоріоамніоніт.
Перші 4 чинники ризику пов’язані з можливістю інфікування новонародженої дитини стрептококами групи В, які колонізують пологові шляхи матері. Таке інфікування найчастіше відбувається під час пологів.
· Для проведення відповідної антибіотикопрофілактики на початку пологів роділлі призначають пеніцилін (5 млн. ОД [початкова доза навантаження] à 2,5 млн. ОД ЛИШЕ внутрішньовенно через кожні 4 год. до народження дитини) або напівсинтетичний пеніцилін (2 г à 1 г внутрішньовенно через кожні 4 год. до народження дитини), або цефалоспорин 1-2 генерації (2 г à 1 г внутрішньовенно через кожні 8 год. до народження дитини) або еритроміцин (500 мг внутрішньовенно кожні 6 год.). У разі підозри на анаеробну інфекцію можливим є також додаткове застосування кліндаміцину (900 мг внутрішньовенно через 8 год.).
Цефалоспорини, еритроміцин або кліндаміцин застосовують за наявності даних анамнезу матері про алергічні реакції на пеніциліни.
У випадку виділення резистентних штамів може використовуватись ванкоміцин (1 г внутрішньовенно через 12 год).
Антибактеріальну профілактику під час пологів вважають адекватною лише за умови введення пеніциліну, ампіциліну, цефазоліну або ванкоміцину щонайменше за 4 год. до народження дитини. Ефективність еритроміцину і кліндаміцину щодо інфекції, спричиненої стрептококом групи В, може бути сумнівною.
· Відразу після встановлення діагнозу передчасного розриву оболонок плода (вагітність недоношена) рекомендується внутрішнє призначення еритроміцину (1-2 г за 3-4 прийоми на добу) або напівсинтетичного пеніциліну (за винятком препаратів, що містять клавуланову кислоту) [1-2 г ампіциліну що 6 год. внутрішньовенно протягом перших 24 год. з наступним переходом на внутрішній прийом – 500 мг кожні 6 год.] на 7 днів або до моменту народження дитини.
· За наявності хоріоамніоніту рекомендується внутрішньовенне призначення антибіотика широкого спектру дії (найчастіше, цефалоспорини 3-4 генерації).
4.2.3. Лікування
Найважливішим заходом слід вважати своєчасне призначення новонародженій дитині антибіотиків. Принципи антибактеріальної терапії в новонароджених описано в розділі «Бактеріальні інфекції у новонароджених»). Слід також мати на увазі можливу вірусну етіологію пневмонії, загрозу розвитку стійкої легеневої гіпертензії новонародженого, запобігати виникненню й агресивно лікувати ацидоз.
Загальні принципи терапії і підхід до обстеження немовлят з підозрою на пневмонію відповідають викладеним вище (див. попередню тему).
У важких випадках природженої пневмонії може бути доцільним використання екзогенного сурфактанту.
4.3. Транзиторне тахіпное новонародженого (ТТН)
Транзиторне тахіпное новонародженого (ТТН) – захворювання відоме також як синдром сповільненого звільнення легень від фетальної легеневої рідини. ТТН є однією з найбільш поширених причин ДР (ДР) у немовлят з гестаційним віком > 34 тиж, однак, відповідний діагноз, як правило, може бути встановлений лише після виключення наявності інших легеневих захворювань.
4.3.1. Діагноз
Дані анамнезу. Дитина, в якої розвивається ТТН, звичайно, має один або кілька з перерахованих чинників ризику в анамнезі: 1) передчасні пологи при терміні гестації > 34 тиж; 2) пологи за допомогою кесарського розтину; 3) пізнє перетискання пуповини; 4) призначення матері седативних препаратів; 5) фетальний дистрес; 6) дефекти надання реанімаційної допомоги в пологовому залі; 7) низька оцінка за Апґар (дихальна депресія).
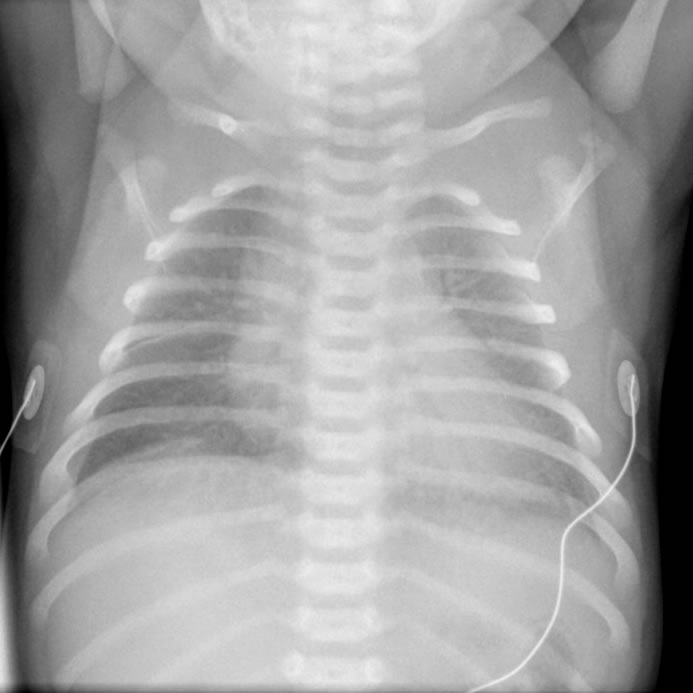
| Рис. 18. Типові рентгенологічні зміни, які характеризують ТТН. |
Об’єктивні дані. Провідний симптом ДР у дитини з ТТН – тахіпное, що може сягати 120/хв. Часто звертають на себе увагу ціаноз при диханні кімнатним повітрям, роздування крил носа, бочкоподібна грудна клітка зі втягненням її податливих ділянок, експіраторний стогін. Характерними є поява відповідних симптомів невдовзі після народження і прогресивна їх позитивна динаміка. Затримка фетальної рідини у легенях може супроводжувати клінічний перебіг інших захворювань легень у новонароджених.
Лабораторно у газовому складі крові – гіпоксемія при диханні кімнатним повітрям, що, як правило, коригується підвищенням FiO2 до 50 %. Протягом перших годин після народження часто можуть траплятись гіперкапнія та помірний дихальний ацидоз. Відсутні лабораторні ознаки інфекційного процесу.
Рентгенологічно виявляється збільшений об’єм легень, зниження прозорості легеневих полів, рідину у міждолевих щілинах, лінійні тіні за ходом трахеобронхіального дерева, а часом суцільні ділянки затемнень (рис.18).
4.3.2. Диференціальний діагноз








