Послідовність виконання роботи
Міністерство освіти і науки України
Національний університет “Львівська політехніка”
Кафедра фізичної та колоїдної хімії

Лабораторна робота №1
на тему:
“Одержання дисперсних систем”
Виконав:
Студент групи МЕ – 13
Прийняв:
Мета роботи:
Отримати дисперсні системи конденсаційними та диспергаційними методами.
Послідовність виконання роботи
1. Одержання золів методом заміни розчинника
Робота 1. Отримання золю каніфолі.
У пробірку наливають 10 мл дистильованої води і, перемішуючи, 1 краплину 2% спиртового розчину каніфолі. Утворюється прозорий золь, який виявляє здатність до опалесценції (тобто розсіювання світла внаслідок дифракції).
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Робота 2. Одержання золю сірки.
У пробірку наливають 10 мл дистильованої води і , перемішуючи, вводять 0,5-1 мл насиченого спиртового розчину сірки. Утворюється прозорий золь, який виявляє здатність до опалесценції. _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Одержання золів за допомогою хімічних реакцій
Робота 3. Одержання золю йодистого срібла в присутності електроліту – стабілізатора KJ.
До 10 мл 0,01н розчину KJ краплинами додають 1 мл 0,05н розчину AgN 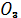 і одержують золь, який виявляє здатність до опалесценції.
і одержують золь, який виявляє здатність до опалесценції.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Робота 4. Отримання золю берлінської лазурі.
До 10 мл 1% розчину Fe 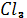 додають 1-2 краплини 0,01% розчичну
додають 1-2 краплини 0,01% розчичну  Fe
Fe 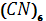 .
.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Робота 5. Одержання золю 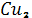 Fe
Fe 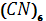 .
.
До 10 мл 0,5% розчину 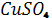 додають 1-2 краплини 0,01% розчину
додають 1-2 краплини 0,01% розчину  Fe
Fe 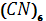 .
.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Одержання емульсії методом механічного диспергування.
Робота 7. Отримання емульсії декану.
У пробірку наливають 5 мл дистильованої води, додають 3-4 краплини забарвленого в синій колір декану і , закривши пробірку, інтенсивно струшують. Отримана емульсія є нестійкою і швидко руйнується: краплини дисперсної фази зливаються та спливають, система розшаровується. З метою стабілізації до емульсії додають 1-2 мл водного розчину поверхнево-активної речовини (звичайного мийного засобу, як-от шампуню чи мила), активно струшують. За допомогою піпетки відбирають краплину стабілізованої емульсії, наносять на предметне скло і розглядають під мікроскопом при восьмикратному збільшенні.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Контрольні запитання
1. Дайте визначення понять «фаза», «гомогенна система», «гетерогенна система», наведіть приклади.
Фаза – це частина системи із властивим їй хімічним складом та фізичними властивостями.
Гомогенна система – це система, що складається з однієї фази. Наприклад: суміш газів, розчин солі у воді.
Гетерогенна система – це система, що складається декількох фаз. Наприклад: суміш води та олії, суміш льоду, води та водяної пари над ними.
2. Які системи називаються дисперсними? Наведіть приклад.
Дисперсна система – це система , в якій одна з фаз перебуває в подрібненому стані. Прикладом є гетерогенна система.
3. Дайте визначення понять «дисперсна фаза» і «дисперсійне середовище».
Дисперсна фаза – це частинка подрібненої речовини.
Дисперсне середовище – це суцільна частина дисперсної системи.
4. Які дисперсні системи називають «емульсіями»? Наведіть приклади.
Емульсія – це дисперсна система, утворена двома взаємно нерозчинними рідинами, котрі сильно відрізняються за полярністю..Переважно полярною рідиною є вода, а неполярною – будь-яка органічна сполука низької полярності, яку загалом називають олією. Наприклад, у прямій емульсії «молоко» краплини жиру утворюють ДФ, а водний розчин – ДС.
5. Як можна класифікувати дисперсні системи?
Дисперсні системи можна класифікувати за агрегатним станом дисперсної фази та дисперсійного середовища і за розміром частинок дисперсної фази.
6. Які дисперсні системи називають «золями»? наведіть приклади.
Системи, у яких розмір твердих частинок ДФ лежить в межах 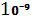 -
- 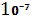 м і розподілені вони і рідкому дисперсійному середовищі називаються золями.
м і розподілені вони і рідкому дисперсійному середовищі називаються золями.
7. Наведіть класифікацію дисперсних систем за розміром частинок.
Класифікація дисперсних систем за розміром частинок дисперсної фази
| Клас | Розміри частинок, м | Представники |
| Високодисперсні | 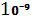 - - 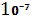 м м
| Золі металів, рубінове скло,сік рослин |
| Середньо дисперсні | 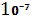 - - 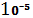 м м
| Сажа, аеросил, крохмаль |
| Грубо дисперсні | 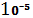 і більше і більше
| Какао-порошок, цукор-пудра, борошно |
8. Які системи називають колоїдними?
Колоїдні системи – це системи з розміром частинок дисперсної фази від 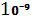 до
до 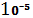 м
м
9. Поясніть, чому істинні розчини не належать до дисперсних систем.
Істинні розчини належать до гемогенних систем, оскільки розчинені речовини дисперговані до молекул чи іонів і не утворюють окремої фази.
10. Назвіть два основні методи отримання дисперсних систем, поясніть, у чому полягає їхня принципова відмінність.
Дисперсні системи можна отримувати або подрібненням крупних частинок(диспергаційні методи), або об’єднанням молекул, іонів у більші агрегати(конденсаційні або агрегацій ні методи). Диспергаційними методами одержують, переважно, середньо- та грубо дисперсні системи. Високодисперсні системи доцільно отримувати конденсаційними методами.
11. Охарактеризуйте диспергаційні методи одержання колоїдних систем. Наведіть відповідні приклади.
Диспергаційні методи поділяються на:
· Механічне диспергування: дроблення, розмелювання, розтерання – отримують цемент, борошно, крупи, какао-порошок, пігменти тощо;
· Ультразвукове диспергування – одержують емульсії, порошки крихких речовин;
· Електричне диспергування у вольтовій дузі – отримують золі металів, графіту.
12. Охарактеризуйте агрегаційні методи отримання колоїдних систем
Агрегаційними методами доцільно отримувати високодисперсні системи. Конденсація може мати фізичну або хімічну природу. У разі хімічної конденсації нова фаза виникає під час хімічної реакції, котра проходить з утворенням речовини, нерозчинної в певному дисперсійному середовищі. До фізичної конденсації належать: заміна розчинника, кристалізація зрощення та конденсація з пари. У методі заміни розчинника істинний розчин речовини невеликими порціями додають до рідини, котра добре розчиняє розчинник, але погано – розчинену речовину, що призводить до виділення її у вигляді окремої фази. Конденсація парів може відбуватися в пересичених системах, наприклад, під час різкого охолодження. В природі так утворюються тумани і хмари. До методів фізичної конденсації також належить кристалізація речовин з їхніх пересичених або переохолоджених розчинів. На першому з цих методів ґрунтується виробництво цукру. Другий метод під час отримання морозива забезпечує необхідні властивості та товарний вигляд продукту.








