Блок уроков Алкины (ацетиленовые углеводороды)
I . Изучение нового материала.
Алкины – органические соединения, углеводороды алифатического (ациклического) непредельного характера, в молекуле которых между атомами углерода – одна тройная связь, и которые соответствуют общей формуле CnH 2 n -2 .
Для алкинов характерна sp-гибридизация, угол между связями 180°. Длина тройной связи 0,120нм. Одновременно, наличие двух подвижных, легко поляризуемых π-связей приводит к тому, что алкины химически более активны, чем алкены, и вступают в реакции двойного присоединения.
В названии алкинов содержится суффикс –ин, обозначающий принадлежность соединения к данному классу.
Простейший алкен: C2H2 или H – C ≡ C – H этин или ацетилен,
В определении названия алкина (как и у алкенов) положение кратной связи имеет при нумерации преимущество перед остальными.
Для алкинов характерны следующие виды изомерии:
1. Структурная изомерия:
а) изомерия углеродного скелета
1 2 3 4 5 1 2 3 4
CH≡C – CH2 – CH2 – CH3 CH≡C – CH – CH3
|
CH3
пентин-1 3-метилбутин-1
б) изомерия положения кратной связи
1 2 3 4 5 1 2 3 4 5
CH≡C – CH2 – CH2 – CH3 CH3–C ≡ C – CH2 – CH3
пентин-1 пентин-2
в) изомерия положения заместителей (Hal, - NO2, SO2-OH и др.)
1 2 3 4 5 1 2 3 4 5
CH ≡ C – CH – CH2 – CH3 CH ≡ C – CH2 – CH – CH3
| |
Cl Cl
3-хлорпентин-1 4-хлорпентин-1
2. Пространственная геометрическая изомерия для алкинов, в отличие от алкенов, не характерна.
3. Межклассовая изомерия (с алкадиенами и циклоалкенами)
1 2 3 4 5 1 2 3 4 5
CH ≡ CH – CH2 – CH2 – CH3 CH2=CH – CH = CH – CH3 CH = CH
пентин-1 1,3-пентадиен | |
CH2 CH2
\ /
CH2
циклопентен
Физические свойства.
C2H2 – C4H6 – газы, C5H8 – C15H28 - жидкости, C16H30 – … – твердые вещества. Алкены плохо растворимы в воде, но лучше, чем алканы и алкены. Их температуры плавления и кипения, также как у алканов и алкенов, закономерно повышаются при увеличении молекулярной массы соединения. Алкины имеют специфический запах.
Химические свойства.
I. Реакции присоединения (двойное присоединение – в два ступени).
1. Гидрирование (в присутствии металлических катализаторов – Pt, Pd, Ni):
CH ≡ C – CH3 + 2 H2 à CH3 – CH2 – CH3
CH ≡ C – CH3 + H – H à CH2=CH – CH3 I ступень
пропин пропилен
CH2=CH – CH3 + H – H à CH3 – CH2 – CH3 II ступень
пропилен пропан
2. галогенирование
CH ≡ C – CH3 + 2 Br2 à CHBr2 – CBr2 – CH3
1 2 3
CH ≡ C – CH3 + Br – Br à CH = C – CH3 I ступень
| |
Br Br
пропин 1,2-дибромпропен
Br Br
1 | 2 | 3
CH = C – CH3 + Br – Br à CH – C – CH3 II ступень
| | | |
Br Br Br Br
1,2-дибромпропен 1,1,2,2-тетрабромпропан
Реакция алкинов с бромной водой – качественная реакция на алкины (бромная вода обесцвечивается).
3. гидрогалогенирование (по правилу Марковникова: при присоединении веществ с полярной ковалентной связью типа HX (где X – это - Hal, - OH и т.д.) к несимметричным непредельным углеводородам по месту разрыва П-связи атом водорода присоединяется к наиболее гидрированному атому углерода, а X – к наименее гидрированному атому углерода)
CH ≡ C – CH3 + 2 HBr à CH3 – CBr2 – CH3
1 2 3
CH ≡ CH – CH3 + H – Br à CH2 = C – CH3 I ступень
|
Br
пропин 2- бромпропен
Br
1 2 3 1 2| 3
CH2=CH – CH3 + H – Br à CH3 – CH – CH3 II ступень
| |
Br Br
2-бромпропен 2,2- дибромпропан
4. гидратация (по правилу Марковникова): ацетилен образует альдегид, его гомологи – кетоны (реакция Кучерова М. Г.)
H
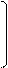
 Hg+ /
Hg+ /
 HC ≡ CH + H – OH à CH2 = CH à CH3 – C
HC ≡ CH + H – OH à CH2 = CH à CH3 – C
 | \\
| \\
 O – H O
O – H O
виниловый спирт этаналь
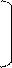
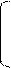 Hg+
Hg+
 CH ≡ C – CH3 + H – OH à CH2 = C – CH3 à CH3 – C – CH3
CH ≡ C – CH3 + H – OH à CH2 = C – CH3 à CH3 – C – CH3
 | ||
| ||
 O – H O
O – H O
пропин непредельный спирт пропанон
II. Реакции окисления.
1. горение
t°
2 C2H2 + 5 O2 (избыток) à 4 CO2 + 2 H2O
t°
2 C2H2 + 3 O2 (недостаток) à 4 CO + 2 H2O
t°
2 C2H2 + O2 (сильный недостаток) à 4 C + 2 H2O
Смеси ацетилена с воздухом или кислородом взрывоопасны; ацетилен может также взрываться при ударах.
2. неполное окисление кислородом окислителя (KMnO4 в нейтральной среде, K2Cr2O7 в кислой среде) – конечным продуктом реакции являются карбоновые кислоты.
O O
из KMnO4 \\ //
CH ≡ CH + 4 [O] ––––––––à HO – C – C – OH
этандиовая (щавелевая) кислота
O O
\\ //
3 CH ≡ CH + 8 KMnO4 + 4 H2O à 3 HO – C – C – OH + 8 KOH + 8 MnO2
Но так как кислота взаимодействует со щелочью, то более правильно следует писать:
O O
\\ //
3HC-1 ≡ C-1H + 8KMn+7O4 à 3KO– C+3– C+3– OK + 2KOH + 8Mn+4O2 + 2H2O
 |  |  |
C2-1 -8ē → C2+3 3 3C2-2 -24ē → 3C2+3
24
Mn+7 +3ē → Mn+4 8 8Mn+7 +24ē → 8Mn+4
O
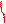 из KMnO4 //
из KMnO4 //
CH3 – C ≡ C – CH3 + 3 [O] + H2O ––à 2 CH3 – C
\
OH
бутин-2 этановая кислота
(уксусная кислота)
O O
 из KMnO4 // //
из KMnO4 // //
CH3 – C ≡CH + 3 [O] + H2O ––à CH3 – C + H – C
\ \
OH OH
пропин этановая кислота метановая кислота
(уксусная кислота) (муравьиная кисллота)
Обесцвечивание щелочного раствора KMnO 4 – это качественная реакция на непредельные углеводороды (алкины обесцвечиваются быстрее, чем алкены).
III. Реакции полимеризации.
1. димеризация (алкилирование)
kt 1 2 3 4
CH ≡ CH + CH ≡ CH à CH2 = CH – C ≡ CH
винилацетилен
(бутен-1-ин-3)
2. циклотримеризация (ароматизация)
3 C2H2 à C6H6
Бензол
3. полимеризация
t0, kt, P
…+ CH2≡CH2 + CH2≡CH2 + …––––––à …-CH2 = CH2 – CH2 = CH2-…
ацетилен полиацетилен
t0, kt, P
n CH ≡ CH ––––––à (– CH = CH –)n
мономер структурное звено
где n – это степень полимеризации
t0, kt, P
n CH3 – C ≡ CH ––––––– à (– C = CH –)n
|
CH3
пропин полипропин
(метилацетилен) (полиметилацетилен)
IV. Реакции замещения (замещение атомов «H», связанных с sp-гибридизованными атомами углерода). Атомы водорода, связанные с sp-гибридизованными атомами углерода в молекулах алкинов, обладают значительной подвижностью (что объясняется поляризацией связи ≡C–H), поэтому они могут замещаться атомами металлов – в результате чего образуются ацетилениды. Способность к таким реакциям отличает алкины от других непредельных углеводородов.
1. Взаимодействие с металлическим натрием в жидком аммиаке
2 CH ≡ CH + 2 Na à 2 CH ≡ CNa +H2 I ступень
моноацетиленид натрия
2 CH ≡ CNa + 2 Na à 2 CNa ≡ CNa + H2 II ступень
диацетиленид натрия
Но более правильно следует писать:
CH ≡ CH + NaNH2 à 2 CH ≡ CNa +NH3↑
моноацетиленид натрия
2. Взаимодействие с аммиачными растворами солей меди (I) – только монозамещенные ацетилена
CH3 – C ≡ CH + [Cu(NH3)2]Cl à CH3 – C ≡ CCu↓ + HCl + 2 NH3↑
метилацетилен метилацетиленид меди (I)
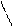
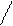 CH3 – C ≡ C – CH3 + [Cu(NH3)2]Cl à
CH3 – C ≡ C – CH3 + [Cu(NH3)2]Cl à
диметилацетилен
Данная реакция используется для очистки высших монозамещенных алкинов. Устойчивые во влажном состоянии, эти ацетилениды легко взрываются в сухом виде!
3. Взаимодействие с аммиачным раствором оксида серебра (I) – только монозамещенные ацетилена
CH3 – C ≡ CH + [Ag(NH3)2]OH à CH3 – C ≡ CAg↓ + H2O + NH3↑
метилацетилен метилацетиленид серебра (I)
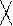 |
CH3 – C ≡ C – CH3 + [Ag(NH3)2]O à
диметилацетилен
Данная реакция используется для очистки высших монозамещенных алкинов. Устойчивые во влажном состоянии, эти ацетилениды легко взрываются в сухом виде!
V. Реакции изомеризации (изомеризация тройной связи).
спирт. р-р KOH; 170°
CH ≡ C – CH2 – CH3 -------------------------à CH3 – C ≡ C – CH3
бутин-1 бутин-2
(этилацетилен) (диметилацетилен)
Получение.
I. Получение ацетилена
1. В промышленности
а. Термическое разложение природного газа или углеводородов нефти:
1000°C
2 CH4 ---------à CH ≡ CH + 3 H2
метан
1200°C
CH2 = CH2 ----------à CH ≡ CH + 2 H2
Этилен
2. В лаборатории
а. Гидролиз карбида кальция (реакция Велера Ф.) или карбидов других активных металлом (K, Mg)
CaC2 + 2 H2O à C2H2↑ + Ca(OH)2
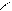
 C H – OH C – H OH
C H – OH C – H OH
 ||| Ca + à ||| + Ca
||| Ca + à ||| + Ca
C H – OH C – H OH
II. Получение гомологов ацетилена
1. Дегидрогалогенирование дигалогеналканов действием спиртового раствора щелочи или твердой щелочи при нагревании:
H Br
| | t°
CH3 – CH2 –C – C – CH3 + 2 Na – OH à CH3 – CH2 –C ≡ C – CH3 + 2 Na – Br + 2 H – OH
| |
Br H
2,3-дибромпентан пентин-2
H Br
| | t°
CH3 – CH2 –C – CH + 2 Na – OH à CH3 – CH2 –C ≡ CH + 2 Na – Br + 2 H – OH
| |
H Br
1,1-дибромбутан бутин-1
(этилацетилен)
2. Алкилирование ацетиленидов
CH3 – C ≡ C – Na + Br – CH2 – CH3 à CH3 – C ≡ C – CH2 – CH3 + NaBr
метилацетиленид натрия метилэтил ацетилен
(пентин-2)
Применение.
Этилацетат 1,2-дихлорэтан
 (CH3COOC2H5) (CH2Cl – CH2Cl)
(CH3COOC2H5) (CH2Cl – CH2Cl)
 | |||||
 | |||||
 | |||||
Растворители
 Щавелевая кислота
Щавелевая кислота
 (HOOC – COOH)
(HOOC – COOH)


 Уксусная кислота Ацетилен Сварка и резка
Уксусная кислота Ацетилен Сварка и резка
 (CH3COOH) CH ≡ CH металлов
(CH3COOH) CH ≡ CH металлов
 | |||
 |
Винилацетат
(CH3COOCH = CH2)
 Этаналь Винилацетилен
Этаналь Винилацетилен
 (уксусный альдегид) (CH2 = CH – C ≡ CH)
(уксусный альдегид) (CH2 = CH – C ≡ CH)
(CH3CHO) Клей ПВА
 |
Этанол Хлоропрен Хлорвинил
(этиловый спирт) (2-хлорбутадиен-1,3) CHCl = CH2
 (C2H5OH) (CH2 = CCl – CH = CH2)
(C2H5OH) (CH2 = CCl – CH = CH2)
 |  |
Парфюмерия, Хлоропреновый каучук Полихлорвинил
растворитель
Домашние задание.
1.Каково значение ацетилена.
2.Напишите сообщение про природный каучук.








