Инструменты и оборудование, использованные при эксперименте
Специальный экспериментальный низкоамперный электролизер (рис. 72); вольтметр М2004 класса точности 0,2 (ГОСТ 8711-78); амперметр М20015 класса точности 0,2 (ГОСТ 8711-60); электронные весы с ценой деления 0,01 грамма; секундомер с ценой деления 0,1с; электронный осциллограф АСК-2022.
Процесс низкоамперного электролиза может состоять из двух циклов, в одном цикле электролизер включен в электрическую сеть, а в другом - выключен (табл. 13).
Процесс генерирования газов легко наблюдается по выходу образующихся пузырьков. Они продолжают выделяться и после отключения электролизера от сети. Конечно, после отключения электролизера от сети интенсивность выхода газов уменьшается, но не прекращается в течение многих часов. Это убедительно доказывает тот факт, что электролиз идет за счет разности потенциалов на электродах [2]. В табл. 15 представлены результаты эксперимента при периодическом питании электролизера импульсами выпрямленного напряжения и тока.
Таблица 15.
| Показатели | Сумма |
| 1 – продолжительность работы электролизера, включенного в сеть, в шести циклах t, мин | 6x30=180,0 |
| 2 – показания вольтметра V, Вольт | 3,750 |
| 3 – показания амперметра I, Ампер | 0,022 |
| 4 – расход энергии (P=VxIxτ/60), Втч | 0,247 |
| 5 – продолжительность работы электролизёра, отключенного от сети, за шесть циклов, мин | 6x30=180,0 |
| 6 – изменение массы раствора m, грамм | 0,45 |
| 7 – масса испарившейся воды m’, грамм | 0,01x6=0,06 |
| 8 – масса воды, перешедшей в газы m’’=m-m’, грамм | 0,39 |
| 9 – расход энергии на грамм воды, перешедшей в газы P’=P/m’’, Втч/грамм воды | 0,63 |
| 10 –существующий расход энергии на грамм воды, переходящей в газы P’’, Втч/гр. воды | 5,25 |
| 11 – уменьшение расхода энергии на получение водорода из воды K= P’’/ P’, раз | 8,33 |
| 12- количество выделившегося водорода ΔМ=0,39x1,23x0,09=0,043, грамм | 0,043 |
| 13 - энергосодержание полученного водорода (Е=0,043х142/3,6) =1,70, Втч | 1,70 |
| 14-энергетическая эффективность процесса электролиза воды ( Eх100/ P), % | 6 88 ,3 |
Есть основания полагать, что низкоамперный электролизёр обладает не только свойствами конденсатора, но и источника электричества одновременно. Зарядившись в начале, он постепенно разряжается под действием электролитических процессов, протекающих в нём. Количество генерируемой им электрической энергии оказывается недостаточным, чтобы поддерживать процесс электролиза, и он постепенно разряжается. Если его подзаряжать периодически импульсами напряжения, компенсирующими расход энергии, то заряд электролизёра, как конденсатора, будет оставаться постоянным, а процесс электролиза – стабильным [2].
Мы представили результаты эксперимента, в котором конические электроды были изготовлены из простой стали. Вполне естественно, что есть другие материалы с большими свойствами катализатора процесса разложения воды на водород и кислород без затрат электрической энергии (табл. 15).
Небольшая производительность описанного процесса вынуждает нас знать детали более производительных современных электролитических процессов для получения водорода из воды, чтобы найти условия их реализации при меньших затратах электрической энергии.
Оказалось, что процесс электролиза может протекать при напряжении 1,5-2,0 В между анодом и катодом и силе тока 0,02 А. Поэтому этот процесс назван низкоамперным.
Прежде всего, отметим, что материал анода и катода один – сталь, что исключает возможность формирования гальванического элемента. Тем не менее, на электродах ячейки появляется разность потенциалов около 0,10 В при полном отсутствии электролитического раствора в ней. После заливки раствора разность потенциалов увеличивается. При этом положительный знак заряда всегда появляется на верхнем электроде, а отрицательный – на нижнем. Если источник постоянного тока генерирует импульсы, то выход газов увеличивается.
Отметим особо важный момент. Зазор между электродами низковольтного электролиза соизмерим с размером пузырей газа, поэтому, поднимаясь вверх, пузыри газа способствуют механическому разрушению связей между атомами в молекулах и кластерах. На это, как мы уже показали, энергии тратится меньше, чем на термическое разрушение этих связей. Процесс низкоамперного электролиза может состоять из двух циклов, в одном цикле электролизер включен в электрическую сеть, а в другом - выключен (табл. 15, 16).
Таблица 16. Показатели электролиза воды
| Показатели | Сумма |
| 1 – продолжительность работы электролизера, включенного в сеть, в шести циклах t, мин | 6x10=60,0 |
| 2 – показания вольтметра V, Вольт; | 11,4 |
| 2’ – показания осциллографа V’, Вольт; | 0,40 |
| 3 – показания амперметра I, Ампер; | 0,020 |
| 3’ – показания осциллографа, I’, Ампер; | 0,01978 |
| 4 – расход энергии (P=VxIxτ/60), Втч; | 0,228 |
| 4’ – расход энергии (P’=V’xI’x τ/60) Втч; | 0,0081 |
| 5 – продолжительность работы электролизёра, отключенного от сети, за шесть циклов, мин | 6x50=300,0 |
| 6 – изменение массы раствора m, грамм | 0,60 |
| 7 – масса испарившейся воды m’, грамм | 0,06 |
| 8 – масса воды, перешедшей в газы, m’’=m-m’, г. | 0,54 |
| 9 – расход энергии на грамм воды, перешедшей в газы, по показаниям вольтметра и амперметра E=P/m’’, Втч/грамм воды; | 0,420 |
| 9’ – расход энергии на грамм воды, перешедшей в газы, по показаниям осциллографа E’=P’/m’’, Втч/г; | 0,015 |
| 10 –существующий расход энергии на грамм воды, переходящей в газы E’’, Втч/гр. воды | 5,25 |
| 11 – уменьшение расхода энергии на получение водорода из воды по показаниям вольтметра и амперметра K= E’’/ P, раз; | 23,03 |
| 11’ – уменьшение расхода энергии на получение водорода из воды по показаниям осциллографа K’= E’’/ P’, раз; | 648,15 |
| 12- количество выделившегося водорода ΔМ=0,54x1,23x0,09=0,06, грамм | 0,06 |
| 13 - энергосодержание полученного водорода (W=0,06х142/3,6) =2,36, Втч | 2,36 |
| 14-энергетическая эффективность процесса электролиза воды по показаниям вольтметра и амперметра ( Wх100/ P), %; | 10 35, 1 |
| 14’ - энергетическая эффективность процесса электролиза воды по показаниям осциллографа ( Wх100/ P’), %; | 29135,80 |
Процесс генерирования газов легко наблюдается по выходу образующихся пузырьков. Они продолжают выделяться и после отключения электролизера от сети. Конечно, после отключения электролизера от сети интенсивность выхода газов уменьшается, но не прекращается в течение многих часов. Это убедительно доказывает тот факт, что электролиз идет за счет разности потенциалов на электродах.
Выделение газов после отключения электролизера от сети в течение длительного времени доказывает тот факт, что формирование молекул кислорода и водорода идет без электронов, испускаемых катодом, то есть за счет электронов самой молекулы воды.
5.6. Вода, как источник электрической энергии
Начальные сведения
Теоретические и экспериментальные исследования показывают, что вода является источником не только тепловой энергии и энергии, заключенной в водороде и кислороде, но и источником электрической энергии. Вспомним мощь грозовых разрядов. Они являются источником электрической энергии, генерируемой из воды в облаках. Теперь можно сказать, что мы вплотную приблизились к моделированию и управлению этими разрядами в лабораторных условиях.
Структуру молекулы воды с полным набором электронов названа нами заряженной структурой (рис. 50). Существуют возможности формирования молекулы воды не с десятью электронами (рис. 73) , а с восемью (рис. 74).
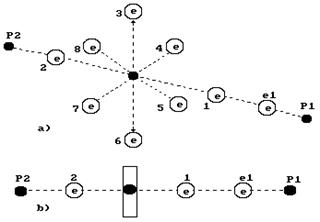
Рис. 73. Схема полу заряженной молекулы воды
Если молекула воды потеряет два электрона, то она станет разряженной (рис. 70).
Главные различия между заряженной (рис. 50) и разряженной (рис. 74) молекулами воды заключаются в том, что в ячейках первого и второго (осевых) электронов атома кислорода заряженной молекулы воды находятся по два спаренных электрона, а в разряженной молекуле воды в этих ячейках располагаются по одному электрону и поэтому у нас есть основания назвать их не спаренные электроны (рис. 74).
Когда спаренные электроны расположены только на одном конце оси атома кислорода, то такую модель назовем полу заряженной (рис. 73, справа).
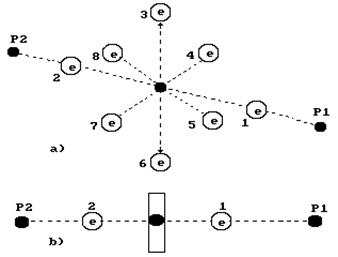
Рис. 74. Схема разряженной модели молекулы воды
Если гипотеза о разном количестве электронов в молекулах воды подтвердится, то этот факт окажется решающим при получении избыточной энергии при электролизе воды. Он определит причину положительных и отрицательных результатов многочисленных экспериментов, которые ставились для проверки факта существования дополнительной энергии при электролизе воды и явлениях её кавитации. Если вода содержит больше заряженных молекул, то эксперимент даст положительный результат. При большем количестве разряженных молекул результат будет отрицательный. Примерные расчеты показывают наличие разницы в массе одного литра заряженной и разряженной воды. Её можно зафиксировать современными измерительными приборами.
Факт разного количества электронов в молекуле воды имеет экспериментальное подтверждение. Оказалось, что при многократном проходе раствора щёлочи через плазмоэлектролитический реактор в растворе накапливается значительный электрический потенциал.
Количество кулонов электричества, которое генерируется в одном литре воды при потере каждой молекулой воды лишь одного электрона, будет равно произведению числа Авагадро на количество молей молекул воды в одном литре [32]
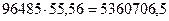 Кулонов. (98)
Кулонов. (98)
Учитывая, что один ампер-час составляет 3600 кулонов электричества, находим минимальную электрическую ёмкость одного литра воды
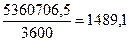 Ач. (99)
Ач. (99)
Экспериментальные исследования также показывают, что при определенных режимах плазменного электролиза воды в электролитическом растворе формируется электрический потенциал, значительно превышающий потенциал, подводимый к раствору. В результате этого в электролитическом растворе генерируется электрическая энергия, превышающая электрическую энергию, вводимую в раствор [31].
Анализ энергий связи между электронами и протонами атомов водорода в кластере из двух молекул воды (рис. 75) показывает возможность реализации различных вариантов разрыва этих связей. В обычных условиях рвется связь 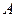 между двумя протонами
между двумя протонами  и
и  , принадлежащих атомам водорода в молекуле воды. Возможен одновременный разрыв связей
, принадлежащих атомам водорода в молекуле воды. Возможен одновременный разрыв связей  и
и  . В последнем случае выделяется молекула водорода. Реализация того или иного вариантов разрыва связей зависит от температуры среды, в которой находятся молекулы воды.
. В последнем случае выделяется молекула водорода. Реализация того или иного вариантов разрыва связей зависит от температуры среды, в которой находятся молекулы воды.
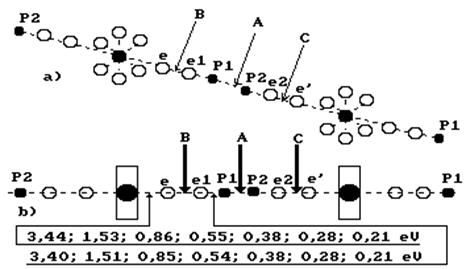
Рис. 75. Схема кластера из двух молекул воды
Если, например, молекулы воды находятся в парообразном состоянии в облаке, то реализация разрыва 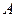 приведет к формированию в облике положительно заряженных молекул воды. В другом облаке, с другой температурой, возможен разрыв связей
приведет к формированию в облике положительно заряженных молекул воды. В другом облаке, с другой температурой, возможен разрыв связей 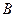 или
или 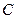 и формирование в облаке отрицательно заряженных и ионов
и формирование в облаке отрицательно заряженных и ионов 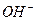 , из которых формируется водород, кислород и озон в процессе грозового разряда.
, из которых формируется водород, кислород и озон в процессе грозового разряда.
Поскольку реализация того или иного варианта разрыва связей зависит от температуры, то, зная энергии связей, мы сможем моделировать этот процесс и использовать его для получения электрической энергии из воды.
5.7. Эффективность топливных элементов
Наши исследования показывают, возможность значительного уменьшения затрат энергии на получение водорода из воды. Это позволит использовать водород и кислород, получаемый из воды для получения электрической энергии.
Сейчас считается, что основным потребителем водорода будут топливные элементы. Обусловлено это тем, что в результате экологически чистого процесса соединения водорода с кислородом в топливном элементе получается самая распространенная экологически чистая электрическая энергия. Главная проблема в этом деле – высокая стоимость топливных элементов.
Стоимость 1 кВт мощности, производимой топливным элементом более тыс. долл. Стоимость же 1 кВт мощности, производимой бензиновым эквивалентом, – 3-5 долларов. Это – главная причина, сдерживающая переход на водородную энергетику на данном этапе её освоения. В целом, достижения в области разработки топливных элементов значительны.
Ячейка топливного элемента представляет собой (рис. 76) ёмкость с двумя электродами и разделительной мембраной, на которую нанесён катализатор (платина). К одному электроду подаётся водород, а к другому – кислород. Катализатор разделяет молекулы водорода на электроны и протоны. Протоны проникают через мембрану в ту половину ёмкости, где находится кислород, а электроны идут в электрическую сеть, соединенную с кислородным электродом. Здесь электроны и протоны вновь соединяются и образуют атомы водорода, которые соединяются с кислородом и образуют воду.
Чем больше катализатор разделит атомов водорода на протоны и электроны, тем эффективнее идет процесс синтеза электрической энергии. Однако, расчеты показывают (мы уже привели их), что современные катализаторы разделяют на электроны и протоны лишь около 0,6 % атомов водорода. Фактически это и есть прямой коэффициент полезного действия топливного элемента.
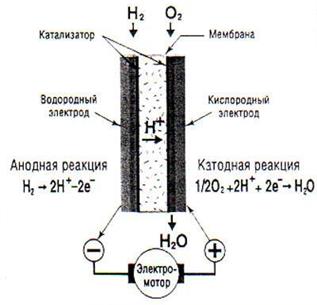
Рис. 76. Схема работы твёрдотопливного элемента
Однако, разработчики топливных элементов определяют коэффициент полезного действия топливного элемента по другому. Они делят энергию, получаемую с помощью водорода на энергию, затрачиваемую при получении водорода из воды. В этом случае получается косвенный коэффициент полезного действия топливного элемента; он достигает 70% и более. Конечно, это неплохой показатель, но надо иметь в виду, что 99,4% атомов водорода в этом случае не участвуют в формировании электрического тока. Из этого следует важная задача разработчиков топливных элементов – увеличение их прямого коэффициента полезного действия
Эффективность процесса соединения водорода с кислородом в топливном элементе и - формирования электрической энергии изучены слабо. В докладе [26] приводятся характеристики одного из топливных элементов. При расходе водорода 2кг/час он генерирует 30 кВтч электрической энергии. Поскольку один кубический метр газообразного водорода весит 90 г., то в 2 кг жидкого водорода содержится 2/0,09=22,2 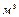 газообразного водорода. Учитывая, что для получения 1
газообразного водорода. Учитывая, что для получения 1 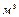 водорода лучшие промышленные электролизёры расходуют 4 кВтч и принимая эту величину энергии за 100%, получаем энергетический коэффициент полезного действия (КПД) топливного элемента
водорода лучшие промышленные электролизёры расходуют 4 кВтч и принимая эту величину энергии за 100%, получаем энергетический коэффициент полезного действия (КПД) топливного элемента
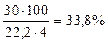 . (100)
. (100)
В источнике информации [27] сообщается, что КПД топливных элементов третьего поколения с твердым электролитом близок к 50% и что использование технологии топливных элементов позволяет повысить КПД по электроэнергии до 75%, а с учетом вырабатываемого ими тепла - до 90-95% [32].
Обратим внимание на факт, который остаётся незамеченным специалистами по топливным элементам. Эффективность топливных элементов зависит, прежде всего, от эффективности использования электрических возможностей самого водорода. Если учесть количество электронов, принадлежащих атомам водорода и участвующих в формировании электрической энергии топливного элемента, то эффективность физико-химического процесса этого элемента оказывается менее 1%. Проведем этот расчет для топливного элемента, описанного в докладе [26]. Он генерирует 30кВтч электроэнергии при расходе 2 кг (2/0,09=22,2 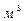 ) жидкого водорода в час. Поскольку моль газообразного водорода равен 22,4 литрам, то для выработки 30 кВтч электрической энергии надо израсходовать 22222,22/22,4=992,06 молей молекулярного водорода [32].
) жидкого водорода в час. Поскольку моль газообразного водорода равен 22,4 литрам, то для выработки 30 кВтч электрической энергии надо израсходовать 22222,22/22,4=992,06 молей молекулярного водорода [32].
Напомним, что числом Фарадея 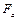 называется величина, равная произведению числа Авагадро
называется величина, равная произведению числа Авагадро 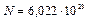 на заряд электрона
на заряд электрона 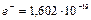 . Измеряется эта величина в Кулонах (Кл) на один моль вещества
. Измеряется эта величина в Кулонах (Кл) на один моль вещества
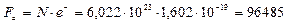 Кл/моль. (101)
Кл/моль. (101)
Если все протоны 992,06 молей молекулярного водорода передадут свои электроны в электрическую сеть топливного элемента, то в результате сформируется 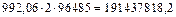 Кулонов электричества. Это потенциальные возможности 22,2
Кулонов электричества. Это потенциальные возможности 22,2 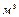 молекулярного водорода. Как же используются эти возможности современными топливными элементами?
молекулярного водорода. Как же используются эти возможности современными топливными элементами?
Рассматриваемый топливный элемент работает при напряжении 100 Вольт, поэтому при выработке 30кВтч в его электрической цепи циркулирует ток 30000/100=300 Ач. При 1 Ампер-часе расходуются 3600 Кулонов электричества, а при 300Ач - 1080000,0 Кулонов. Если потенциальное количество Кулонов электричества, содержащихся в 22,2 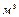 водорода (191437818,2 Кулонов), взять за 100%, то реальное количество Кулонов электричества, генерируемое топливным элементом, составит [32]
водорода (191437818,2 Кулонов), взять за 100%, то реальное количество Кулонов электричества, генерируемое топливным элементом, составит [32]
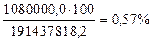 . (102)
. (102)








