Иммуноглобулины и антитела
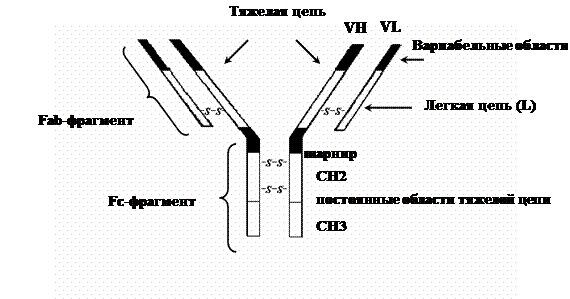
Иммуноглобулины (антитела) – это большое семейство белков, которые синтезируются В-лимфоцитами и плазматическими клетками. Иммуноглобулины находятся в крови и при электрофорезе сыворотки крови они образуют фракцию g-глобулинов. Часть особых иммуноглобулинов – секреторных – присутствует во всех секретах, продуцируемых слизистыми оболочками (слезная жидкость, слизь носа, бронхов, кишечника, половых органов). В структуре иммуноглобулиновой молекулы различают 2 тяжелые (H – heavy) и 2 легкие (L – light) полипептидные цепи, соединенные между собою дисульфидными связями. Тяжелые цепи определяют принадлежность иммуноглобулинов к соответствующему классу: IgG – тяжелая цепь – g, IgA – a, IgM – m, IgD – d, IgE – e (рис. 1.4).



|
| |||||
 | ||||||
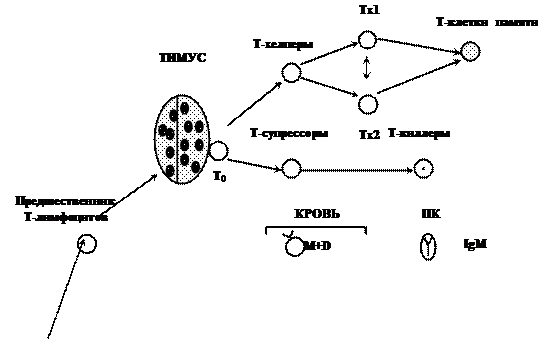
Рис. 1.3. Этапы развития клеток, принимающих участие
в иммунном ответе
В цепях молекулы иммуноглобулинов различают константные (constant) и вариабельные (variable) участки.
Отдельные замкнутые в виде глобул части цепей иммуноглобулина получили название доменов. В константном участке различают CL, СН1, СН2 и СН3 домены, а в IgM и IgE и СН4 домены, в V-участке – VH и VL домены (в зависимости от цепи).
Гипервариабельные участки, где часты замены аминокислот, относятся к регионам, определяющим комплементарность иммуноглобулиновых молекул. Эти регионы локализованы в доменах тяжелой (VH) и легкой (VL) цепей. Они формируют активный центр молекулы иммуноглобулина (антитела).
Между СН1 и СН2 доменами тяжелой цепи локализуется подвижный – "шарнирный" участок молекулы иммуноглобулина, чувствительный к протеолитическим ферментам (папаину, пепсину, трипсину). Под действием папаина молекула иммуноглобулина расщепляется на 2 Fab-фрагмента (fragment antigen binding – фрагмент, связывающий антиген) и Fc-фрагмент (fragment crystallizable – фрагмент кристаллизующийся).
Когда молекула Ig связывает антиген, CН2 домен Fc-фрагмента иммуноглобулина активирует комплемент по классическому пути, а СH3 домен может связываться с Fc-рецепторами, имеющимися на лейкоцитах и других клетках.
Иммуноглобулины класса G составляют основную массу иммуноглобулинов сыворотки крови (75-85%) – 10 г/л (8-12 г/л). Они неоднородны по строению Fс-фрагмента и различают их четыре субкласса: G1, G2, G3, G4.
Снижение уровня IgG в крови обозначается как гипогаммаглобулинемия IgG, увеличение – гипергаммаглобулинемия IgG.
Основную массу антител против бактерий, их токсинов и вирусов составляют IgG.
Иммуноглобулины класса М (м.м. 950 кДа) содержатся в сыворотке крови в концентрации от 0.8 до 1.5 г/л, в среднем – 1 г/л. В крови они находятся в виде пентамеров. Антитела IgM синтезируются в организме при первичном иммунном ответе, низкоаффинны, но высокоавидны из-за большого числа активных центров.
Иммуноглобулины класса А (от 1,5 до 3 г/л) IgA в крови присутствуют в виде мономеров, а в секретах в форме димеров и тримеров. Секреторные IgA (sIgA), будучи антителами, формируют местный иммунитет, препятствуют адгезии микроорганизмов к эпителию слизистых оболочек, опсонируют микробные клетки, усиливают фагоцитоз.
Иммуноглобулины класса D содержатся в сыворотке крови в концентрации 0,03-0,04 г/л. Они служат рецепторами созревающих В-лимфоцитов.
Иммуноглобулины класса Е присутствуют в сыворотке крови в концентрации около 0,00005 г/л или от 0 до 100 МЕ/мл (1 МЕ ~ 2,4 нг). При аллергии их содержание в крови увеличивается и многие из них специфичны к аллергену, т.е. являются антителами.
 | |||
| |||
Рис. 1.4. Структура молекулы иммуноглобулина G
Различают естественные и иммунные антитела. Естественные АТ находятся в организме без предварительного введения антигена (иммунизации). Примером таких АТ являются a- и b-изогемагглютинины сыворотки крови человека I группы, направленные против А и В антигенов эритроцитов людей других групп крови (II-IV) – это чаще антитела класса IgM. Встречаются естественные антитела против микробов.
Иммунные АТ накапливаются и выявляются в сыворотке крови после предварительной иммунизации антигенами.
Механизм действия антител:
Þнейтрализация активных центров токсинов (токсиннейтрализующий эффект);
Þобразование комплекса антиген-антитело, который активирует комплемент с последующим лизисом клетки (литический эффект при участии комплемента);
Þопсонизация объектов фагоцитоза (усиление фагоцитоза);
Þсвязывание с Fc-рецепторами лейкоцитов, которые приобретают способность специфично взаимодействовать с антигенами ("вооружающий" эффект антител);
Þантирецепторные антитела, связываясь с соответствующим рецептором, блокируют его или стимулируют функцию клетки (блокирующие и стимулирующие эффекты);
Þантитела обладают собственной медленной ферментативной активностью и могут расщеплять некоторые субстраты (абзимная активность).
Бивалентные АТ (обычно класса G), имеющие 2 активных центра, получили название полных АТ. Наряду с ними существуют моновалентные неполные АТ, у которых действует один связывающий активный центр из-за пространственной блокировки второго центра.
Сила связывания (сродство) одного активного центра АТ с эпитопом антигена получила название аффинности (аффинитета). Прочность связывания всей иммуноглобулиновой молекулы с антигеном называется авидностью (авидитетом). Обычно она прогрессивно увеличивается с увеличением количества активных центров в иммуноглобулиновой молекуле. Отсюда наибольшей авидностью обладают IgM.
При иммунизации антигеном в сыворотке крови появляется широкий спектр АТ с различной аффинностью. Это обусловлено тем, что антиген стимулирует большое количество клонов В-клеток. Получаемые таким образом поликлональные иммунные антитела и сыворотки представляют смесь иммуноглобулиновых молекул различных классов.
Иммунные комплексы образуются при взаимодействии активных центров (паратопов) антител и детерминант (эпитопов) антигенов в нейтральной среде (рН 7,2-7,3) за счет связей Ван-дер-Ваальса (нековалентная связь – наименьший энергетически выгодный радиус между атомами), водородных (атомы водорода в составе функциональных групп), электростатических и гидрофобных.
Взаимодействия антител и антигенов вызывают феномены агглютинации, преципитации и лизиса. Иммунные комплексы активируют комплемент по классическому пути, связывая его С1q компонент СН2 доменом Fc-фрагмента IgG или IgM. Если эти Ig-антитела направлены против антигенов мембраны клетки, то она при этом лизируется (см. «комплемент»).








