Механічні та фізичні властивості
Основні фізичні і механічні властивості найпоширеніших металів приведені в таблиці.
| Метали | Густина,ρ, кг/м3 | Температура плавлення, °C | Температура кипіння, °C | Границя міцності, σв, МПа | Відносне видовження,δ, % | Твердість,HB | Лінійний коефіцієнт теплового розширення, α, при 20 °C (10−6/°C) |
| Залізо | 7860 | 1539 | 2380 | 300 | 21...55 | 50...70 | 11,5 |
| Алюміній | 2700 | 660 | 2500 | 80...110 | 40 | 20...30 | 23,1 |
| Мідь | 8930 | 1083 | 2600 | 220 | 60 | 35 | 16,5 |
| Магній | 1740 | 651 | 1103 | 170...200 | 10...12 | 25...30 | 25,7 |
| Нікель | 8900 | 1455 | 3080 | 400...500 | 40 | 60 | 13,9 |
| Титан | 4500 | 1665 | 3260 | 300...550 | 20...30 | 100 | 1,2 |
| Молібден | 10200 | 2620 | 4800 | 800...1200 | 46 | 150...160 | 5,8...6,2 |
Усі метали (за винятком ртуті) при звичайних умовах є кристалічними речовинами. Їхні атоми розташовані в певному геометричному порядку і утворюють просторовукристалічну ґратку. У вузлах кристалічної ґратки містяться іони металів. Валентні електрони дуже слабо зв'язані з атомами і можуть легко переміщатися по всьому об'єму металу, переходячи від одних іонів до інших.
Легкою рухливістю валентних електронів пояснюється висока електропровідність і теплопровідність металів. На відміну від розчинів і розплавів при проходженні електричного струму через металічний провідник переносу частинок речовини не відбувається. Метали мають електронну електропровідність. За електропровідністю і теплопровідністю метали розміщуються в однаковому порядку. Найкращими провідниками електричного струму є срібло, мідь, золото і алюміній.
Характерна особливість металів — металічний блиск, тобто здатність добре відбивати світло. Але ця здатність проявляється лише тоді, коли метал утворює суцільну і гладку (поліровану) поверхню.
Дуже важливою властивістю більшості металів є пластичність, тобто здатність змінювати зовнішню форму при дії сторонньої сили і зберігати набуту форму після припинення впливу зовнішньої дії. На цій здатності базуються різні способи механічної обробки металів: прокатка, кування, штамповка, волочіння тощо. Однак ця властивість у різних металів виявляється не однаково. Здатність розкатуватись у тоненькі листи і витягуватись у тоненький дріт найкраще виявляється у золота, срібла, міді, алюмінію і олова, трохи гірше в заліза і цинку. Деякі метали зовсім не виявляють пластичності, вони дуже крихкі — це бісмут, манган і особливо стибій (сурма). При ударі вони розпадаються на шматочки.
За густиною метали умовно поділяють на легкі (густина яких менша 5 г/см3) і важкі (густина яких більша 5 г/см3). До найлегших металів належать літій, калій і натрій. Легкі метали — манган, алюміній і титан. Найважчими вважаються ртуть, золото, платина і осмій.
За твердістю метали теж дуже відрізняються один від одного. Найтвердішим металом є хром, який дряпає скло. За ним іде вольфрам, нікель і ін. До найм'якших металів належать калій і натрій, які легко ріжуться ножем. Дуже м'яким є також свинець. (Див. таблиця густин речовин; таблиця відносної твердості речовин)
За температурами плавлення метали теж різко відрізняються один від одного. Найнижчу температуру плавлення має ртуть (—39°С), за нею йде цезій (28,5 °C), рубідій(38,5 °C), калій (62,3 °C), а найвищу — вольфрам (3410 °C). (Див. таблиця температур плавлення речовин)
За забарвленням метали умовно поділяють на чорні — залізо, манган та їх чисельні сплави (чавун, сталь) і кольорові, до яких відносять усі інші метали. Відповідно до цього і промисловість, яка їх добуває, називають чорною і кольоровою металургією.
Хімічні властивості
Характерною особливістю металів є здатність їх атомів віддавати свої валентні електрони і утворювати позитивно заряджені іони. На відміну від неметалів метали негативно заряджених іонів не утворюють. Отже, вільні метали є відновниками. Чим легше даний метал віддає свої валентні електрони, тим він активніший відновник. За хімічною активністю метали можна розподілити на три групи: сильно активні — калій, натрій, барій, кальцій і ін., середньої активності — цинк, залізо, нікель тощо і мало активні — срібло, золото і платина. Відносну активність металів можна визначити за положенням елемента в періодичній системі Д. І. Менделєєва: металічний характер елементів і хімічна активність металів посилюється в періодах справа наліво, а в головних підгрупах - згори донизу. Типові металічні елементи перебувають у лівому нижньому куті довгого варіанта періодичної системи. Це францій, цезій, радій.
Сильно активні метали з киснем повітря енергійно взаємодіють вже при звичайній температурі, утворюючи оксиди, наприклад:
§ 2Ca + O2 = 2CaO
Тому лужні і лужноземельні метали зберігають під шаром гасу, щоб запобігти їх окисненню киснем повітря. Метали середньої активності окиснюються киснем повітря лише з поверхні, покриваючись тонкою оксидною плівкою, яка запобігає дальшому окисненню металу. Наприклад:
§ 2Zn + O2 = 2ZnO
Але при високій температурі вони енергійно взаємодіють з киснем і перетворюються в оксиди.
Малоактивні (благородні) метали з киснем безпосередньо не реагують взагалі. Більшість металів може безпосередньо реагувати з сіркою, хлором і майже з усіма неметалами, особливо при високій температурі. З водою сильно активні (лужні і лужноземельні) метали взаємодіють вже при звичайній температурі з виділенням водню і утворенням розчинних гідроксидів (лугів), наприклад:
§ 2Na + 2H2O = 2NaOH + H2 ↑
§ Ba + 2H2O = Ba(OH)2 + H2 ↑
Метали середньої активності, наприклад залізо, реагують з водою (водяною парою) лише при сильному розжаренні:
§ 3Fe + 4H2O = Fe3O4 + 4H2 ↑
Мало активні метали з водою не реагують ні при яких умовах. Відношення металів до кислот визначається їх місцем в електрохімічному ряду напруг (ряду активності). Усі метали, що займають місце в ряду напруг лівіше від водню взаємодіють з кислотами з утворенням солі і виділенням водню (з нітратної кислоти водень не виділяється!) Метали, що займають місце в ряду напруг правіше від водню, водню з кислот не витісняють. Але деякі з них можуть реагувати з концентрованою сульфатною кислотою при нагріванні з утворенням солі і виділенням діоксиду сірки SO2, наприклад:
§ Cu + 2H2SO4 = CuSO4 + 2H2O + SO2 ↑
Що ж стосується нітратної кислоти, то при взаємодії її з усіма металами, незалежно від їх місця в ряду напруг, водень з HNO3 не виділяється, а утворюються оксиди азоту і сіль металу.
Наприклад:
§ 3Zn + 2HNO3 + 6HNO3 = 3Zn(NO3)2 + 2NO ↑ + 4H2O
§ 3Ag + HNO3 + 3HNO3 = 3AgNO3 + NO ↑ + 2H2O
Метали в природі
Метали складають понад 80% усіх хімічних елементів. Переважна більшість металів зустрічається в природі у вигляді різних сполук і лише деякі з них — у вільному стані. Це так звані самородні метали (золото і платина), а також інколи срібло, ртуть, мідь і інші метали.
Мінерали і гірські породи, придатні для добування з них металів заводським способом, називаються рудами. Важливішими рудами є оксиди (Fe2O3, Fe3O4, Al2O3 • nH2O, MnO2 тощо); сульфіди (ZnS, PbS, Cu2S, HgS і ін.), солі (NaCl, KCl, MgCl2 CaCO3 і т. д.). Малоактивні метали зустрічаються переважно у вигляді оксидів і сульфідів, а активні (лужні і лужноземельні) — винятково у вигляді солей.
Одержання металів з руд
В більшості випадків руди містять різні домішки у вигляді піску, глини, вапняку тощо. Ці домішки називають пустою породою. Коли в руді багато пустої породи, тобто коли руда є бідною на корисну речовину, таку руду піддають збагаченню, тобто видаляють з неї частину пустої породи. Різні руди збагачують різними способами.
Для збагачення сульфідних руд звичайно застосовують спосіб флотації (спливання). При цьому способі руду розмелюють у тонкий порошок і заливають у великих чанах водою. До води додають певні органічні речовини (наприклад, соснове масло, вищі жирні кислоти тощо), молекули яких добре адсорбуються частинками сульфідів, і вкривають їх тонкою плівкою, внаслідок чого вони не змочуються водою. Крізь воду продувають повітря, пухирці якого з маслом утворюють піну, а також прилипають до частинок сульфідів, і вони спливають та збираються зверху разом з піною, а змочені водою частинки пустої породи осідають на дно (див. мал. Схема флотаційного апарату). Піну з сульфідами металів зливають з чану і віджимають сульфіди. Так одержують збагачену на корисну речовину руду.

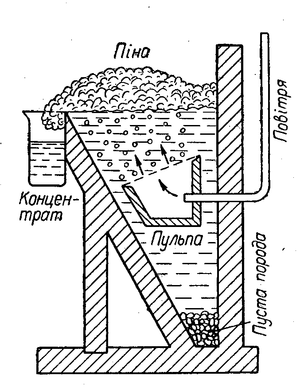
Схема флотаційного апарату
Вільні метали добувають з руд різними способами. З оксидних руд метали одержують відновленням їх при високих температурах. При цьому як відновник частіше всього використовують вугілля (кокс) і монооксид вуглецю СО. Наприклад:
§ Fe2O3 + 3C = 2Fe + 3CO ↑
§ Fe2O3 + 3CO = 2Fe + 3CO2 ↑
§ SnO2 + C = Sn + CO2 ↑
§ 2Cu2O + C = 4Cu + CO2 ↑
Інколи відновником служать активні метали. Наприклад, при добуванні хрому, берилію, мангану і ін. як відновник застосовують алюміній (алюмінотермія):
§ Cr2O3 + 2Al = 2Cr + Al2O3
§ 3MnO2 + 4Al = 3Mn + 2Al2O3
У деяких випадках як відновник використовують водень, зокрема при добуванні молібдену, вольфраму, порошкоподібного заліза тощо:
§ Fe2O3 + 3H2 = 2Fe + 3H2O
§ WO3 + 3H2 = W + 3H2O
Сульфідні руди спочатку обпалюють, переводячи їх в оксиди металів, які потім відновлюють. Наприклад:
§ 2PbS + 3O2 = 2PbO + 2SO2 ↑
§ PbO + C = Pb + CO ↑
Найактивніші метали — калій, натрій, кальцій і ін. — не можна одержати способом хімічного відновлення їх сполук. Ці метали одержують лише електролізом їх розплавлених солей. Наприклад:

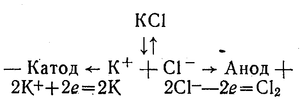
Отримання калію електполізом
Застосування металів
Конструкційні матеріали
Метали і їх сплави — одні з головних конструкційних матеріалів сучасної цивілізації. Це визначається насамперед їх високими міцністю, жорсткістю та іншими механічними властивостями, технологічністю у переробці, відносною доступністю, однорідністю і непроникністю для рідин і газів, стійкістю до температурних впливів та впливів навколишнього середовища. Крім того, змінюючи рецептуру сплавів, можна впливати їх властивості у потрібному напрямку і в дуже широких межах.
Електротехнічні матеріали
Метали використовуються як хороші провідники електрики (мідь, алюміній), так і в якості матеріалів з підвищеним опором, котрі працюють при високих температурах: длярезисторів, реостатів і електронагрівальних елементів (ніхром і т.п.)
Інструментальні матеріали
Метали і їх сплави широко застосовуються для виготовлення інструментів (їх робочої частини). В основному це інструментальні сталі і тверді сплави.
Науки, що вивчають метали
Фізика металів (металофізика) — розділ фізики, який вивчає атомно-кристалічну, дефектну і гетерофазну структури металів і сплавів, їх фізико-хімічні властивості. Вивчає також процеси, що мають місце у металах і сплавах при їх отриманні, механічній і термічній обробці та в умовах експлуатації. Металофізика є теоретичною основою металознавства.
Металознавство — наука, що вивчає взаємозв'язки складу, будови та властивостей металів і сплавів, а також закономірності їх зміни при теплових, механічних, фізико-хімічних та інших видах впливу. Металознавство є науковою основою пошуку складу, способів отримання і обробки металевих матеріалів з різноманітними механічними, фізичними і хімічними властивостями.
Література
§ Деркач Ф. А. «Хімія» Л. 1968
§ Металознавство: Підручник / О. М. Бялік, B. C. Черненко, В. М. Писаренко, Ю. Н. Москаленко - 2-ге вид., перероб. і доп. - К.: ІВЦ "Видавництво «Політехніка»",2008 - 384 с.
§ Гуляев А. П. Металловедение. – М.: Металлургия, 1986. – 542 с.
§ Уманский Я. С., Скачков Ю. А. Физика металлов.- М: Атомиздат, 1978. - 405 с.








