Характеристика химического элемента " P".
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА РФ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ
ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ОБРАЗОВАНИЯ
"ОРЛОВСКИЙ ГОСУДАРСТВЕННЫЙ АГРАРНЫЙ УНИВЕРСИТЕТ
ИМЕНИ Н.В.ПАРАХИНА"
Домашняя контрольная работа по дисциплине "Химия"
на тему :
Характеристика химического элемента " P".
Выполнил:
Студент 1 курса
Инженерно-строительного института
группы СБ-171(2)
Бабанков Сергей.
Проверил:
Доцент,к.с./х.н.
Воронкова Марина Владимировна
План
1. Положение элемента в ПС(порядковый номер, период, группа, подгруппа).
2.Строение атома (Заряд ядра и его состав - количество протонов, нейтронов, число электронов в атоме, изотопы, структура электронной оболочки , электронно-графическая формула, валентность в стационарном и возбужденном состояниях.) Тип элемента( электронное семейство)
3.Основные химические свойства элемента( уравнения реакций взаимодействия с простыми и сложными веществами)
4.Нахождение в природе. Способы получения.
5. Роль элемента и его соединений в природе, сельском хозяйстве, строительстве.
1.Фосфор — химический элемент 15 порядкового номера (по устаревшей классификации — главной подгруппы пятой группы) третьего периода периодической системы Д. И. Менделеева; имеет атомный номер 15.
2. Атом фосфора состоит из положительно заряженного ядра (+15), внутри которого есть 15 протонов и 16 нейтронов, а вокруг, по трем орбитам движутся 15 электронов
Распределение электронов по орбиталям выглядит следующим образом:
+15 P)2)8)5;
1s22s22p63s23p3.
Внешний энергетический уровень атома фосфора содержит 5 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
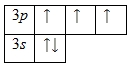
Каждый валентный электрон атома фосфора можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l(орбитальное), ml (магнитное) и s (спиновое):
| Подуровень | n | l | ml | s |
| s | 3 | 0 | 0 | +1/2 |
| s | 3 | 0 | 0 | -1/2 |
| p | 3 | 1 | -1 | +1/2 |
| p | 3 | 1 | 0 | +1/2 |
| p | 3 | 1 | 1 | +1/2 |
Наличие трех неспаренных электронов свидетельствует о том, что степень окисления фосфора равна +3. Так как на третьем уровне есть вакантные орбитали 3d-подуровня, то для атома фосфора характерно наличие возбужденного состояния:
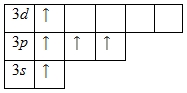
Именно поэтому для фосфора также характерна степень окисления +5.
Электронно-графическая формула: 1s2 2s2 2p6 3s2 3p3
У атома фосфора есть свободные d– орбитали, поэтому для фосфора характерновозбуждённое состояние, когда 3s2 электроны распариваются и валентность принимает значение V
3. Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность снижается. Белый фосфор в воздухе при окислении кислородом воздуха при комнатной температуре излучает видимый свет, свечение обусловлено фотоэмиссионной реакцией окисления фосфора.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.








