Определение коэффициента карбонатности горных пород
Одним из основных факторов, определяющих эффективность кислотных обработок скважин, является детальное представление о химическом и минералогическом составе и коллекторских свойствах призабойной зоны скважины. Определение карбонатности проводится для выяснения возможности проведения солянокислотной обработки скважин с целью увеличения проницаемости призабойной зоны, а также для определения химического состава горных пород. Соляная кислота взаимодействует с известняками и доломитами. Образующиеся продукты реакции удаляются вместе с раствором прореагировавшей кислоты, так как хлориды кальция и магния растворимы в воде, а диоксид углерода – газ.
Для известняка:
СаСО3 + 2HCl = CaCl2 + H2O + CO2
Аналогично для доломитов.
Под карбонатностью пород понимают содержание в них солей угольной кислоты: поташа К2СО3 , сидерита FеСО3 , известняка СаСО3 .
Коэффициент карбонатности – отношение массы карбонатов, содержащихся в образце, к массе образца.
Описание установки
Экспериментальная установка для определения карбонатности горных пород газометрическим способом состоит из следующих основных узлов (см. рис.4.1.):
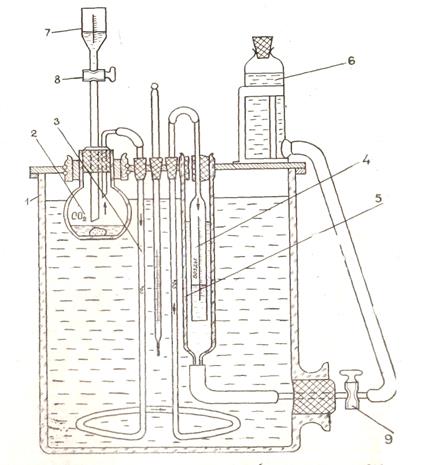
Рис.4.1. Схема установки для определения карбонатности горных пород
1 - термостат
2 – реакционная колба
3 – змеевик
4 – бюретка, градуированная по 0,2 см3
5 – цилиндр
6 – уравнительная склянка
7 – бюретка для соляной кислоты
8 – сливной кран,
9 – кран.
Порядок проведения работы
1. Замеряется барометрическое давление.
2. Фиксируется температура в термостате.
3. Концентрические трубки 4 и 5 заполняются водой из склянки 6 так, чтобы вода в кольцевом пространстве и во внутренней трубке находились на одном уровне.
4. Отмечают уровень воды в бюретке 4.
5. Образец породы высушивают при температуре 105 - 107о С до постоянной массы.
6. Керн тщательно растирают в ступе до получения порошкообразного состояния.
7. Берется навеска порошка (примерно 0,5 г)
8. Навеска высыпается в колбу 2, которая тщательно закрывается пробкой.
9. При закрытом кране 8 в бюретку 7 наливают соляную кислоту.
10. Отмечают уровень кислоты в бюретке 7.
11. Кран 8 быстро открывается часть соляной кислоты (достаточная, чтобы прикрыть весь порошок) наливается в колбу 2.
12. Кран 8 закрывается.
13. Отмечают уровень кислоты в бюретке 7.
14. Выделяющийся углекислый газ по змеевику 3 поступает в бюретку 4, вытесняя из нее воду в кольцевое пространство. Для выравнивания уровней воды в кольцевом пространстве и в бюретке склянку 6 опускают, после чего кран 9 открывают до выравнивания уровней. Эту операцию повторяют до тех пор, пока не прекратится выделение углекислого газа.
15. Отмечают уровень воды в бюретке 4.
16. Все измеренные величины приводятся к единой системе единиц СИ и заносятся в таблицу 4.1.
Таблица 4.1
| Наименование величины | Обозначение | Результат |
| Масса взятого образца (порошка) | М | |
| Уровень воды в бюретке 4 до опыта | Vв1 | |
| Уровень воды в бюретке 4 после опыта | Vв2 | |
| Уровень кислоты в бюретке 7 до опыта | Vк1 | |
| Уровень кислоты в бюретке 7 после опыта | Vк2 | |
| Барометрическое давление | Ра | |
| Температура в термостате | t | |
| Плотность углекислого газа* | ρ | |
| Коэффициент карбонатности | k |
* - определяется по таблице в Приложении
Обработка полученных результатов
1. Количество кислоты Vк , введенной в колбу определяется по разнице уровней до и после опыта:
Vк= Vк2 -Vк1
2. Разница уровней воды в бюретке 4 до и после опыта V равна объему выделившегося углекислого газа Vсо2и количеству введенной кислоты Vк: V= Vв2 –Vв1
3. Объем выделившегося углекислого газа Vсо2:
Vсо2 =V –Vк
4. Коэффициент карбонатности в пересчете на СаСО3 по найденному объему СО2 рассчитывается по формуле:
k= 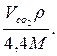
Лабораторная работа 5








