Верхний ларингеальный нерв. Блокаду выполняют от места проекции рога подъязычной кости или от щитовидного хряща (рис. 8.2).
Точку на коже отмечают на 1 см медиальное проекции верхнего отростка подъязычной кости. Несколько сдвинув полоску кожи, иглу размером 25G проводят до соприкосновения с большим рогом подъязычной кости. Затем иглу поворачивают от кости в каудальном направлении и проходят через щитоподъязычную мембрану.
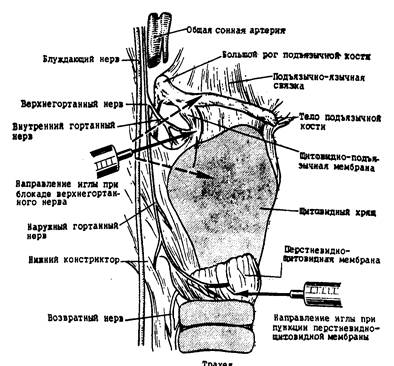
Рис. 8.2. Направление иглы при регионарной анестезии подсвязочного пространства
По второй методике после местной анестезии кожи иглу вводят к верхнему отростку щитовидного хряща, проходя через щитоподъязьгчную мембрану. Убедившись, что в шприц поступает воздух, вводят 2 мл 2%-го раствора лидокаина. Процедуру выполняют с двух сторон.
Возвратный ларингеальный нерв может быть заблокирован транстрахеальным доступом. Иглу размером 25G вводят по срединной линии, через крикотириовдную мембрану в просвет трахеи, что должно быть подтверждено аспирацией воздуха. Затем вводят 2 мл 2%-го раствора лидокаина и немедленно удаляют иглу.
После введения анесгетика пациент начинает кашлять и анестетик распространяется в проксимальном направлении. Дан ный вид анестезии не рекомендуется применять у больных с полным желудком из-за опасности аспирации.
При ларингоскопии в сознании, кроме проводниковой блокады нервов, описанной выше, можно использовать седативные препараты, такие, как мидазолам, пропофол, в комбинации с фентанидом.
Интубация через нос в сознании может быть выполнена только после адекватной анестезии местными анестетиками как местно, так и регионарно.
Перед интубацией необходимо использовать седативные препараты.
Хорошо увлажненную ЭТТ осторожно продвигают в носоглотку.
Глубокие резонансные дыхательные шумы обычно свидетельствуют о том, что ЭТТ находится над входом в трахею. Можно использовать улучшенную позицию для интубации («человек, вдыхающий утренний воздух»).
Об удачной интубации судят по отсутствию фонации у пациента, наличию дыхательных шумов при вентиляции и наличию капнограммы.
Осложнения
Те же, что и для оротрахеальной интубации.
Интубация со светящимся проводником
Используется специальный гибкий волоконно-оптический проводник, по которому ЭТТ может быть вслепую установлена в трахею.
Интубацию проводят в затемненной операционной. ЭТТ надевается на проводник, который затем вводится в ротовую полость, глотку и гортань. Правильность постановки проводника определяют по светящемуся пятну на передней поверхности шеи. Если пятна нет, значит, проводник находится в пищеводе. Наличие светового пятна на передней поверхности шеи свидетельствует о нахождении проводника в трахее. После этого интубационную трубку сдвигают в трахею, как с обычного проводника.
Интубация с фибробронхоскопом
Гибкий фиброоптический бронхоскоп состоит из специальных стекловолокон, по которым передаются свет и изображение. Рабочий канал фибробронхоскопа можно использовать для введения местных анестетиков, подачи кислорода или для отсасывания слизи, крови и т.д. из трахеи. Чтобы видимость через бронхоскоп была хорошей, конец брохоскопа перед работой помещают в теплую воду или силикон. Поток кислорода в 10— 15 л/мин позволяет защитить оптику от слизи, секрета и т.д. Стандартное оборудование:
— Мундштук.
— Воздуховод (Ovassapian).
— Местные анестетики.
— Отсос.
— Фибробронхоскоп с источником света.
Показания
Гибкий фиброоптический бронхоскоп может быть использован как у пациентов, находящихся в сознании, так и под наркозом, для диагностики и интубации трахеи. Может быть использован и для интубации через нос и через рот. Должен использоваться при предполагаемой трудной интубации в первую очередь, а не как «последняя надежда».
Как предмет выбора фиброопгическая ишубация должна быть применена у больных с установленным или предполагаемым повреждением шейного отдела позвоночника, у больных с опухолями головы и шеи, при ожирении или в случае известной или предполагаемой трудности при вентиляции и интубации.
Техника
ЭТТ надевается на бронхоскоп, к рабочему каналу подсоединяется кислород, правой рукой контролируют положение и продвижение фиброскопа, а левой манипулируют им. При продвижении фибробронхоскопа в ротовую полость необходимо следить за тем, чтобы бронхоскоп шел строго по средней линии, чтобы не попасть в периформную ямку. Конец бронхоскопа после прохождения нижнего отдела шотки переводят в переднею позицию и продвигают к надгортаннику.
После прохождения надгортанника, голосовых связок и верификации колец трахеи конец бронхоскопа устанавливают в нейтральную позицию. После этого ингубационную трубку сдвигают с фиброскопа в трахею.
При большом сопротивлении ингубационную трубку следует повернуть на 180° против часовой стрелки — для облегчения прохождения через голосовые связки и контакта с передней комиссурой.
Ретроградная интубация трахеи
Показания
Данная техника применяется в том случае, если вышеописанные методики оказались безуспешными. Данная техника применима у пациентов, находящихся в сознании и на самостоятельном дыхании.
Техника
После местной и проводниковой анестезии дыхательных путей (как описано выше) крикотиреоидная мембрана пунктируется в/в катетером размером 18G по средней линии. По катетеру в ротовую полость проводят 80 см металлический проводник диаметром 0,025 дюйма или эпидураль-ный катетер. В/в катетер удаляют, металлический проводник или эпидуральный катетер больной или выплевывает сам, или при помощи ларингоскопа его выводят из ротовой полости, и по нему продвигают интубационную трубку за голосовую щель.
Обеспечение проходимости дыхательных путей в экстренной ситуации
Чрескожная игольчатая крикотиреотомия
Выполняется путем установки в/в катетера размером 14G или 7,5F интродъюссера через крикотиреоидную мембрану в просвет трахеи. Кислород подается через соединения 3 мм адаптера ЭТТ непосредственно с в/в катетером или через соединение 8,5 мм адаптера ЭТТ с корпусом 2 мл шприца, а затем с в/в катетером. После установки катетера за ним необходимо постоянное наблюдение, так как смещение катетера может привести к баротравме, обширной эмфиземе шеи и передней поверхности грудной клетки и потере проходимости дыхательных путей.
Через катетер может быть осуществлена оксигенация с потоком 10—12 л/мин, но не вентиляция. Это — временное средство, и оно абсолютно противопоказано при полной обструкции верхних дыхательных путей, так как может привести к баротравме.
Некоторое подобие струйной вентиляции может быть осуществлено при использовании кнопки экстренной подачи кислорода, когда подача кислорода осуществляется в течение 1 с, а спонтанный выдох — в течение 2—3 с. При наличии соответствующей аппаратуры возможно проведение высокочастотной ИВЛ.
Осложнения
Могут включать тканевую энфизему, баротравму и пневмоторакс. Так как верхние дыхательные пути не «защищены», возможна аспирация желудочного содержимого.
Крикотиреотомия
Это быстрый, простой и безопасный метод при обструкции верхних дыхательных путей. При разогнутой шее по средней линии в области крикотиреоидной мембраны делается поперечный разрез скальпелем. Ручка скальпеля используется для от-сепаровки мягких тканей и расширения щели до постановки трахеостомической или шпубационной трубки.
Регидная бронхоскопия
Необходима для обеспечения проходимости дыхательных путей при инородных телах трахеи, при травматическом повреждении трахеи, при стенозах. Очень важно иметь под рукой все размеры жестких бронхоскопов (включая детский). Для индукции на самостоятельном дыхании рекомендуется использовать ингаляционные анестетики.
Трахеостомия
Выполняется под местной анестезией перед вводным наркозом у больных с заранее известной трудной интубацией трахеи.
Техника
Разрез обычно выполняется по третьему или четвертому кольцу трахеи. Это требует очень внимательного рассечения сосудов, нервов и перешейка щитовидной железы.
Осложнения
Включают кровотечение, ложный ход, пневмоторакс.
Специальные дополнения
Быстрая последовательная индукция
Показания
Больные, недавно принимавшие пищу (полный желудок), беременные, больные с высокой кишечной непроходимостью, больные с высокой степенью ожирения или с симптоматическим рефлюксом.
Техника
Оборудование, необходимое для быстрой последовательной индукции:
— работающий отсос;
— различные типы и размеры клинков ларингоскопов (Макинтош и Миллер);
— различные ЭТТ на проводниках, включая на один размер меньше чем в норме.
Ассистент (сестра-анестезистка), который может выполнить прием Селика (давление на перстневидный хрящ).
Пациент преоксигенируется большим потоком 100%-го кислорода в течение 3—5 мин (денитрогенизация). Если нет времени, то четыре вдоха, по объему равные полной жизненной емкости легких, приводят к такому же результату.
Во время введения гипнотика (тиопентал, пропофол, кетамин) и деполяризующего миорелаксанта ассистент выполняет прием Селика. Данный прием позволяет предотвратить пассивную регурппацию, уменьшить вентиляцию желудка при вентиляции маской, а также улучшает обзор голосовых связок за счет смещения их в заднем направлении. Однако этот прием не предотвращает регургигации при рвоте.
По возможности нужно отказаться от вентиляции пациента маской. Интубация трахеи должна выполняться за 30—60 сек. Прием Селика вьшолняется до тех пор, пока не будет верифицирована правильная постановка эндотрахеальной трубки.
Если интубация неуспешна, то прием Селика вьшолняется на протяжении всех последующих попыток интубации и при вентиляции маской 100%-ным кислородом.
Замена интубационной трубки
Иногда необходима замена интубационной трубки у больных, интубация которых представляла те или иные сложности. Как правило, это необходимо из-за повреждения манжетки и невозможности выполнения тампонады полости рта.
Санируется ротовая полость и глотка. Пациент оксигениру-ется 100%-ным кислородом.
По старой интубационной трубке мягкий проводник проводится в трахею. Старая интубационная трубка удаляется, а новая по проводнику заводится в трахею. Проводник удаляется. Альтернативной методикой может служить ишубация при помощи бронхоскопа. Новая интубационная трубка надевается на бронхоскоп, который затем вдоль старой ингубационной трубки проводится за голосовые связки. Манжетка на старой трубке сдувается, и бронхоскоп проводится в трахею до момента определения хрящевых колец трахеи для верификации позиции. Старая трубка удаляется, а новая устанавливается в трахею так же, как описано ранее.
НЕКОТОРЫЕ ОСЛОЖНЕНИЯ, СВЯЗАННЫЕ С ОБЕСПЕЧЕНИЕМ ПРОХОДИМОСТИ ДЫХАТЕЛЬНЫХ ПУТЕЙ
Ключ к успеху лежит в тщательном предоперационном осмотре, знании алгоритма действия, возможности прибегнуть к посторонней помощи и в наличии современного оборудования.
Таблица 8.1
Алгоритм действий анестезиолога при неудачной интубации
| Проблема | Метод решения |
| Первая попытка интубации неудачна | Продолжить вентиляцию маской до следующей попытки интубации (например, при помощи бронхоскопа) |
| Все попытки неудачны | Пациент должен быть пробужден |
| Предыдущее невозможно из-за невозможности отменить хирургическую операцию (экстренное Кесарево сечение) | Должна быть продолжена вентиляция маской с применением приема Селика |
| Вентиляция маской затруднена или невозможна | Обеспечить оксигенацию путем постановки ларингеальной маски. Если несмотря на прилагаемые усилия насыщение гемоглобина кислородом у пациента снижается, то необходимо немедленно провести чрескожную игольчатую крикотиреотомию или хирургическую крикотиреотомию |
Ларингоспазм
Наиболее частой причиной ларингоспазма является раздражение рефлексогенных зон ротоглотки, трахеи или бронхов в условиях поверхностной анестезии. Это может быть в результате попытки итубации или попадания секрета, крови, желудочного содержимого или инородного тела. Способствуют развитию ларингоспазма гипоксия, гиперкапния и ацидоз. Рефлекторное смыкание голосовых связок вызывает появление «стридерозного» дыхания. При полной обструкции анестезиолог не в состоянии вентилировать пациента.
Терапия
— переход на ингаляцию 100% кислородом;
— введение деполяризующих мышечных релаксантов;
— санация трахеобронхиального дерева;
— углубление анестезии.
Бронхоспазм
Бронхоспазм может быть как проявлением генерализованной реакции организма (бронхиальная астма), так и местного воздействия (как-то: ларингоспазм, реакция на интубацию и т.д.). Бронхоспазм также может быть проявлением анафилактической или анафилактоидной реакции организма на введение того или иного препарата. Кроме того, ряд препаратов (морфин, тубарин, тракриум) могут провоцировать развитие бронхоспазма из-за присущего им гистаминогенного эффекта.
Для бронхоспазма характерно тахипноэ с затрудненным выдохом, при аускультации обнаруживается жесткое дыхание. При возникновении бронхоспазма у пациента, находящегося в наркозе, отмечается резкое увеличение давления на вдохе, увеличение сопротивления и резкое уменьшение комплаенса.
Лечение
— верификация положения ингубационной трубки. Раздражение карины может быть провоцирующим фактором в развитии бронхоспазма;
— углубление анестезии. При этом целесообразно использовать фторотан (галотан), так как последний является весьма эффективным бронходилятатором. При проведении ТВА можно ввести кетамин, так как он также обладает расслабляющим влиянием на мускулатуру бронхов ввиду наличия симпатомиметических свойств. Однако можно использовать барбитураты и пропофол. При гипоксии необходимо увеличить содержание кислорода во вдыхаемой смеси;
— ингаляция бронходилататоров (инсуфляция в дыхательный контур). Инсуфляция препаратов позволяет минимизировать нежелательные эффекты препаратов на систему кровообращения (изадрин, стероидные препараты);
— в/в препараты;
— симпатомиметики стимулируют B2-адренорецепторы и активируют аденилатциклазу в легких. Образовавшийся цАМФ вызывает расслабление гладкой мускулатуры бронхов:
— адреналин, при введении в малых дозах (0,25—1,0 мкг/мин), воздействует преимущественно на (B2-рецепторы и, таким образом, является эффективным брон-ходилататором;
— изопротеренол — неспецифический B-агонист, вызывает тахикардию;
— метилксантины (эуфиллин) — 5 мг/кг каждые 30 мин, затем 0,5—1,0 мг/(кг/ч), но не более 0,5 мг в течение 4 ч. Побочный эффект — тахикардия.
— кортикостероиды (преднизолон — 30—60 мг/кг; дексазон — 4—8 мг/кг; — целестон — 1—2 мг/кг);
— адекватное увлажнение вдыхаемого газа.
Бронхиолоспазм — крайне тяжелое осложнение интраоперационного периода. Развивается мгновенно, чаще всего в виде аллергической реакции во время вводного наркоза.
Симптомы:
— «каменный» мешок. Резко увеличивается давление на вдохе, при попытке перехода на ручную вентиляцию — ощущение, что интубационная трубка окклюзирована;
— тотальный цианоз;
— дыхание в легких не прослушивается.
При бронхиолоспазме очень ограничено время от начала приступа до гипоксической остановки сердца. Как правило, это происходит на 2—5 минуте. Так как анестезиолог редко сталкивается с подобным осложнением, он начинает поиски места окклюзии, переинтубации трахеи, что еще более сокращает время, отведенное на попытку вывести больного из данного состояния.
Алгоритм действия анестезиолога при возникновении бронхиолоспазма:
— немедленный перкуссионный массаж грудной клетки, ритмичное и глубокое сдавление грудной клетки в попытке имитировать дыхание;
— в/в введение высоких доз стероидов (целестон — 2,0— 2,5 мг/кг);
— введение адреналина;
— введение в интубационную трубку растворов муколи-тиков.
Несмотря на своевременность и правильность проводимых мероприятий, смертность чрезвычайно высока и достигает 70—90%.
РОЛЬ РЕГИОНАРНОЙ АНЕСТЕЗИИ
Регионарная анестезия может служить методом выбора у пациентов с заведомо трудной интубацией. Однако серьезные осложнения самой регионарной анестезии (потеря сознания, остановка сердца из-за введения местных анестетиков интрава-зально) могут потребовать интубации трахеи. Нарушение проходимости дыхательных путей может также произойти из-за применения седативных и наркотических препаратов. Успешное использование регионарной анестезии у больных с заведомо трудной интубацией может быть обеспечено за счет использования катетерных техник (продленная регионарная анестезия), тест-доз, незначительных возрастающих доз анестетика для предотвращения возможной интоксикации. Адекватность блока должна проверяться до начала операции, а план «отступления» (в случае развития неадекватности блока во время операции, или в случае, если пациент не может больше находиться в определенной позиции, или если операция затянулась) должен обсуждаться с хирургом и пациентом заранее. Он может включать местную инфильтрационную анестезию, перенос операции на другой день или использование техники интубации в сознании для последующего проведения общей анестезии.
Рекомендуемая литература:
Латто И.П., Роузен М. Трудности при интубации трахеи.—М.: Медицина.—1989.—303 с.
Mallampati S. et al. A clinical sign to predict difficult trachea! intubation: A prospective study//Can. Anaesth. Soc. J.—1985.—V. 32.—№. 4.— Р. 429.
Глава 9
МОНИТОРИНГ
В.В. Лихеанцев
СТАНДАРТЫ МОНИТОРИНГА
Основная задача интраоперационного мониторинга — повышение безопасности во время общей анестезии и постоянный контроль функций, которые могут пострадать в результате проводимой операции или анестезии. Таким образом, условно можно разделить мониторинг на мониторинг безопасности и мониторинг состояния какой-либо системы пациента.
Основная тенденция современного мониторинга — возможно более полный отказ от использования инвазивных методик в том случае, если это идет не в ущерб безопасности больного. В любом случае необходимо стремиться соблюдать баланс между реальной пользой от использования того или иного исследования (тем более инвазивного или сопряженного с использованием громоздкой, дорогостоящей аппаратуры) и опасностью (а также трудозатратами), связанной с его проведением.
Согласно рекомендациям V Всероссийского съезда анестезиологов и реаниматологов (Москва, 1996), признано необходимым контролировать ЭКГ, пульсоксиметрию и проводить автоматическое измерение артериального давления неинвазивным методом во время выполнения любого оперативного вмешательства. Данный шаг следует признать весьма полезным, но недостаточным.
Минимальный объем мониторинга при любом виде общей анестезии должен включать:
— Электрокардиографию с подсчетом ЧСС.
— Пульсоксиметрию.
— Измерение АД неинвазивным методом.
— Термометрию.
— Капнографию с определением содержания СО2 в конце выдоха (EtCO2).
— Содержание кислорода во вдыхаемой смеси (FiO2).
— Контроль (ЧД).
— Минимальный объем мониторинга при проведении регионарной анестезии или общей в анестезии с сохраненным спонтанным дыханием должен состоять из:
— ЭКГ.
— Пульсоксиметрии.
— Измерения АД неинвазивным методом.
— Контроля ЧД.
МОНИТОРИНГ СОСТОЯНИЯ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ
Электрокардиография
Непрерывный контроль ЭКГ проводят всем больным вне зависимости от типа оперативного вмешательства или варианта анестезии для:
— обнаружения аритмий;
— определения ишемии миокарда;
— обнаружения нарушений электролитного баланса крови;
— мониторинга функции кардиостимулятора;
— подсчета ЧСС.
Расположение электродов. Для контроля ЭКГ необходимо иметь как минимум три электрода: два активных и один электрод сравнения («земля»). ЭКГ-сигнал достаточно маломощный (порядка 1 мВ), и поэтому на запись ЭКГ существенное влияние оказывают использование электрокоагулятора, движения больного и т.д. Необходимо по возможности уменьшить сопротивление под электродом, для чего тщательно смазанный электропроводным гелем электрод накладывается на чистую, предварительно обезжиренную кожу.
При работе с трехэлектродным кабелем ЭКГ имеет смысл проводить постоянный мониторинг либо:
— во II стандартном отведении — оптимальное отведение для обнаружения и определения вида аритмий;
— в отведении V5 — для контроля ишемии миокарда, так как именно в этом отведении контролируется наибольшая по объему часть левого желудочка.
Еще более целесообразно мониторировать модифицированное отведение V5. При этом электроды располагают:
— «правая рука» — справа под ключицей;
— «левая рука» — в положении V5;
— «левая нога» — в обычном месте.
У пациентов с заболеваниями сердца имеет смысл проводить мониторинг ЭКГ в двух отведениях одновременно (II стандартном и V5), для чего необходимо иметь пятижильный кабель. Данное расположение электродов позволяет выявить до 80—96% случаев ишемии миокарда, против 75—80% — при использовании только V5, или 18— 33% при использовании только II стандартного отведения. Большинство современных мониторов имеет выбор из двух возможностей анализа ЭКГ:
— «диагностическую» — при этом современный монитор производит автоматический анализ смещения сегмента ST , выявления и анализ аритмий. Недостатком является фильтр с достаточно широкой полосой пропускания (0,05—100 Гц). Анализ смещения сегмента ST во многом зависит от защиты прибора от работы электрокаутера и других электрических помех в операционной. Если еще 5—7 лет назад данный анализ в операционной был практически нереален, то современные мониторы (AS3/TM, Datex, Финляндия) позволяют проводить подобный контроль достаточно надежно и эффективно;
— в «режиме мониторинга» — более узкая полоса пропускания (0,5—100 Гц), а следовательно, большая устойчивость к шумам и более удобно следить за нарушениями ритма.
Измерение артериального давления
Определение артериального давления неинвазивным методом. В настоящее время большинство мониторов оснащено блоком для измерения АД неинвазивным методом. При этом прибор раздувает манжету с запрограммированной врачом периодичностью и измеряет АД осциллометрическим методом. Как правило, точность автоматических приборов сравнима с измерением АД прямым методом.
На точность измерения влияют движения пациента, неправильно выбранный размер манжеты, сдавление манжеты извне. Некоторые приборы имеют режим непрерывного измерения АД, т.е. сразу по окончании измерения цикл повторяется. Данный режим очень удобен во время вводного наркоза или при нестабильной гемодинамике, однако им не следует злоупотреблять, так как слишком длительное измерение АД в подобном режиме приводит к нарушению сначала венозного, а затем и артериального кровообращения конечности.
Обычная кратность измерения АД — 1 раз в 5 мин. Наконец, есть приборы, позволяющие не только измерять АД в непрерывном режиме, но и моделировать на дисплее кривую артериального давления. Данные приборы достаточно хорошо работают при относительно стабильном АД, однако моделированные кривые, по крайней мере пока, могут существенно отличаться от истинных при резких колебаниях давления.
Прямое измерение артериального давления. В ряде случаев, когда есть основания предполагать существенные колебания АД во время операции, имеет смысл избрать метод его прямого измерения. В необходимый набор для измерения АД инвазивным методом входят:
— артериальная канюля. Канюляция артерии может производиться двумя способами: пункционно и путем артериосекции. Для обеспечения доступа используют, как правило, a . radialis :
— электронный датчик прямого измерения АД с одноразовой или многоразовой камерой («домиком») и артериальной магистралью (соединяющей «домик» и канюлю), заполненные стерильным раствором. Датчик предварительно выводится на «О» и калибруется в соответствии с инструкциями к монитору. Промывание датчика производится либо в автоматическом режиме, либо с необходимой кратностью, с тем, чтобы не допустить тромбоза измеряющей магистрали и попадания крови в «домик».
Некоторые правила определения АД инвазивным методом:
— перед постановкой артериальной канюли проводят пробное пережатие лучевой артерии (проба Аллена), с тем, чтобы убедиться, что кровоснабжение кисти сохраняется за счет анастомозов с веточками a . ulnaris ;
— если катетер устанавливают повторно, место пункции следует выбрать проксимальнее предыдущей. Если ранее проводилась артериосекция, имеет смысл использовать для повторной канюляции контрлатеральную конечность;
— для корректного измерения необходимо следить за отсутствием в магистралях воздуха, тромбов, перегибов и т.д. Магистраль не должна быть слишком длинной, чтобы не искажать результатов измерения («демпфированная» кривая);
— датчик измерения АД следует располагать на одном уровне с артерией.
Измерение центрального венозного давления
Измерение центрального венозного давления (ЦВД) производится через катетер, установленный в подключичной или внутренней яремной вене, по правилам, изложенным для измерения инвазивного АД.
Другой метод измерения ЦВД предусматривает соединение с катетером через трех- или двухходовой краник специальной полой измерительной линейки, заполненной стерильным раствором (метод Вальдмана). «0» в данном случае устанавливается по передней подмышечной линии больного, что соответствует уровню правого предсердия. ЦВД определяют по высоте столба жидкости (по закону сообщающихся сосудов).
Измерение давлений в полостях сердца
В ряде случаев стандартный мониторинг безопасности необходимо расширить и производить измерение давлений в легочной артерии (PA — pulmonary artery), включая давление заклинивания легочных капилляров (PCW — pulmonary capillary wedge pressure), правом предсердии (CVP — central vein pressure), правом желудочке (RV — right ventricle), минутного выброса сердца (СО — cardiac output), так называемый полный инвазивный мониторинг.
Для проведения полного инвазивного мониторинга необходимо установить катетер Сван-Ганц. Последний имеет каналы для измерения давлений (два — в легочной артерии и правом предсердии), термистор (для определения минутного выброса сердца). Последние модификации катетера (Baxter, USA; Abbott, USA) имеют дополнительные каналы:
— или оптоволоконный, для измерения насыщения смешанной венозной крови кислородом в режиме on line;
— или термонагреватель — позволяет измерять МОС в режиме on line.
Катетер имеет деления через каждые 10 см.
Показания к полному инвазивному мониторингу
— Пациенты с нарушением насосной функции сердца.
— Пациенты с тяжелой ишемической болезнью сердца.
— Пациенты с тяжельм поражением клапанного аппарата сердца.
— Пациенты с сочетанным заболеванием: ИБС и нарушением проводимости (на фоне которого по данньм ЭКГ трудно установить возникновение ишемии миокарда), например, ИБС на фоне блокады левой ножки пучка Гиса).
— Пациенты, которые нуждаются в пейсмекере интраоперационно (катетер Сван-Ганц, совмещенный с эндокардиальным электродом).
— Пациенты с полиорганной недостаточностью (сепсис, шок, РДС, почечная недостаточность).
— Пациенты, у которых оперативное вмешательство однозначно вызывает серьезные физиологические сдвиги (пациенты с торако-абдоминальной аневризмой или предполагаемой трансплантацией органов).
Полный инвазивный мониторинг позволяет наиболее рано и точно диагностировать нарушения сократимости миокарда, поражение клапанов сердца, аритмию, легочную гипертензию. PCW достаточно четко коррелирует с давлением заполнения левого желудочка, а, следовательно, по его величине можно судить о преднагрузке левого желудочка и волемическом статусе пациента.
Установка катетера Сван-Ганц
Доступом через центральную или крупную периферическую вену под контролем кривой давления по магистрали легочной артерии проводят катетер до правого предсердия и далее до правого желудочка (рис. 9.1).
Появление характерной «желудочковой» кривой с высокими пиками и отсутствием диастолического давления является достоверным признаком нахождения кончика катетера в правом желудочке. Раздувают воздушный баллончик и с током крови стремятся продвинуть катетер в легочную артерию: появление «артериальной» кривой с ясно определяемой диастолой и характерным смещением в зависимости от фазы дыхательного цикла свидетельствует о нахождении катетера в легочной артерии. Катетер продвигают до исчезновения кривой («заклинивание» катетера), после чего удаляют воздух из баллончика и убеждаются, что кривая давления появляется вновь. Повторно раздув баллончик, измеряют PCW.
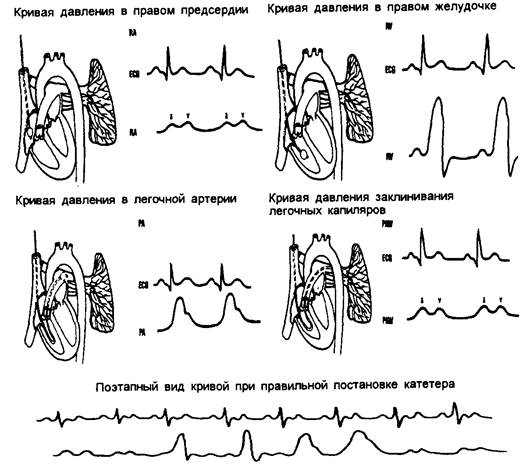
Рис. 9.1. Характерные кривые в зависимости от положения катетера Сван-Ганц в различных полостях сердца
Осложнения катетеризации полостей сердца
1. Аритмия. При прохождении кончика катетера через правое предсердие и правый желудочек могут возникать различного рода нарушения ритма, чаще всего — экстрасистолия. Наиболее вероятно развитие аритмий у лиц с нарушениями сердечного ритма в анамнезе.
При возникновении аритмий целесообразно использовать введение 2%-го раствора лидокаина; у лиц с аритмическим анамнезом лидокаин вводится профилактически.
2. Может наблюдаться преходящая блокада правой ножки пучка Гиса. У пациентов с а.-в. блокадой первой степени или у больных с блокадой левой ножки пучка Гиса проведение катетера может спровоцировать развитие полной поперечной блокады. В этом случае должна быть полная готовность к проведению электрокардиостимуляции одним из вышеописанных способов (наружной или через трансвенозный доступ).
3. Нельзя держать воздушный баллон катетера постоянно раздутым из-за опасности развития пролежня стенки легочной артерии или инфаркта легкого. Раздувать баллон необходимо только на время измерения PCW.
4. Очень редко, но возможно скручивание катетера в полости сердца с образованием узла или подшивание (прошивание) катетера при выполнении операции на сердце.
5. Возможны осложнения, общие с осложнениями при катетеризации центральных вен.
Определение МОС (СО)
Сердечный выброс и сердечный индекс (СИ=МОС/площадь поверхности тела) — одна из ведущих констант организма. только определение СИ (СI) позволяет оценить сократимость миокарда и количественно оценить сердечную недостаточность. Существует несколько способов определения минутного выброса сердца.
Метод Фика. Расчет производится по формуле, компонентами которой являются потребление кислорода и артерио-венозная разность по кислороду.
Метод разведения красителя. Точно известное количество инертного красителя (кардиогрин) вводится в центральную вену, а в артериальной пробе определяется его концентрация. Несложный расчет дает величину МОС.
Имеются приборы с ушным датчиком, которые позволяют регистрировать на бумаге кривую разведения красителя и автоматически рассчитывать величину МОС.
Известным ограничением метода является невозможность частого повторения измерений из-за накопления красителя в крови.
Метод ультразвуковой доплерографии. Датчик, расположенный эндопищеводно и сориентированный на грудную аорту, измеряет линейную скорость кровотока по аорте. Затем на основании антропометрических данных определяется диаметр аорты и производится расчет объемной скорости кровотока. Метод привлекателен ввиду неинвазивности, однако по понятным причинам недостаточно точен.
Метод тетраполярной реографии. Имеет те же преимущества (неинвазивность), но и те же недостатки, что и предыдущий вариант. Ошибка метода чаще всего превышает 20%, что делает измерение, по сути дела, бессмысленным.
Метод прямой флоуметрии. Наиболее точный метод измерения МОС. Однако измерение данным методом можно проводить только при строго ограниченном круге операций и только на определенных этапах, так как необходимо установить датчик электромагнитного флоуметра (точно подобранный по размеру) на корень аорты или легочной артерии. Кстати, на разности показаний датчиков, установленных на корне аорты и легочной артерии одновременно, основан один из методов измерения коронарного кровотока.
Метод термодилюции. Один из самых точных методов, лишенный недостатков флоуметрии. Для проведения измерений необходим катетер Сван-Ганц. Заранее известное количество охлажденного раствора быстро вводится через венозный порт. Термистор, расположенный на конце катетера, регистрирует разность температур и на основании кривой термодилюции рассчитывает величину МОС.
При проведении исследования необходимо помнить о следующих правилах:
— если прибор для измерения МОС не распознает автоматически тип катетера, необходимо выставить на мониторе калибровочное число используемого типа катетера;
— если введено меньшее количество раствора, чем это выставлено на мониторе, результат измерений превысит истинное значение МОС;
— при использовании современных мониторов температура вводимого раствора не имеет значения. Она может стать причиной ошибки, только если термистор перестает регистрировать разницу температур. Например, при использовании слегка подогретого раствора (24—25° С) у пациентов, находящихся в состоянии гипотермии. В этом случае возможна ошибка измерения, или прибор сообщит о возникших проблемах;
— наличие внутренних шунтов в сердце искажает результаты измерения (например, дефект межжелудочковой перегородки);
— быстрое введение неподогретых растворов через центральную вену одновременно с проведением измерения искажает результат последних;
— правильнее проводить измерение МОС в конце выдоха, для чего необходимо отсоединить пациента от ИВЛ на время проведения измерения. Более современные мониторы (ass/tm, Datex, Финляндия) автоматически синхронизируют измерение с концом выдоха. Истинным следует считать средний результат трех последовательных измерений.
Определение МОС в режиме on line
В настоящее время фирмами Baxter (США) и Abbott (США) разработаны и производятся катетеры для непрерывной регистрации сердечного выброса. Спираль, расположенная проксимальнее термистора, подогревает омьшающую кровь. Разность температур до и после подогрева регистрируется прибором. Это значительно расширяет возможности обсуждаемого метода.
Определение REF
Также новой возможностью является измерение фракции выброса правого желудочка (REF — right ejection fraction). Необходимым условием для измерения данной величины является катетер типа Сван-Ганц с термистром с низкой постоянной времени (Fast Termistor) и математической программой наложения ЭКГ на кривую термодилюции. Измерение REF, ценное само по себе, позволяет определить и конечно-диастолический объем (КДО), и КД1 (КДО/ППТ) правого желудочка. Последний показатель, равный в норме 105—115 мл/м2, является прямьил методом контроля воле-мического статуса пациента. Данная возможность реализована в настоящее время в приборах фирмы АВВОТТ («Оксиметрик», США), Baxter («Explorer», США), Datex ASS/тм (Финляндия).
МОНИТОРИНГ ДЫХАНИЯ
Пульсоксиметрия
Система дыхания, включая внешнее дыхание и систему транспорта кислорода, является, наряду с сердечно-сосудистой системой, наиболее важной для поддержания жизнедеятельности организма. После газообмена в легких кислород переносится тканям в связанном с гемоглобином виде и в виде растворенного в плазме. Вклад последнего в общий транспорт кислорода минимален, что очевидно из следующей формулы:
CaО2= [(l,37)-(Hb)х(SaO2)] + [(0,003)-(РаО2)],
где 1,37 — количество мл кислорода, связанного с полностью оксигенированной молекулой гемоглобина;
Hb — концентрация гемоглобина (г/дл);
SaO2 — насьпцение артериальной крови кислородом;
0,003 — константа растворимости кислорода в плазме;
РаO2 — парциальное давление кислорода в плазме крови. В этой связи представляется чрезвычайно важным мониторировать насыщение кислородом гемоглобина артериальной крови. Методом, позволяющим производить подобные измерения в режиме on line, является пульсоксиметрия. Метод основан на разном поглощении света оксигемоглобином в видимом красном и инфракрасном диапазонах. Свет, излучаемый двумя светодиодами, попадает на сенсор, проходя через капиллярное ложе (чаще всего ногтевая фаланга или мочка уха). Количество света, попадающее на сенсор, зависит от:
— пульсовой волны, так как во время систолы поглощение возрастает в обоих диапазонах вследствие увеличения количества крови в капиллярном русле, а, следовательно, и количества гемоглобина;
— изменения концентрации гемоглобина или оксигемоглобина, что, собственно, и регистрирует метод.
Следует помнить, что измерение возможно только во время пульсирующего кровотока, что позволяет проводить пуль-соксиметрию именно артериальной крови. Однако с указанным свойством связаны и некоторые ограничения, например, пуль-соксиметр не работает при плохой микроциркуляции (шок, сепсис, глубокая гиповолемия, гипотермия, искусственное кровообращение). Кроме того, все пульсоксиметры калиброваны эмпирически (на добровольцах), и потому точность измерения при насыщении ниже 70% резко снижается.
Возможные причины снижения сатурации
Пациент
— низкая FiO2;
— неадекватная вентиляция;
— плохая микроциркуляция (см. выше);
— появление патологического гемоглобина (метгемоглобин, карбоксигемоглобин, сульфгемоглобин);
— введение красителя (кардиогрин, метиленовый синий);
— венозны застой;
— отсутствие пульсирующего кровотока (искусственное кровообращение);
— движения пациента.
Монитор
— электрическая интерференция (работа электрокаутера);
— наличие добавочных источников инфракрасного излучения (для устранения можно накрыть датчик пульсоксиметра непрозрачным материалом — салфеткой, простыней и т.д.);
— технические дефекты датчика или кабеля.
Непрерывное определение насыщения крови кислородом
В настоящее время выпускаются катетеры, снабженные оптоволоконным каналом, позволяющие определять насыщение кислородом крови в том месте сосудистого русла, где установлен катетер. Одновременное проведение пульсо-ксиметрии и оксиметрии смешанной венозной крови позволяет рассчитать основные показатели кислородтранспортной функции крови и мониторировать их в режиме on line. Таким образом, появилась возможность оценить соотношение транспорта и потребления кислорода в реальном масштабе времени. Ценность подобной опции для практики анестезиолога трудно переоценить.
Пока невозможно предположить все области анестезиологии-реаниматологии, где может найти применение указанный метод. Однако уже сейчас он используется для:
— контроля гипоксии мозга во время операций на сонных артериях. Катетер устанавливается во внутреннюю яремную вену);
— оценки степени реперфузии тканей после снятия зажима с аорты при протезировании аорты и ее ветвей.
Капнометрия
Исследование содержания углекислого газа в конце выдоха (EtCO2) производится при любом виде анестезии, в том числе и для контроля правильности интубации трахеи, правильности выбора параметров ИВЛ и для обнаружения некоторых патологических состояний: злокачественной гипертермии, эмболии легочной артерии. Как правило, значения EtCO2 на несколько мм рт. ст. ниже соответствующих значений артериальной крови и довольно точно коррелируют с ними при большинстве клинических ситуаций. В то же время внутрилегочное шунтирование крови, значительное увеличение мертвого пространства и колебания легочного кровотока могут изменить артериальную разницу в конце выдоха таким образом, что EtCО2 перестанет точно отражать изменения РаСО^. В указанных случаях необходим контроль газового состава артериальной крови.
Значительно расширяет диагностические возможности капнометрии регистрация кривых содержания СО2 (рис. 9.2).
Капнография позволяет выявить следующие состояния:
— негерметичность контура;
— неисправность клапана вдоха или вьщоха;
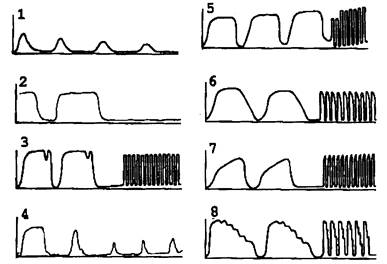
Рис. 9.2. Некоторые капнограммы, часто встречающиеся в практической работе:
1 — быстро убывающая кривая, характерная для ошибочной интубации пищевода; 2 — разгерметизация дыхательного контура; 3 — регулярные падения в конце конечно-экспираторного плато, характерные для гипервентиляции или для пациентов, с восстановлением нервно-мышечной проводимости; 4 — изменение формы капнограммы и уменьшение выделения СО; указывает на редукцию кровотока через легкие в результате снижения сердечного выброса; 5 — смещение кривой вверх от изолинии, свидетельствующее о попадании углекислого газа во вдыхаемую смесь (контроль адсорбента); 6 — рестриктивное заболевание легких; 7 — обструктивное заболевание легких; 8 — кардиогенные осцилляции
— неработающий адсорбер;
— обструкцию в дыхательном контуре;
— быстрое нарастание уровня СО2 (является одним из ранних признаков злокачественной гипертермии);
— состояние гипоперфузии — шок;
— эмболию легочной артерии;
— затрудненный выдох (бронхиальная астма, инородное тело, экстрапульмональная компрессия);
— внутрилегочное шунтирование крови;
— адсорбцию углекислоты из брюшной полости во время выполнения лапароскопических вмешательств;
— реперфузию, после снятия турникета с аорты;
— один из ранних признаков восстановления нервно-мышечной проводимости после медикаментозной блокады.
Спирометрия в боковом потоке
В настоящее время ряд мониторов позволяет мониторировать некоторые показатели механики дыхания, используя для анализа минимальные объемы газа из контура пациента — метод, получивший название «Side Stream Spirometry». С помощью указанного метода достаточно точно можно определить:
— податливость, растяжимость (Compliance) легких — значение данного показателя для диагностики рестриктивных заболеваний легких и выраженности РДС-синдрома обсуждалось в соответствующей главе;
— аэродинамическое сопротивление на вдохе — данный показатель весьма эффективно позволяет диагносцировать обструкцию в контуре или дыхательных путях пациента;
— получать на дисплее монитора кривые поток/объем и объем/давление, сравнивать их во времени и таким образом мониторировать механику дыхания (рис. 9.3, 9.4).
Определение FiO2 и концентрации ингаляционных анестетиков
Большинство современных наркозно-дыхательных аппаратов позволяет мониторировать процентное содержание кислорода во вдыхаемой смеси. Это необходимо, так как позволяет контролировать состав газонаркотической смеси и вовремя определить его гипо- и гипероксический характер.
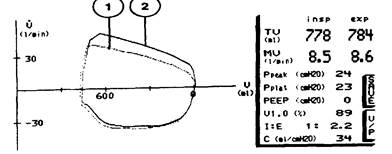
1. интубациояная трубка, диаметром 6 мм.
2 . Иятубационная трубка диаметром 9 мм.
Рис. 9.3. Кривая поток/объем
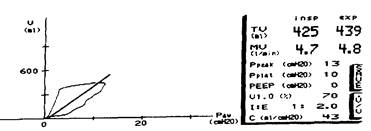
Хороший комплайнс
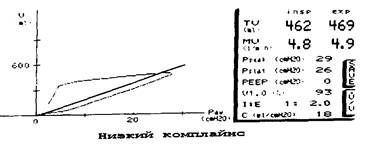
Рис. 9.4. Кривая объем/давление
Непрерывный контроль содержания ингаляционных анестетиков в подаваемой смеси и контуре пациента особенно необходим при проведении ИВЛ по методике Low или Minimum Flow, так как позволяет:
— в начале наркоза определить истинную концентрацию анестетика в контуре, которая может быть существенно ниже, чем концентрация анестетика в подаваемой смеси или той, которая выставлена регулировочной ручкой как желаемая;
— в период поддержания и окончания анестезии, когда складывается обратная ситуация.
Некоторые современные наркозно-дыхательные аппараты (например, ADU, Datex-Engstrom, Финляндия) позволяют сразу рассчитать МАК (минимальную альвеолярную концентрацию), что очень удобно, особенно для начинающего анестезиолога.
ТЕРМОМЕТРИЯ
Термометрия является непременным компонентом современного мониторинга при любом типе оперативного вмешательства. Необходимость в термометрии диктуется следующими обстоятельствами:
— контроль за возникновением злокачественной гипертермии;
— у детей относительно высок индекс площади поверхности тела к массе тела. Мониторинг температуры у данного контингента особенно показан еще и в связи со слабо развитой системой терморегуляции;
— у всех пациентов потеря тепла с открытой раны, переливание инфузионных растворов различной температуры, использование термоматраца (или без него) вызывают необходимость в интраоперационной термометрии.
Для измерения температуры приняты следующие точки:
— кожная температура. Следует иметь в виду, что при длительных операциях температура кожи может быть на 3—4°С ниже внутренней температуры тела;
— в подмышечной впадине. Редко используется для рутинного мониторинга. Может быть на 1°С ниже внутренней температуры тела;
— ректальная температура. Достаточно точно отражает изменения температуры тела и может быть использована для мониторинга во время анестезии;
— температура пищевода. Достаточно точно отражает изменения температуры тела и может быть использована для мониторинга во время анестезии;
— температура в носоглотке. Достаточно точно отражает изменения температуры тела. Наиболее часто используется для мониторинга во время анестезии;
— при наличии катетера Сван-Ганц используют имеющийся термистор для измерения температуры.
— температура наружного слухового прохода. Достаточно точно отражает внутричерепную температуру.
Глава 10
ОБЩАЯ АНЕСТЕЗИЯ
В.В. Лихванцев
В 1996 г. исполнилось 150 лет первому наркозу, проведенному Мортоном в Бостоне эфиром, который, как известно, является парообразующим или ингаляционным анестетиком. Длительные годы вслед за этим эфир оставался практически единственным средством для проведения общей анестезии.
Ситуация коренным образом изменилась после основополагающих работ Де Кастро 50-х годов нынешнего столетия, в которых разрабатывалась теория нейролепсии, или нейролептаналгезии. В результате неоднократных трансформаций и модификаций эта теория привела к созданию современной концепции многокомпонентной сбалансированной анестезии (МСА). Различные варианты МСА: НЛА, атаралгезия, тотальная внутривенная анестезия (ТВА) и т.д. настолько прочно укоренились в нашей стране, что, казалось, напрочь вытеснили саму идею использования летучих анестетиков в практической анестезиологии, может быть, за исключением детской анестезиологии.
Следует отметить, что для этого были определенные основания: ведь единственно доступному в нашей стране ингаляционному анестетику — галотану (фторотану) — инкриминировались следующие недостатки:
— высокая токсичность как для больного, так и для персонала, находящегося в операционной. Действительно, фторотан вызывает дозазависимую депрессию сердечно-сосудистой системы и дыхания, увеличение мозгового кровотока и внутричерепного давления, обладает гепато- и нефротоксичностью;
— кроме того, несовершенная, часто значительно изношенная наркозно-дыхательная аппаратура с негерметичным контуром приводила и приводит к загрязнению операционной отнюдь не безвредными парами галотана.
— недешевый сам по себе, галотан (а тем более эн- и изо-флюран) для точности дозировки требует хороших и дорогих испарителей, которые в нашей стране не производились и не производятся (отечественные испарители для галотана и энфлюрана рассчитаны только на большие газовые потоки, а испарителей для изофлюрана вообще нет).
Вместе с тем в развитых западных странах даже появление нового мощного в/в анестетика дипривана не привело к отказу от ингаляционной анестезии. Так, по данным 1995 г., 65% операций в Германии, 75 — во Франции и 73% — в США проведены в условиях общей ингаляционной анестезии. Это не может не наводить на определенные размышления.
Учитывая, что наиболее прогрессивной методикой МСА признается ТВА на основе дипривана и альфентанила, попробуем сравнить эти препарат и ингаляционные анестетики с так называемым идеальным анестетиком.
Свойства идеального анестетика:
— должен вызывать быструю и комфортабельную индукцию. Здесь определенное преимущество имеют в/в анестетики — диприван и барбитураты. За исключением педиатрии ингаляционные анестетики для вводного наркоза в настоящее время не используются;
— длительность анестезии должна быть легко контролируема. До настоящего времени это значительно легче достигается с помощью ингаляционого анестетика. Лучшее понимание фармакокинетики и фармакодинамики в/в препаратов и проведение TCI (Target Control Infusion — инфузия, контролируемая по «мишени»), может быть, в будущем изменит сложившуюся ситуацию;
— глубина анестезии должна быть легко измеряема и изменяема. Конечно, гораздо легче контролировать глубину анестезии при использование ингаляционных анестетиков, однако быстрее углубить наркоз можно только при использовании в/в препаратов;
— способ введения препарата должен быть максимально прост. По сравнению с ингаляционной анестезией, требующей сложной и дорогостоящей наркозно-дыхательной аппаратуры, испарителя и монитора, способ введения в/в препаратов предельно прост. Это стало особенно очевидно после появления инфузионных насосов и методики TCI;
— препарат по возможности не должен иметь побочных эффектов. К сожалению, как в/в анестетики, так и галогенсодержащие парообразующие препараты обладают побочными эффектами. Так, хорошо известно кардиодепрессивное действие ингаляционных агентов, присущее даже самым современным препаратам, таким, как сево- и дезфлюран. Поэтому они с осторожностью должны использоваться у лиц с гиповолемическим шоком или скомпрометированной сердечно-сосудистой системой. В данном случае методом выбора является использование высоких доз опиовдных аналгетиков. Последние, в свою очередь, вызывают выраженную депрессию дыхания, что может осложнить течение раннего послеоперационного периода;
— у препарата не должно быть токсических метаболитов. Как уже говорилось раньше, распад галотана сопровождался появлением значительного количества токсических метаболитов, приводящих иногда даже к развитию некроза печени. Современные ингаляционные анестетики практически не метаболизируются в организме, а выводятся легкими в неизменном виде. В этой связи риск появления токсичных метаболитов сведен к минимуму и сравним с таковым при применении в/в препаратов (рис. 10.1);
— выведение препарата не должно быть связано с функцией печени или почек. Современные ингаляционные анестетики в неизменном виде выводятся легкими, чего нельзя сказать о в/в препаратах. Элиминация последних в той или иной степени протекает в указанных органах;
— действие препарата должно быть достаточно специфичным. Излишне говорить, что в/в препараты обладают гораздо более выраженной селективностью действия;
— препарат должен обладать достаточной широтой терапевтического действия. Эта проблема более актуальна для в/в анестетиков.
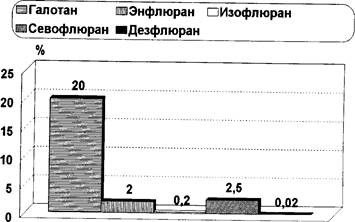
Рис. 10.1. Метаболизм газовых анестетиков в печени
Таким образом, сравнение в/в и ингаляционных анестетиков по меньшей мере свидетельствует о наличии баланса положительных и отрицательных свойств тех и других. Однако если учесть, что сейчас редко кто проводит мононаркоз ингаляционным анестетиком, то можно предположить, что разумное сочетание преимуществ изо-, дез- и севофлюрана с таковыми препаратов группы фентанила может обеспечить максимальный положительный эффект при анестезиологическом обеспечении особенно длительных и травматичных операций.
Действительно, если в «хирургии одного дня» в первую очередь необходимы недорогая аппаратура, комфортность пробуждения, быстрота углубления анестезии и не имеют существенного значения такие факторы, как гарантированная глубина анестезии, отсутствие связи элиминации препарата с функцией печени и почек и т.д., то при обеспечении длительных и травматичных операций ситуация меняется с точностью до наоборот.
Таким образом, при всех преимуществах ТВА на основе дипривана и фентанила в «малой» хирургии, представляется, что анестезиологическое пособие длительных и травматичных операций, по крайней мере, пока, как необходимый компонент, должно включать использование современного парообразующего анестетика. Последнее позволит сделать анестезию более надежной, управляемой и защитит пациента от более чем нежелательного пробуждения во время анестезии или наличия у него сознания на этом этапе.
Глава 11
МНОГОКОМПОНЕНТНАЯ АНЕСТЕЗИЯ
НА ОСНОВЕ ВНУТРИВЕННЫХ ПРЕПАРАТОВ
А.И. Салтанов
Компоненты общей анестезии, используемые для реализации конкретного эффекта, как правило, являются внутривенными препаратами. В англоязычной литературе широкий круг лекарственных средств, применяемых в анестезиологии (гипнотики, аналгетики), называют внутривенными анестетиками ( intravenous anaesthetics ). С их помощью создаются различные схемы общей сбалансированной анестезии ( balanced anaesthesia — ВА) или тотальной внутривенной анестезии ( total intravenous anaesthesia — TIVA ).
Внедрение в современную практику препаратов ультракороткого действия придает внутривенной анестезии все более управляемый характер и в этом плане приближает ее к ингаляционной, чему способствует и техническая разработка инфузионных систем, обеспечивающих максимально точное дозирование лекарственных средств, в том числе с возможностью компьютерного программирования инфузии ( Target controlled infusion — ТС I ).
Практически реализована концепция Prys Roberts (1979) о минимальном уровне инфузии препарата ( minimum infusion rate — MIR ), т.е. о минимальной дозе препарата, способной подавлять двигательную активность у 50% пациентов в ответ на разрез кожи (ЕD50). Эта величина имеет бесспорную аналогию с широко принятой константой, характеризующей активность ингаляционного анестетика — минимальной альвеолярной концентрацией ( minimum alveolar concentration — MAC ).
Важным аспектом современной комбинированной анестезии на основе внутривенных препаратов являются учет и разумное использование их синергических и антагонистических свойств. В современных схемах широко используется принцип не только потенцирования основных свойств лекарственных средств, но и коррекции побочных эффектов. В свое время Р. Janssen точно подобрал соотношения частей дроперидола и фентанила (50:1) с целью взаимной коррекции побочного действия этих препаратов; хорошо известно влияние диазепама на профилактику и коррекцию побочных эффектов кетамина.
В данной главе представлены главным образом новые средства. Некоторые препараты, ставшие традиционными и рутинными в анестезиологической практике и подробно описанные в руководствах и учебниках (тиопентал, гексенал, морфин, фентанил), будут представлены только в аспекте сравнения основных и побочных эффектов с современными средствами общей анестезии. Миорелаксантам посвящена соответствующая глава руководства.
Гипнотики
Большинство препаратов с гипнотическим действием, применяемых в анестезиологии, лишено какой-либо аналгетической активности, за исключением стероидных производных, обладающих слабыми аналгетическими свойствами. Механизм воздействия на ЦНС связан, как правило, с торможением активности ретикулярной формации среднего мозга через систему ГАМК.
Общей тенденцией современной фармакологии стала разработка препаратов ультракороткого действия, обеспечивающих управляемость гипнотического эффекта, отсутствие кумуляции и токсичности, минимальные побочные эффекты, совместимость с другими компонентами общей анестезии. Это достигается появлением в клинической практике новых барбитуратов (метогекситал натрия), небарбитуровых гипнотиков (этомидат, пропофол), бензодиазепинов (флунитрозепам, мидазолам).
Барбитураты
Метогекситал натрия (бриетал, бревиметал) — гипнотик короткого действия, применяющийся как для индукции, так и для проведения кратковременной самостоятельной анестезии. Имеет преимущества перед гексеналом и тиопенталом (более быстрый и плавный гипнотический эффект, пробуждение без остаточной депрессии). Применяется в дозе 1,0—1,5 мг/кг (всего 80—150 мг) для индукции. Создает быстрое наступление гипнотического эффекта, длящегося не более 5—7 мин. По данным некоторых авторов, бриетал в индукционной дозе более 1 мг/кг способен вызвать существенные колебания гемодинамических показателей у больных с выраженной гиповолемией. В связи с этим рекомендуют вводить препарат медленно (1 мл 1%-ного раствора за 5 сек.). При самостоятельном наркозе повторное введение метогекситала натрия осуществляют в дозах 20—40 мг. Препарат может применяться в виде инфузии для поддержания анестезии, однако в современной анестезиологии для этой цели используют, как правило, небарбитуровые гипнотики.
Небарбитуровые гипнотики
Кетамин (калипсол, кетанест) достаточно хорошо известен, хотя этот препарат до сих пор является предметом всестороннего экспериментального и клинического изучения. Синтезирован в 1965 г. Оказывает анестезирующее (наркотизирующее) и аналгетическое действие. Анестезия кетамином получила название «диссоциативной», так как препарат угнетает преимущественно ассоциативные зоны коры и таламуса (В.Д. Машковский, 1993). Существует и другая трактовка термина «диссоциативная анестезия»: имеются в виду торможение одних отделов ЦНС (кора, ретикулярная формация) и возбуждение других (лимбическая система); последнее обусловливает побочные эффекты (в частности, галлюцинации). Метаболизирует путем деметилирования; основная часть метаболитов выделяется с мочой в течение 2 ч (меньшая часть может оставаться в организме несколько дней); кумуляция при многократном введении не наблюдается.
Помимо применения как самостоятельного анестетика (1,5—2 мг/кг в/в), кетамин в последние годы активно включают в различные схемы ТIVА и ВА. Установлено, что минимальная доза при в/в введении, обеспечивающая аналгетический эффект, равна 0,5 мг/кг. Оптимальный аналгетический эффект без побочных явлений наступает при введении 1 мг/кг (или 2 мг/кг/ч инфузионно); повышение дозы усиливает только гипнотический эффект. Длительность действия кетамина дозазависима: при введении 0,5 мг/кг — 2 мин; 1,0 мг/кг — 6 мин; 2,0 мг/кг — 10—15 мин. Соматическую болевую чувствительность снижает сильнее, чем висцеральную. Кетамин является корректором вегетативных (вагусных) проявлений опиатов, в также пропофола (дипривана). В.М. Мизиков с соавт. (1994) стабилизируют индукцию пропофолом, вводя 0,5 мг/кг кетамина. Кетамином дополняют общую анестезию у пациентов с низким исходным АД и (с осторожностью) — при выраженной гиповолемии, а также при низком насыщении крови кислородом, требующем выключения закиси азота.
При использовании в клинических дозах требуется профилактика побочных явлений, а при их развитии — применение корректоров. Подробно описанные в литературе побочные явления (повышение двигательной активности при индукции анестезии и в период выхода из наркоза, галлюцинации, повышение АД, тризм жевательной мускулатуры) корригируются введением диазепама.
Появились работы (Н.А. Adams, 1996) о новом препарате — производном кетамина — S (+)- Kem амин e . Исследование на добровольцах (1 мг/кг в/в) показало, что препарат мало отличается от кетамина (2 мг/кг): увеличивается плазменная концентрация адреналина и норадреналина, АКТГ и кортизола, повышается среднее АД и ЧСС. Пробуждение после введения S(+)-кетамина оказалось более быстрым; остальные клинические показатели сравнимы с таковыми при использовании кетамина.
Альтезин (СТ1341, альфатезин), стероидный гипнотик, обладающий слабым аналгетическим действием. Синтезирован в 1971 г. (Великобритания). Препарат короткого действия с восстановлением сознания через 10—15 мин после введения. Применяется в дозах 0,05—0,075 мл/кг (дозы даются в мл из-за неоднородного состава препарата). Обеспечивает выраженное снижение мышечного тонуса; незначительно снижает АД, увеличивая ЧСС. В дозе 0,1 мл/кг и выше создает кратковременную дыхательную депрессию; при пробуждении могут возникнуть миоклония и повышенная саливация. Один из недостатков — растворитель препарата кремофор EL. Возможно, что малое число публикаций о применении альтезина в последние годы связано с тем, что к веществам, растворителем которых является кремофор (пропанидид, в частности), стали относиться отрицательно из-за непредсказуемости серьезных побочных явлений и грозных осложнений (анафилактический шок).
Сообщено (C.F. MacLeon et al., 1996) о новом стероидном анестетике — эльтанолоне (eitanolon, coreltan) — на основе эмульсии. Препарат с удовлетворительными фармакокинетическими свойствами. При двухчасовом введении эмульсии в дозах 2 и 3,5 мг/кг/ч показатели следующие: клиренс — соответственно 1,39 и 1,21 л/кг; t1/2а — 0,025 и 0,028 ч; t1/2В — 0,66— 0,65 ч; t1/2Y — 5,16—4,38 ч. Препарат вызывал умеренное снижение АД, отмечена хорошая управляемость анестезии, непроизвольные движения не отмечены; пробуждение дозазависимо (A. Wessen et al., 1996).
Данные Н. Oven et al. (1996) свидетельствуют в пользу появления непроизвольных движений под влиянием эльтанолона, снижающиеся под влиянием морфина. Последний увеличивает риск апноэ после введения эльтанолона.
Этомидат (гипномидат, раденаркон) синтезирован в 1965 г. (Бельгия). Применяется для инцукции (0,2—0,3 мг/кг одномоментно или 0,16 мг/кг/ч инфузионно) и как компонент TIVA (гипнотическое состояние поддерживается капельной инфузией этомидата со скоростью 0,005 мг/кг/мин). Это короткодействующий препарат с быстрой индукцией (максимальная концентрация в крови создается через 1 мин после введения) и пробуждением через 4—8 мин с быстрым восстановлением сознания, адекватной ориентацией в месте и времени без неприятных воспоминаний о периоде наркоза и галлюцинаций (хотя и описаны случаи постнаркозной дисфории). Длительность сна зависит от дозы: при введении 0,2 мг/кг сон длится 2—3 мин, 0,3 мг/кг — 4—5 мин. Наблюдение за пациентом, перенесшим наркоз этомвдатом в амбулаторных условиях, не менее 1 ч.
Препарат оказывает минимальное воздействие на дыхание и ЧСС; обладает противоэпилептическим эффектом; не освобождает гистамин, совместим с другими препаратами. Этомидат не предупреждает постингубационную гипертензию; во многих применяемых схемах TIVA перед введением этомидата вводят дроперидол с фентанилом.
Побочные эффекты: преходящее снижение уровня кортико-стероидов (без снижения активности АКТГ); появление непроизвольных движений; боль, жжение в месте инъекции (без явлений флебита); после анестезии возможны кашель, рвота, гипертензия, брадикардия. Препараты-корректоры позволяют нивелировать некоторые побочные эффекты зтомидата.
Так, для профилактики миоклонии в премедикацию целесообразно включить диазепам (можно использовать дроперидол с фентанилом); с целью предупреждения повышения вагусной активности показана дополнительная атропинизация. Серьезное практическое предупреждение: не использовать для пункции тонкие вены!
Накоплен опыт использования этомидата при поддержании общей анестезии (0,1—0,15 мг фракционно в/в через 10 мин) в комбинации с фентанилом при спонтанной вентиляции. Применение этомидата в виде капельной инфузии при длительных и травматичных операциях (в комбинации с высокими дозами опиатов) вызвало определенньш интерес анестезиологов в связи с высокой антистрессорной защитой анестезии. Однако антистрессорную активность можно объяснить снижением функции коры надпочечеников под влиянием этомидата. С другой стороны, отмечено, что при постоянной инфузии этомидата имеет место снижение печеночного артериального кровотока (возможно, за счет дозазависимого снижения СВ и среднего АД). Сочетание этих побочных явлений способно увеличить анестезиологический риск у пациентов при длительной инфузии этомидата. Видимо, с этим связано значительное уменьшение числа публикаций в последние годы о применении этомидата в целях поддержания общей анестезии.
Пропофол (диприван) синтезирован в 1976 г. (Великобритания); в России применяется с 1993 г. Это препарат (2,6-диазопропиленфенол) в виде водно-масляной эмульсии. Липофильность препарата обеспечивает быстрое проникновение в ЦНС (выключение сознания — через 30—40 сек от начала введения, «на кончике иглы»). Быстро выводится из организма, не обладает способностью к кумуляции, метаболизирует в печени. Вызывает местное раздражение, не вызывая некроза (перед введением целесообразно ввести лидокаин в небольшой дозе). Умеренный миорелаксирующий эффект пропофола в сочетании с подавлением рефлексов с гортаноглотки делает удобным применение ларингеальной маски.
Пропофол снижает повышенный мышечный тонус и судорожную готовность (что используется в неврологии и психиатрии). Правильное введение пропофола (титрование по 40 мг каждые 10 сек) предупреждает развитие апноэ. Общая индукционная доза 2,0—2,5 мг/кг.
Умеренная гипотония, развитие которой возможно при введении пропофола, обусловлена снижением общего сосудистого сопротивления, особенно у пожилых.
Имеются экспериментальные данные о возможности блокады кальциевых каналов пропофолом и снижения за счет этого высвобождения норадреналина (N. Rolf, 1996, N.L. Biddle et al., 1996). Снижение ЧСС (ваготонический эффект пропофола) предупреждается и корригируется введением холинолитиков (атропин, метацин).
Отсутствие кумулятивного эффекта позволяет применять пропофол (диприван) для поддержания анестезии любой продолжительности. С целью инфузионного введения Пропофол растворяют в 5%-ном растворе глюкозы и переливают из поливенилхлоридных или стеклянных емкостей. Поддержание возможно и при фракционном введении (болюсы по 50— 25 мг, по мере необходимости).
Зарубежные данные свидетельствуют о широком диапазоне доз пропофола при инфузионном введении — от 4 до 12 мг/кг/ч. Это зависит от многих факторов, включая возраст больных, эффект премедикации, характер вмешательств и потенцирующее влияние других препаратов. Так, расход пропофола снижается при комбинации с фентанилом и суфентанилом; последний, по данным бельгийских авторов (М.Н. Lauvers et al., 1996), проявляет отчетливый синергизм с пропофолом. Было показано, что с возрастом доза пропофола снижалась с 10 мг/кг/ч у молодых пациентов до 8,6 мг/кг/ч у больных старше 65 лет. Влияние интенсивности хирургической агрессии на инфузионную дозу пропофола было доказано на основании различий в концентрациях препарата в плазме при операциях на поверхности тела — 2,97 мг/мл и при абдоминальных вмешательствах — 4,04 мг/мл.
Пропофол (диприван) применяют при кратковременных манипуляциях и оперативных вмешательствах в хирургии «одного дня», при лапароскопических операциях, в сердечно-сосудистой, абдоминальной и торакальной хирургии. В работах отечественных авторов (А.А. Бунятян с соавт., Б.Р. Гельфанд с соавт., С.Ф. Грицук, Г.Г. Жданов, В.Д. Малышев, В.М. Мизиков, Ю.С. Полушин и др.) отражен значительный опыт применения дипривана при различных оперативных вмешательствах. При лапароскопических операциях (В.В. Лихванцев, 1995) индукции анестезии достигают введением дипривана (1,93+0,02 мг/кг) и фентанила (4,34+0,26 мкг/кг); поддерживают анестезию диприваном инфузионно (6 мг/кг/час), фентанилом и N2O (65%). Отмечают хорошую управляемость и достаточную глубину анестезии с быстрым и полным пробуждением, последующим хорошим самочувствием пациентов. И.А. Козлов с соавт. (1995) использовали диприван при малых операциях (имплантации постоянных ЭКС), операциях на сердце без ИК и с ИК, поддерживая анестезию диприваном инфузионно со скоростью 6 мг/кг/час. Н.А. Осипова с соавт. (1996) включает диприван в различные схемы TIVA и ВА при различных вмешательствах в онкологии — от мастэктомии и лимфаденэктомии до полостных операций на желудке и пищеводе.
В схеме ВА (калипсол, фентанил, N2O, миорелаксанты, ИВЛ) инфузию дипривана осуществляют со скоростью 2,1 мг/кг/ч.
Зарубежные данные свидетельствуют о хороших результатах применения пропофола при нейрохирургических вмешательствах (в комбинации с альфентанилом или суфентанилом) — отмечено снижение церебрального метаболизма, отсутствовали эпизоды пшертензии. Поддержание анестезии осуществляется инфузией пропофола при начальной скорости 150—200 мкг/кг/мин с последующим снижением до 100—120 мкг/кг мин.
Позитивные результаты получены при больших торакальных операциях (T.J. Trinder et al., 1996); при сравнении с методикой ВА <сгиопентон/изофлюран» применение комбинации «пропофол/альфентанил» дало удовлетворительные результаты (величина SpO2 в динамике была выше при TIVA). При операциях в кардиоторакальной хирургии (Gao Tean Hua et al., 1996) анестезию поддерживают пропофолом (1,72—4,96 мг/кг/ч) и фентанилом с удовлетворительными результатами. Схожесть гемодинамических профилей при использовании методик анестезии, включающих пропофол или изофлюран, отмечена при операциях ортотопической трансплантации печени (Мога А., 1994; Roige J. et al., 1994).
Американскими специалистами (N.R. Fahmy et al., 1996) установлено, что при длительной инфузии пропофола (0,11+0,003 мг/кг/мин) адренокортикальная функция не подавлена.
В субнаркотических дозах пропофол (диприван) вызывает антиэметический эффект и с успехом используется для профилактики и лечения послеоперационной тошноты и рвоты — синдрома PONV ( post operative nausea and vomiting ). В сравнительных исследованиях пропофол оказался активнее изофлюрана в профилактике PONV (C.D. Brooker et al., 1996).
Постепенно утверждается мнение, что пропофол (диприван) по степени анестезиологической защиты, управляемости и возможности точной дозировки с помощью постоянно совершенствующейся техники становится альтернативой ингаляционным анестетикам — изофлюрану, севофлюрану и дезфлюрану; с последним пропофол сопоставим по времени пробуждения пациентов и опережает изофлюран.
Бензодиазепины
Производные бензодиазепина (БЗД) по клиническому эффекту относятся к транквилизаторам ( tranquilloare , лат. — успокаивать), хотя в более высоких дозах вызывают гипнотический эффект; БЗД активно воздействуют на ГАМК-ергические рецепторы, потенцируя центральное ингибирующее действие у-аминомасляной кислоты. В клетках ЦНС обнаружены специфические «бензодиазепиновые» рецепторы, для которых БЗД являются лигандами.
Специфические БЗД-рецепторы в ЦНС описаны в 1977 г.; вместе с рецепторами ГАМК они образуют единый протеиновый ГАМК-БЗД-СL-канальный комплекс.
Рецепторы представлены во многих органах, включая миокард. БЗД способствуют высвобождению ГАМК и ее влиянию на синаптическую передачу. Нейрофизиологами установлено, что БЗД (в частности, диазепам) подавляют вызванные потенциалы в ответ на электрические и звуковые раздражители в образованиях таламуса и лимбической системы. Имеются данные, что диазепам является антагонистом химических медиаторов в ЦНС (ацетилхолина, серотонина, катехоламинов). Широко применяются для снижения тревоги, при депрессии, истерии, возбуждении, агрессивности и других реактивных состояниях психики; снижает эпилептиформную активность, базальный тонус поперечно-полосатой мускулатуры (за счет угнетения нейронов спинного мозга и полисинаптических проводящих путей супраспи-нальных структур). Первьм бензодиазепином (БЗД), синтезированный в 1956 г., был хлордиазепоксид (либриум), который и в наши дни с успехом применяется как пероральный анксиолитик.
Диазепам (валиум, седуксен, сибазон, реланиум) синтезирован Stembach, Reeder в 1960 г. Как средство медикаментозной подготовки применен впервые во Франции в 1964 г. При приеме внутрь диазепам быстро всасывается из ЖКТ; максимальная концентрация в плазме достигается через 2—4 ч. Выводится в два этапа: первый этап — быстрый, с периодом полувыведения 10 ч (в крови содержится только диазепам), второй — медленный, с периодом полувыведения 2—3 дня (в крови содержится метаболит — а-диметилированный аналог диазепама). При в/в введении время полувьшедения диазепама —30 ч, его метаболита— 100 ч.
Диазепам незначительно влияет на АД и ЧСС. Мнения исследователей в отношении влияния диазепама на дыхание расходятся.
Рекомендуют различные дозы диазепама для индукции — от 0,2 до 0,6 мг/кг, обеспечивающие наступление гипнотического эффекта с последующей ретроградной амнезией. При быстром введении возможно умеренное снижение АД, возвращающееся к исходному уровню через 5—7 мин. Диазепам, включенный в индукцию, предупреждает мышечные фибрипляции и последующие боли в связи с введением сукцинилхолина. Как средство для индукции, а также компонент сбалансированной анестезии, диазепам нашел применение в офтальмологической практике (снижение внутриглазного давления), нейрохирургической и ЛОР-практике (возможность операции в положении сидя), акушерстве (отсутствие влияния на сократимость матки и новорожденного), в амбулаторной стоматологии, при кардиоверсии, различных эндоскопических и кардиологических исследованиях. Как препарат-корректор, диазепам нивелирует побочные эффекты опиатов (снижает частоту тошноты и рвоты), одновременно снижая их расход. Хорошо известны свойства диазепама как корректора побочных эффектов кетамина.
Противопоказания: миастения, первый триместр беременности (в современных аннотациях указывается на осторожность применения), острые заболевания печени и почек. Не следует сочетать с ингибиторами МАО. Алкоголь потенцирует действие диазепама.
Мидазолам (дормикум, флормидал) в клиническую практику введен в начале 80-годов (Великобритания, 1982). Это первый водорастворимый БЗД, имеющий наиболее короткую продолжительность действия. Время полураспределения — 25—30 мин, время полувыведения мидазолама — 1,5—3,0 ч, его метаболитов — <1,5 ч. Мидазолам широко применяется для премедикации (0,05—0,1 мг/кг) и индукции (0,15— 0,2 мг/кг) с аналгетиками. Среднее время наступления гипнотического эффекта составляет немного более 60 сек. Для индукции мидазолам применяют в дозе 0,15—0,2 мг/кг. Мидазолам применяется и в комбинации с пропофолом, главным образом для снижения его дозы. Пробуждение после введения мидазолама быстрое, в этом он даже конкурирует с пропофолом (диприваном). Японские исследователи (Т. Nishijama et al., 1994) показали, что при использовании мидазолама в ответ на интубацию повышения в плазме уровня адреналина и норадреналина не происходит. По данным В.А. Гологорского с соавт. (1994), доза мидазолама 15 мг не влияет на сердечно-сосудистую систему. Шведские анестезиологи (Р. Grattidge, U. Caplsson, 1994) используют малые (субгипнотические) дозы мидазолама (0,06 мг/кг) при гастроскопии. Его широко применяют при выскабливании полости матки (0,07 мг/кг) с фентанилом (3 мкг/кг) при спонтанном дыхании пациенток.
Флюнитрозепам (рогипнол). Применяется для премедикации (0,015—0,03 мг/кг) и индукции. В дозе 2 мг (1мл) в/в вызывает быстрое наступление гипнотического эффекта; оптимальная скорость введения для индукции 1 мг/30 сек. Для поддержания анестезии вводят дробно малые дозы препарата. Для в/в введения требуются вены большого калибра; при введении в артерию возможен некроз. Как и другие БЗД, препарат потенцирует действие нейролептиков, аналгетиков, анестетиков и других средств, угнетающих ЦНС. Как и другие БЗД, флюнитрозепам оказывает анксиолитическое, миорелаксирующее и противосудорожное действие. Связывается с белками плазмы (80%), проникает через плацентарный барьер, выделяется с грудным молоком. Побочные эффекты проявляются в виде незначительного снижения АД, угнетения дыхания, особенно у пожилых.
Противопоказания: абсолютное — miastenia gravis, относительные — первый триместр беременности, лактация. Потенцирует действие миорелаксантов, усиливает угнетающее действие на ЦНС нейролептиков, транквилизаторов и седативных средств. В зарубежной литературе последних лет флюнитрозепам упоминается намного реже мидазолама — препарата, постепенно вытесняющего из схем ВА и TTVA другие бензодиазепиновые производные.
Антагонисты бензодиазепиновых рецепторов. Флумазенил (анексат) — первый специфический антагонист БЗД, синтезированный в 1979 г. и введенный в клиническую практику в начале 80-х годов. Выпускается в виде водного раствора в ампулах (500 мкг в 5мл или 1 мг в 10 мл). Быстро купирует все эффекты БЗД включая амнезию, депрессию дыхания, не приводя к гипертензии (по аналогии с налоксоном). Продолжительность действия при в/в введении зависит от дозы и колеблется от 15 до 140 мин (средняя продолжительность — около 60 мин).
Средняя эффективная доза — 1 мг (рекомендуют начинать с первой дозы 0,2 мг, титруя эффект введением по 0,1 мг с небольшими перерывами). Следует учитывать возврат к так называемой резидуальной седации, которая может произойти при высокой суммарной дозе БЗД, особенно у пожилых больных.
Из многочисленных литературных данных хорошо известно, что антагонистами бензодиазепинов являются и антихолинестеразные препараты (прозерин, физостинмин), что следует учитывать в практике.
АНАЛГЕТИКИ
Рецепторы опиоидов
По современным представлениям, фармакологические эффекты, вызываемые наркотическим аналгетиками, обусловлены взаимодействием со специфическими местами связывания мембран клеток — рецепторами. Первоначально выделялись три типа опиоидных рецепторов: мю-,сигма- и к-, названные так по начальным буквам прототипов их агонистов: морфина, SKF-1047 и кетоциклозацина. Локализация и возможная роль опиатных рецепторов и их агонистов суммированы в табл. 11.1 и 11.2.
В дальнейшем в ЦНС были обнаружены также эпсилон-, дельта- и лямда- рецепторы. Однако возникли некоторые сомнения относительно В-рецепторов, которые сейчас ряд авторов предлагают выделить в отдельную сигмаергическую систему.
По мнению Chang К., Cuatrecacsas (1981), в головном мозге имеются три различные области, характеризующиеся локализацией тех или иных рецепторов опиатов:
1. Отделы мозга, в которых превалируют мю-рецепторы, гипоталамус и таламус.
2. Отделы мозга, в которых имеет место выраженное превалирование мю-рецепторов над дельта-рецепторами, — ствол, гиппокамп, лимбическая система.
Таблица 11.1
Локализация и функция опиоидных рецепторов в ЦНС
| Спинной мозг | Спинальная аналгезия |
| Околоводопроводное вещество | Супраспинальная аиалгезия |
| N.n. solitarius, commissuralis, ambiguus | Регуляция висцеральных рефлексов (депрессия дыхания, ортостатическая гипотония) |
| Медиальное и латеральное оптические ядра | Миоз |
| Лимбическая система | Эйфория |
| Базальное ядро | Регуляция двигательного поведения |
| Locus cerulius | Эйфория |
| Megial eminence | Регуляция нейроэндокринных функций |
Таблица 11.2
Фармакологические эффекты агонистов мю-, к- и сигма- опиоидных рецепторов
| Действие на | мю- | К | сигма |
| зрачок | Миоз | Миоз | Мидриаз |
| ЧД | Стимуляция, затем депрессия | Нет изменений | Стимуляция |
| ЧСС | Брадикардия | Нет изменений | Тахикардия |
| температуру тела | Гипотермия | Нет | Нет |
| аффект | Безразличие к различным стимулам | Седация | Делирий |
| кожную чувствительность (супраспиналь-ные рефлексы) | Снижение | Нет | Нет |
| ноцицептивные рефлексы (спинальные) | Снижение | Повышение | Некоторое снижение |
3. Отделы головного мозга, в которых имеется примерно одинаковое число мю- и дельта-рецепторов, — кора мозга, полосатое тело.
К-рецепторы распределены подобно ц-рецепторам, но их абсолютное число в 2—3 раза меньше.
Эндогенные лиганды опиоидных рецепторов
В настоящее время выделено и идентифицировано свыше 20 эндогенных лигандов опиоидных рецепторов. Установлено, что в организме человека и животных опиоидные пептвды первоначально формируются в виде высокомолекулярного предшественника. Образование собственно нейропептидов происходит в ходе ферментативной фрагментации последнего. Процессинг опиоидных пептвдов протекает в эндоплазматическом ретикулуме, где молекула предшественника продвигается к секреторным гранулам, и под воздействием протеолитических ферментов, в частности трипсиноподобных протеаз, осуществляется фрагментация полипептидной цепи на функционально активные молекулы.
Все опиоидные пептиды в зависимости от белка предшественника можно разделить на три группы, происходящие из:
— проопиомеланокортина: основной представитель — В-эндорфин;
— проэнкефалина А, содержащего в своем составе мет- и лей-энкефалины;
— проэнкефалина В, содержащего динорфин, а-нео-эндорфин и лейморфин.
Фармакология опиатов
Основной эффект, присущий препаратам указанной группы, — аналгезия. Принято считать, что чем выше сродство препарата к т-опиоидным рецепторам, тем более выражены у него свойства аналгетика. В этой связи наркотические аналгетики, в комбинации с другими препаратами, используются в большинстве схем вводного наркоза и поддержания анестезии. В больших дозах наркотические аналгетики могут использоваться как основное вещество для поддержания анестезии (например, в кардиоанестезиологии, так называемая центральная аналгезия).
Механизм действия наркотических аналгетиков связан со специфическим взаимодействием с опиоидньши рецепторами ЦНС и спинного мозга.
Опиаты
Известные побочные эффекты фентанила побудили поиск новых опиатных аналгетиков. Были синтезированы новые препараты (альфентанил, суфентанил, ремифентанил), получившие большое распространение в современных схемах ВА и TTVA. Инфузионный метод введения аналгетиков более эффективен за счет создания постоянной концентрации препарата в крови и экономичен.
Суфентанил — синтетический опиоид, в 5—10 раз мощнее фентанила; терапевтический индекс в 100 раз больше. Период полураспределения — 0,72 мин, период полураспада — 13,7 мин. Почти полностью связывается с белками (92,5%), липофилен. Обладает более быстрым, по сравнению с фентанилом, началом действия. В дозах 10—20 мкг/кг создает надежную ангигипертензивную защиту. Снижает MAC ингаляционных анестетиков более значительно, чем фентанил. Не освобождает гистамин.
У суфентанила (так же как и фентанила) печеночный клиренс превышает печеночный кровоток; при снижении последнего вследствие системной артериальной гипотонии, сердечной недостаточности и заболеваниях печени элиминация альфентанила задерживается. Почки косвенно влияют на элиминацию суфентанила и других опиатов, замедляя ее при заболеваниях за счет нарушения распределения интра- и экстрацеллюлярной жидкости.
Суфентанилу присуще гипноседативное действие; его синергизм по отношению к пропофолу (дипривану) был зарегистрирован S. Schraag et al. (1996) при сравнении суфентанила и альфентанила (в эквипотенциальных дозировках) в отношении индукционной дозы пропофола, который вводили методом титрования до получения эффекта (волны на ЭЭГ с частотой 10 Гц); расход пропофола оказался ниже на фоне действия суфентанила более чем в 2 раза. В исследовании М.Н. Lauwers et al. (1996) при увеличении дозы суфентанила (с 15 до 45 мкг) время потери сознания под влиянием пропофола достоверно снизилось.
Хорошие результаты применения суфентанила получены в нейроанестезиологии. При краниотомии по поводу опухолей расход пропофола оказался ниже при использовании суфентанила (0,4 мкг/кг/ч) по сравнению с применением фентанила и альфентанида (Р. Kessler et al., 1996). Суфентанил показал хорошие результаты у кардиохирургических больных с низкой фракцией выброса (менее 40%) как после интубации трахеи, так и после стернотомии (J.C. D. Pereira et al., 1996); лучше фентанила блокирует ноцицептивные импульсы (O.H.G. Wider-Smith, 1996).
Альфентанил — синтетический опиоид; в 4 раза слабее фентанила, но обладает более быстрьм началом действия и короткой продолжительностью. Клиренс альфентанила снижается, а элиминация удлиняется у больных, получавших эритромицин (R R Barkowski et al., 1990).
Альфентанил успешно применяется при кратковременных операциях. Наиболее удачно сочетание альфентанила с пропофолом (диприваном). В эксперименте показано, что средние дозы не вызывают изменений центральной гемодинамики, в то время как большие (5 мг/кг) приводят к увеличению ЧСС и СВ.
При нейрохирургических операциях применение альфентанила для индукции (10—20 мкг/кг) и поддержания анестезии (инфузионно, начиная со скорости 1,5—2 мкг/кг/мин и снижая до 0,3 мкг/кг/мин) на фоне пропофола показало снижение церебрального метаболизма, отсутствие эпизодов гипертензии (В. van Aken, 1996). N. Baykan et al. (1994) применяют комбинацию альфентанила (0,03 мг/кг/ч) с пропофолом при краниотомии с хорошим эффектом.
Замечательный результат получили R.G. Aquado et al., (1994) при тимэктомии у больных с miasthenia gravis: использовали инфузию альфентанила (1,5 мг/кг/мин) в комбинации с пропофолом («ступенчатая» инфузия от 167 до 50 мкг/кг/мин) без миорелаксантов.
Специальные исследования (A.L. Lindekaer et al., 1994) показали, что сочетание альфентанила с пропофолом (диприваном) в амбулаторной практике не оказывает существенного влияния на психомоторные функции.
Ремифентанил — первый в этом классе опиоид с очень коротким временем полужизни (менее 10 мин) за счет высокой степени эстеразной активности метаболизма, что обусловливает быстрое прекращение действия. Сравнение ремифентанила с альфентанилом в амбулаторной практике (Е Chung, 1996) при инфузионном введении в комбинации с пропофолом показало лучшую гемодинамическую стабильность при использовании ремифентанила в дозе 0,5 мкг/кг/мин. F. Cama et al. (1996) сравнивали аналгетические эффекты ремифентанила и фентанила при больших абдоминальных операциях. В дозе 0,4 мкг/кг/мин ремифентанил оказался эффективнее фентанила; побочные реакции не выявлены. R.J.R. Duthie et al. (1996) вводили ремифентанил инфузионно в дозах от 1,0 до 2,0 мкг/кг/мин с пропофолом при операциях аорто-коронарного шунтирования и в послеоперационный период. Этим же опытом обладает F. Geisler (1996), вводивший ремифентанил с пропофолом по аналогичной методике. Минимальный гипертензивный ответ бьш зафиксирован только во время стернотомии. Авторы считают, что ремифентанил создает глубокую аналгезию, блокирующую ноцицепгивные импульсы, без побочных эффектов.
Опыт клиницистов выделяет очевидные преимущества опиатов, включаемых в схемы ВА и TIVA, особенно на этапе индукции: снижается доза гипнотика, нивелируется реакция сердечно-сосудистой системы на ларингоскопию и интубацию трахеи; последнее очень важно у нейрохирургических больных (профилактика повышения внутричерепного давления) и у пациентов с сопутствующей патологией (гипертоническая болезнь, ИБС).
Некоторые препараты с мю-агонистической активностью имеют в настоящее время менее широкое применение в схемах ВА и TIVA.
Пиритрамид (дипидолор), агонист мю-рецепторов; по аналгетической активности 15 мг дипидолора эквивалентны 10— 20 мг морфина. При операциях аналгезия удовлетворительного уровня достигается введением 0,075 мг/кг препарата. Для поддержания достаточно введения 3—5 мг/ч. Преимущества по сравнению с морфином: в меньшей степени вызывает депрессию дыхания, тошноту и рвоту, имеет высокий терапевтический индекс, не вызывает привыкания.
Применялся довольно широко в 80-х годах в составе сбалансированной анестезии (А.А. Бунятян с соавт.,1984) в комбинации с диазепамом (седуксеном). Для индукции вводили седуксен (10—15 мг в/в) и дипидолор (15 мг в/в); поддержание анестезии осуществляли дробным введением дипидолора по 5— 7,5 мг через 30—60 мин и седуксеном (повторно через 60 мин).
Трамадол гидрохлорид (трамал). Считается частичным мю-агонистом опиатных рецепторов, но обладает двойным (опиоидзависимым и опиоиднезависимым) действием. В эксперименте установлено, что налоксон ингибирует аналгезию трамадолом только частично. Аналгезию снижают также антагонисты серотониновых рецепторов; не исключено воздействие препарата на а2-адренергические рецепторы, с которыми взаимодействуют опиоиды. Видимо, в связи с низким сродством к т-рецепторам трамадол считают аналгетиком средней силы действия, которая составляет около 1/3—1/5 аналгетического потенциала морфина и эквивалентна потенциалу пентазоцина. Эффект 1 мг/кг трамадола сравним с таковым у бупренорфина в дозе 3 мкг/кг, налбуфина (1 мг/кг), морфина (1 мкг/кг). Проявив высокие качества в лечении острого и хронического болевого синдрома, трамадол вместе с тем не нашел широкого применения как эффективный аналгетик в составе многокомпонентной анестезии при оперативных вмешательствах.
Опиоиды (агонисты-антагонисты)
Большинство известных агонистов-антагонистов (пентазоцин, налбуфин, буторфанол) как агонисты к-рецепторов вызывают опиоидзависимые эффекты (аналгезия и седация). Взаимодействуя с мю-рецепторами, эти препараты создают антагонистические эффекты (например, в отношении опиатной депрессии дыхания, хотя в больших дозах сами могут ее вызывать).
Пентазоцин (лексир, фортрал). Агонист-антагонист опиатных рецепторов. При в/в введении характеризуется коротким периодом распределения. Применяется с 80-х годов (А.А. Бунятян с соавт, 1984) как компонент сбалансированной анестезии. В литературе имеются данные об умеренном гипердинамическом эффекте пентазоцина при в/в введении 30 мг (увеличение АД и ЧСС), что связывают с активацией а-адренорецепторов, которая подавляется дроперидолом. Это опровергается данными других авторов, свидетельствующими, напротив, о вазоплегическом влиянии препарата. В дискуссиях на эту тему не исключалось влияние других факторов, связанных с наркозом, операцией и переохлаждением пациентов. Введение пентазоцина в дозе 1—2 мг/кг больным в сознании, по данным фотоплетизмографии, выявило расширение сосудов кожи пальцев. Введение пентазоцина как антагониста морфина (фентанила) осуществляется за 10—15 мин до окончания операции: в/в медленно (в течение 2—3 мин) вводят пентазоцин (1 мг/кг); целесообразно вначале ввести половину расчетной дозы, а через 3—4 мин — оставшуюся часть. Эффект пробуждения и восстановления самостоятельного дыхания наступает через 3—4 мин. Уменьшая депрессию дыхания, связанную с применением фентанила, пентазоцин при в/в введении сам приводит к ней, хотя длительность депрессии значительно меньше.
Налбуфин (нубаин). Агонист к-рецепторов и антагонист мю-рецепторов (период полувыведения — 3,5 ч). Широко используется для лечения острой и хронической боли. Имеет высокий терапевтический индекс, не обладает кардиодепрессивным действием, гипертензивной активностью, не освобождает гистамин. Налбуфин включают в премедикацию (0,1 мг/кг в/м) и дополняют общую анестезию. Описаны схемы анестезии с введением основной дозы налбуфина (0,15—0,25 мг/кг) и поддерживающих (0,05—0,075 мг/кг). Применение налбуфина предупреждает послеоперационную тошноту и рвоту. Налбуфин как агонист к-рецепторов имеет меньшую анальгетическую активность по сравнению с опиатными аналгетиками. В схемах TTVA и ВА его применяют в комбинации с препаратами-потенциаторами аналгетической и нейровегетативной активности, в частносги с клонидином (клофелином). Последний назначают дополнительно в дозе 25—50 мкг в/в. Налбуфин вызывает депрессию дыхания, если при в/в введении его доза составляет более 20—30 мг/70 кг. Как антагонист мю-рецепторов, налбуфин применяется для предупреждения инверсии дыхательной депрессии, вызванной опиатами, в частности фентанилом. Эффективной дозой считается 20 мг, однако, по другим данным. достаточно ввести 0,1 мг/кг для нормализации EtCO2.
Буторфанол тартрат (морадол, стадол, бефорал), частичный агонист к-рецепторов и антагонист мю-рецепторов. Обладает выраженным аналгетическим действием (2 мг в/м или 1 мг в/в), позволяющим купировать острую послеоперационную боль и болевые приступы при печеночной и почечной коликах. За счет отчетливого седативного действия применяется в премедикации. В литературе имеются многочисленные ссылки на попытку применения буторфа-нола (БТ) в схемах ВА и TIVA, однако в целом эффект не убедителен (даже при применении сравнительно больших доз БТ — 4—6 мг в/в), так как препарат применялся либо на фоне кетамина, либо в комбинации с большими дозами диазепама или клонидина. Включение диазепама оправданно только при длительных операциях и требует, как правило, применения ИВЛ в течение нескольких часов послеоперационного периода. Так же как и налбуфин, БТ обладает возможностью инверсии «фентаниловой» депрессии дыхания; с этой целью вводят 1 мг БТ. Эффект, как правило, наступает через 1,5—2 мин и характеризуется увеличением МОД и ЧД, понижением EtCO2; при недостаточном эффекте можно дополнительно ввести 1 мг БТ.
Следует отметить, что современная литература, уделяющая много внимания опиатам нового поколения (алъ-фентанил, суфентанил, ремифентанил), все реже посвящается применению частичных агонистов-антагонистов в схемах сбалансированной (ВА) и тотальной внутривенной анестезии ( TIVA ). Видимо, гарантированный аналгетический эффект при оперативных вмешательствах можно получить только при использовании мю-агонистов.
Побочные эффекты опиоидов. Все опиоидные агонисты мю-рецепторов вызывают дозозависимое угнетение дыхания, что обусловлено снижением чувствительности ДЦ ствола мозга к СО2. Опиоиды медленно выводятся из организма; после окончания в/в инфузии риск дыхательной депрессии может сохраняться несколько часов. Метаболит морфина (морфин-6-глюкуронид) особенно агрессивен в отношении дыхательной депрессии, превосходя сам морфин. Метаболиты фентанила, суфентанила и альфентанила подобные эффекты не создают. Селективные агонисты к-рецепторов практически не влияют на дыхание.
Мышечная ригидность (мышцы грудной клетки и живота) может возникнуть при введении опиоида в большой дозе. Нередко она становится препятствием для спонтанной и искусственной вентиляции; купируется введением миорелаксантов, ослабляется введением барбитуратов и бензодиазепинов. Мышечную ригидность может усилить закись азота и гипоксия.
В ЖКТ обнаружена высокая концентрация опиатных рецепторов (общее эмбриональное происхождение ЖКТ и ЦНС). Эффекты опиоидов на ЖКТ проявляются угнетением опорожнения желудка и перистальтики.
Хорошо известно действие опиоидов, затрудняющее механизм желчеотделения: повышение давления в общем желчном протоке, снижение продукции и оттока желчи в связи со спазмом сфинктра Одди, повышение тонуса общего желчного протока.
Тошнота и рвота возникают в результате стимуляции опиоидами хеморецепторной триггерной зоны (ХТЗ). При больших концентрациях опиоиды подавляют рвотный центр (рвота — редкое явление в кардиохирургии), в малых дозах (но при повторном введении) — вызывают стимуляцию ХТЗ.
Развитие артериальной гипотензии определяется снижением общего периферического сосудистого сопротивления (ОПСС) за счет освобождения гистамина под влиянием морфина и петидина (промедола). Фентанил и новые опиаты (альфентанил, суфентанил) не вызывают гистаминлиберацию. Кардиодепрессивное воздействие опиатов связывают только с петидином (в больших дозах).
Налоксон (антагонист опиатных рецепторов) обладает высоким сродством к рецептору, в силу чего способен перемещать (вытеснять) любой лиганд, занимающий опиатсвязывающий участок (конкурентный антагонизм). Поскольку налоксон не обладает внутренней активностью, он не вызывает аналгезию. Используется для лечения опиатной депрессии дыхания; при его применении устраняется антиноцицептивное действие опиоидов: появляются гипертензия, тахикардия; возможны аритмии и даже отек легких (при нормо- и гипокапнии эти проявления менее значительны). Действие налоксона короче, чем опиоидов, поэтому возможен рецидив дыхательной депрессии. Требуется соблюдение важного принципа — сохранение аналгезии. С этой целью налоксон вводят по схеме (Е. Freye,1987):








