Основные синдромы при заболеваниях печени.
При различных заболеваниях печени нарушаются те или иные виды обмена или те или иные функции органа. Одни заболевания сопровождаются преимущественным повреждением клеток печени,. другие - преимущественным нарушением оттока желчи и т.д., поэтому диагностика заболеваний печени часто проводится посиндромно. Далее описываются основные синдромы (табл.7).
1. Цитолитический синдром (цитолиз) возникает вследствие нарушения структуры клеток печени, увеличения проницаемости мембран, как правило, за счет усиления процессов перекисного окисления липидов (ПОЛ) и выхода ферментов в кровь. При цитолитическом синдроме в кровь попадают как цитоплазматические, так и митохондриальные компонены ферментов, однако основной уровень активности определяют цитоплазматические изоферменты. Цитолиз сопровождает, в основном, острые заболевания печени и увеличивается при обострении хронических. Выделяют следующие основные механизмы цитолиза:
1) токсический цитолиз (вирусный, алкогольный, лекарственный);
2) иммунный цитолиз, в т.ч. аутоиммунный;
3) гидростатический;
4) гипоксический (“шоковая печень” и др.);
5) опухолевый цитолиз;
6) цитолиз, связанный с недостатком питания и неполноценностью пищи.
Цитолиз не тождественен некрозу клеток: при цитолизе клетка остается живой и способна к различным видам обмена, в том числе к синтезу ферментов, поэтому при цитолизе активность ферментов может возрастать в десятки и сотни раз и сохраняться повышенной длительное время. Некроз подразумевает гибель клеток, поэтому подъем активности ферментов может быть значительным, но кратковременным.
Основными доступными маркерами цитолиза при остром гепатите являются аланиновая (АЛТ) и аспарагиновая (АСТ) трансаминазы, гамма-глутамилтранспептидаза (ГГТ), лактатдегидрогеназа (ЛДГ).
Повышение активности АЛТ и АСТ наблюдается у 88-97% пациентов в зависимости от вида гепатита, более, чем у половины из них, наблюдается значительное (в 10-100 раз) увеличение. Максимум активности характерен для 2-3-ей недели заболевания, и возвращение к норме - на 5-6 неделе. Превышение сроков нормализации активности является неблагоприятным фактором. Активность АЛТ > АСТ, что связано с распределением АСТ между цитоплазмой и митохондриями. Преимущественное повышение АСТ связано с повреждением митохондрий и наблюдается при более тяжелых повреждениях печени, особенно алкогольных. Активность трансаминаз повышается умеренно (в 2-5 раз) при хронических заболеваниях печени, чаще в фазе обострения, и опухолях печени. Для циррозов печени повышение активности транаминаз, как правило, не характерно.
Гамма-глутамилтранспептидаза (ГГТ, ГГТП, g-ГТ) содержится в цитоплазме (низкомолекулярная изоформа) и связана с мембранами билиарного полюса (высокомолекулярная изоформа). Повышение ее активности может быть связано с цитолизом, холестазом, интоксикацией алкоголем или лекарствами, опухолевым ростом, поэтому повышение активности ГГТ не является специфическим для того или иного заболевания, но в определенной мере универсальным или скрининговым для заболеваний печени, хотя предполагает дополнительные поиски причины заболевания.
Лактатдегидрогеназа (ЛДГ) повышается при многих заболеваниях. Диагностическое значение суммарной активности невелико и ограничивается определением для исключения опухолевого и гемолитического процессов, а также для дифференциальной диагностики синдрома Жильбера (нормальная) и хронического гемолиза (повышена). Для диагностики заболеваний печени более значима оценка печеночного изофермента ЛДГ - ЛДГ5.
Повышение активности одного или всех ферментов свидетельствует об остром заболевании печени, обострении хронического заболевания или опухолевом процессе, однако не указывает на природу заболевания и не позволяет поставить диагноз.
2. Холестатический синдром (холестаз) характеризуется нарушением секреции желчи. Некоторые авторы выделяют редкую безжелтушную форму холестаза, связанную с изменением нормальных соотношений компонентов желчи (гормональные сдвиги, нарушения кишечно-печеночной циркуляции холестерина). Выделяют внутрипеченочной холестаз, связанный с нарушением секреции желчи гепатоцитом или нарушением формирования желчи в желчных ходах, и внепеченочный холестаз, обусловленный обтурацией желчных протоков камнем, опухолью, или введением лекарств, вызывающих холестаз. При холестазе в плазму крови попадают и накапливаются вещества, которые у здоровых людей выводятся с желчью, а также повышается активность так называемых индикаторных ферментов холестаза. Типичная желтушная форма холестаза характеризуется кожным зудом и желтухой.
При холестазе повышается содержание желчных кислот; билирубина с преимущественным увеличением конъюгированного, входящего в состав желчи (холебилирубина); холестерина и b-липопротеидов; активности ферментов ЩФ, ГГТ, 5-нуклеотидазы.
Щелочная фосфатаза (ЩФ) проявляет свою активность при рН 9-10, содержится в печени, кишечнике, костной ткани, однако главным выделительным органом является печень. В гепатоците ЩФ связана с мембранами билиарного полюса и микроворсинками эпителия желчных ходов. Причинами гиперферментемии являются задержка выведения фермента в желчь и индукция синтеза фермента, зависящая от блока кишечно-печеночной циркуляции. Повышение активности при заболеваниях печени чаще всего указывает на холестаз, при котором активность фермента повышается на 4-10 день до 3-х и более раз, а также на опухоли печени. При повышении активности ЩФ следует проводить дифференциальную диагностику с заболеваниями костей.
5-нуклеотидаза относится к группе щелочных фосфатаз, изменяется параллельно с ними, но повышение ее активности связано исключительно с холестазом. Однако отсутствие доступных коммерческих наборов не позволяет использовать данный показатель в полном объеме.
ГГТ также является мембрансвязанным ферментом и при холестазе повышается за счет активации синтеза. Исследование ГГТ при холестазе считается обязательным.
Нарушение экскреции желчи приводит к нарушению эмульгирования жиров и снижению всасывания жирорастворимых веществ в кишечнике, в том числе витамина К. Снижение содержания витамина К в организме приводит к уменьшению синтеза витамин-К-зависимых факторов свертывания крови и снижению протромбинового индекса (ПТИ). При внутримышечном введении витамина К при холестазе ПТИ через сутки повышается на 30%.
3. Гепатодепрессивный синдром включает любые нарушения функции печени, не сопровождающиеся энцефалопатией. Синдром наблюдается при многих заболеваниях печени, но наиболее выражен при хронических процессах. Для индикации синдрома используются нагрузочные пробы и определение концентрации или активности различных компонентов сыворотки или плазмы крови.
Нагрузочные пробы чувствительны, но используются редко. К ним относятся:
а) пробы на выделительную функцию печени - бромсульфалеиновая, индоциановая и др.;
б) пробы на детоксицирующую функцию печени - антипириновая, кофеиновая, проба Квика.
Как показали исследования, наименее устойчивой при заболеваниях печени является синтетическая функция, и в первую очередь снижается синтез тех веществ, которые образуются преимущественно в печени. Доступными и информативными индикаторами гепатодепресии могут быть следующие:
1. Альбумин практически полностью синтезируется печенью. Снижение его концентрации наблюдается у половины больных с острыми и у 80-90% больных с ХАГ и циррозом печени. Развивается гипоальбуминемия постепенно, результатом может быть снижение онкотического давления крови и отеки, а также снижение связывания гидрофобных и амфифильных соединений эндогенной и экзогенной природы (билирубина, свободных жирных кислот, лекарств и др.), что может вызвать явления интоксикации. Информативно параллельное определение альбумина и общего белка. Как правило, содержание общего белка остается нормальным или растет за счет иммуноглобулинов (Ig) на фоне снижения концентрации альбумина. Снижение альбумина до 30 г/л и менее свидетельствует о хронизации процесса.
2. a -1-Антитрипсин - гликопротеид , составляющий 80-90% фракции a1-глобулинов, белок острой фазы, синтезируется в печени, является чувствительным индикатором воспаления паренхиматозных клеток. Исключительное диагностическое значение связано с врожденной недостаточностью белка, приводящей к тяжелым формам поражения печени и других органов у детей.
3. Холинэстераза (псевдохолинэстераза, бутирилхолинэстераза - ХЭ, БХЭ) сыворотки крови, синтезируется печенью, относится к b2-глобулинам. Одной их функций является расщепление миорелаксантов, производных сукцинилдихолина (листенон, дитилин). Недостаток фермента или появление атипических форм затрудняет расщепление препаратов, что усложняет процесс выхода из наркоза. Для предотвращения послеоперационных осложнений рекомендуется определять активность фермента и дибукаиновое число, т.е. степень ингибирования фермента дибукаином. При хронических процессах, особенно циррозе печени, активность фермента снижается, причем степень снижения имеет прогностическое значение. Другая причина снижения активности - отравление фосфорорганическими соединениями.
4. Фибриноген, I фактор свертывания крови, белок острой фазы, относится к b2-глобулинам. Уровень фибриногена закономерно снижается при тяжелых хронических и острых заболеваниях печени.
5. ПТИ снижается в связи с нарушением синтеза витамин К-зависимых факторов свертывания крови (II, VII, IX, X). В отличие от холестаза, уровень ПТИ не нормализуется при внутримышечном введении витамина К. ПТИ является маркером тяжести острой дисфункции печени.
6. Холестерин в крови снижается у больных с хроническим гепатитом и циррозом печени, чаще при подостром варианте течения. При жировой дистрофии печени уровень холестерина может повышаться.
Для хронических заболеваний печени в стадии компенсации нехарактерно повышение активности ферментов. Однако умеренное повышение (в 1,5 - 3 раза) активности трансаминаз с более высоким уровнем АСТ свидетельствует о повреждении субклеточных структур, в частности, МХ.
4. Мезенхимально-воспалительный синдром обусловлен повреждением мезенхимы и стромы печени, он по сути является иммунным ответом на антигенную стимуляцию кишечного происхождения. Данный синдром сопровождает как острые, так и хронические заболевания печени. Маркерами синдрома являются g-глобулины, иммуноглобулины, тимоловая проба, антитела к клеточным элементам и др.
Определение g -глобулинов относится к обязательным тестам для печени. Подъем g-глобулинов, по сути являющихся иммуноглобулинами, характерен для большинства заболеваний печени, но наиболее выражен при ХАГ и циррозе печени. В последнее время показано, что g-глобулины могут вырабатываться купферовскими клетками и плазматическими клетками воспалительных инфильтратов печени. При циррозах печени на фоне низкой концентрации альбумина из-за нарушения синтетической функции печени наблюдается значительный рост g-глобулинов, при этом концентрация общего белка может оставаться нормальной или повышенной.
Иммуноглобулины (Ig) представляют собой белки, входящие во фракцию g-глобулинов и обладающие свойствами антител. Известно 5 основных классов Ig: IgA, IgM, IgG, IgD, IgE, однако для диагностики используются первые три. При хронических заболеваниях печени увеличивается содержание всех классов Ig, однако наиболее выражен рост IgM. При алкогольных поражениях печени наблюдаетмя повышение IgА.
Тимоловая проба - неспецифичный, но доступный метод исследования, результат которого зависит от содержания IgM, IgG и липопротеидов в сыворотке крови. Проба бывает положительной у 70-80% больных острым вирусным гепатитом в первые 5 дней желтушного периода, у 70-80% больных с ХАГ, у 60% - с циррозом печени. Проба нормальна при механической желтухе у 95% пациентов.
Антитела к тканевым и клеточным антигенам ( нуклеарные, гладкомышечные, митохондриальные) позволяют выявить аутоиммунные компоненты при заболеваниях печени.
К дополнительным методам исследования относится определние гаптоглобина, орозомукоида, a2-макроглобулина, b2-микроглобулина, оксипролина, уроновых кислот.
Таблица 1.
Синдромы при заболеваниях печени.
| Синдром | Лабораторные показатели |
| 1.Цитолиз некроз | АЛТ , АСТ , ЛДГ , ГГТ АСТ , ГлДГ , ЛДГ5 |
| 2. Холестаз | желчные кислоты, ЩФ , ГГТ , билирубин , холестерин , ПТИ ¯ |
| 3.Гепатодепрессия | альбумин¯ , холестерин¯, фибриноген ¯ , ПТИ¯ , ХЭ¯ , (снижение синтетической функции), АСТ> АЛТ |
| 4.Мезенхимально-воспалительный (иммунный ответ) | g-глобулины (Ig ) , тимоловая проба:отрицат., - холестаз (95%) + о.гепатит (80%), ХАГ (80%), цирроз (60%) |
| 5.Печеночная недостаточность | NH3 , фенолы , циклические аминокислоты , жирные кислоты с короткой цепью(масляная, валериановая, капроновая), синтетическая функция снижена) |
Примечание: - повышение, ¯ - снижение, ® - норма.
5. Печеночная недостаточность обусловлена нарушением основных функций печени, а также поступлением в кровяное русло, минуя печень, токсических веществ из кишечника с последующим развитием энцефалопатии. К индикаторам шунтирования печени относятся аммиак и его производные, фенолы, циклические аминокислоты, жирные кислоты с корткой цепью.
Аммиак образуется при дезаминировании аминокислот и является исключительно токсичным для мозга соединением. Нейтрализация аммиака осуществляется печенью путем его превращения в мочевину. В редких случаях повышение содержания аммиака может быть связано с врожденной или приобретенной недостаточностью ферментных систем, но, в большинстве случаев, его повышение обусловлено заболеваниями печени. Показано, что концентрация аммиака повышена у больных с циррозом печени ( на 25-50% - без энцефалопатии, на 50% и более - с энцефалопатией), у больных с тяжелым течением вирусного гепатита, у 80% больных с печеночно-клеточной комой и у всех больных с портально-печеночной комой.
Фенолы, представляющие собой циклические гидрофобные соединения, токсичные для мозга, резко повышаются при печеночной коме. В лабораторной диагностике используются редко из-за отсутствия доступных методов.
Циклические аминокислоты (тирозин, фенилаланин, триптофан,) повышаются при тяжелых поражениях печени. У здоровых людей общий уровень аминокислот, а также соотношение их различных видов, поддерживает печень. При отсутствии регулирующей функции печени количество аминокислот непропорционально меняется, и некоторые из них, находясь в избытке, могут оказывать токсический эффект. Так, тирозин и фенилаланин могут вытеснять истинные медиаторы (норадреналин) из синапсов и выполнять роль ложных нейротрансмиттеров, дезорганизуя работу нервной системы. Продукты расщепления триптофана, индол и скатол, токсичны для нервной системы и могут вызывать кому. Метионин в высоких концентациях сам по себе токсичен для мозга.
К жирным кислотам с короткой цепью (ЖККЦ) относятся масляная (С4), валериановая (С5), капроновая (С6), каприловая (С8), которые образуются в кишечнике и нейтрализуются печенью. В норме жирные кислоты, как и все токсичные и активные гидрофобные соединения, связаны с альбумином. При печеночной недостаточности содержание кислот повышается, а альбумина - закономерно снижается, поэтому ЖККЦ могут беспрепятственно оказывать токсический эффект на синапсы нервных клеток, замедляя проведение нервных импульсов.
Различают малую печеночную недостаточность и большую печеночную недостаточность, которая может быть обусловлена как поступлением токсичных веществ из кишечника (шунтирование печени), так и повреждением или разрушением печеночных клеток.
Таблица 2.
Основные характеристики печеночной недостаточности.
| Признак | Малая | Большая |
| Гепатогенная энцефалопатия | Отсутствует | Имеется |
| Наличие гепатодепрессии | Обычно умеренное | Обычно выраженное |
| Повышение индикаторов шунтирования | Отсутствует или умеренное | Выраженное |
Печеночно-клеточная недостаточность (истинная кома) связана с разрушеним клеток или их замещением на другие клетки (соединительнотканные, опухолевые и др.). Заболевание характеризуется энцефалопатией, желтухой и геморрагическим синдромом. У больных выражен гептодепрессивный синдром (снижение факторов свертывания крови, ПТИ, холестерина, ХЭ, альбумина), повышение обеих фракций билирубина в 10-20 раз, отеки, связанные преимущественно со снижением уровня альбумина, повышен уровнь индикаторов шунтирования печени - аммиака, циклических аминокислот, жирных кислот с короткой цепью, могут быть повышены ферменты цитолиза. Уменьшение содержания ферментов на фоне комы является неблагоприятным признаком, что обусловлено снижением способности печени к синтезу ферментов.
Портально-печеночная недостаточность (шунтовая кома) обусловлена, в первую очередь, попаданием в общий кровоток веществ, которые в норме обезвреживаются печенью и расцениваются как индикаторы шунтирования - аммиак, циклические аминокислоты, жирные кислоты с короткой цепью, меркаптаны. Ведущая роль в развитии комы отводится аммиаку, повышение которого нарушает энергетический метаболизм нервных клеток. Гипербилирубинемия умеренная, функциональные пробы печени не изменены. Кома наблюдается у больных циррозом печени с выраженными кавапортальными анастамозами, поддается лечению.
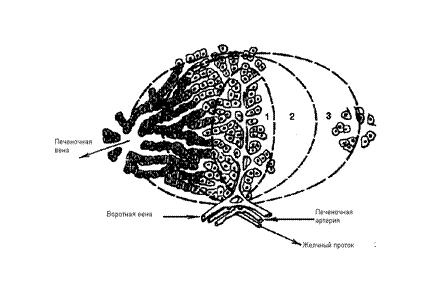
Рис.1. Печёночная долька.
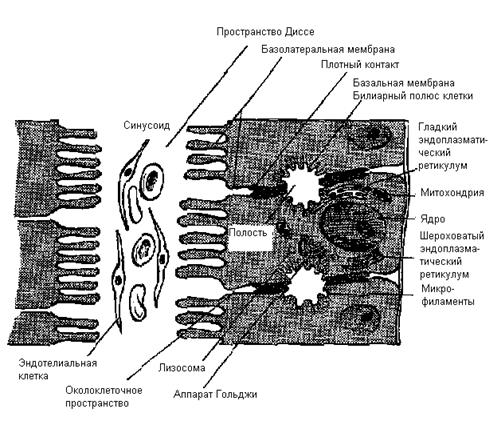
Рис. 2. Клетка печени (гепатоцит).








