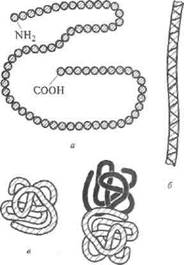
Белкам свойственны различные структуры. Последовательность аминокислотных остатков в полипептидной цепи называют первичной струк турой белка (рис. 3, а). Она специфична для каждого белка.
В молекуле белка полипептидная цепь частично закручена в виде α-спирали, витки которой скреплены водородными связями.
|
|
Вид спирали характеризует вто ричную структуру (рис. 6, б). Возможна также слоисто-складчатая структура.
Пространственное расположение полипептидной цепи определяет тре тичную структуру белка (рис. 3, в). В зависимости от пространственного расположения полипептидной цепи форма молекул белков может быть различной. Если полипептидная цепь образует молекулу нитевидной формы, то белок называется фибриллярным (от лат. fibrilla - нить), если она уложена в виде клубка - глобулярным (от лат. globulus - шарик).
Рис. 3. Структуры белковых Четвертичная структура харак-
молекул: теризует способ расположения
а) первичная; б) вторичная; в пространстве отдельных поли-
в) третичная; г) четвертичная пептидных цепей в белковой моле-
куле.
Белки обладают большой молекулярной массой (от нескольких тысяч до нескольких миллионов). Вследствие большого размера белковых частиц водные растворы их представляют собой коллоидную систему, которая состоит из дисперсионной среды (растворитель) и дисперсной фазы (частицы растворенного вещества).
|
|
Благодаря присутствию в аминокислотных остатках групп, способных к ионизации (СООН, NH2 и др.), белковые молекулы несут отрицательные и положительные заряды. Нарушение этих факторов устойчивости приводит к осаждению (коагуляции) частиц. Коагуляцию можно осуществить, добавляя в раствор белков дегидратирующие вещества (спирт, ацетон, сульфат аммония и некоторые другие соли), разрушающие гидратную оболочку. При этом происходит обратимое осаждение белков, т. е. при удалении этих веществ белки вновь переходят в нативное состояние.
При действии на белок солей тяжелых металлов, кислот и щелочей, а также при нагревании происходят необратимые реакции осаждения с потерей первоначальных свойств белка. Это явление называется денату рацией. Она характеризуется развертыванием полипептидной цепи белка, которая в нативной белковой молекуле была свернута. В результате развертывания полипептидных цепей на поверхность белковой молекулы выходят гидрофобные группы. При этом белок теряет растворимость, агрегирует и выпадает в осадок.
3.2 Классификация белков молока
В молоке содержится в среднем около 3,2% белков, колебания составляют от 2,9% до 3,5%. Белки, входящие в состав молока, имеют сложный состав, разнообразны по строению, физико-химическим свойствам и биологическим функциям.
Используя современные способы разделения и выделения белков, исследователи установили, что в состав молока входят три группы белков:
· казеин;
· сывороточные белки;
· белки оболочек жировых шариков.
На рис. 4 представлен фракционный состав белков молока.
Биологические функции белков молока многообразны. Так, казеин является собственно пищевым белком, выполняющим в организме новорожденного структурную функцию. Кроме того, казеин транспортирует в составе своих частиц кальций, фосфор и магний. Транспортные функции также выполняют лактоферрин и β-лактоглобулин, иммуноглобулины обладают защитными функциями, α-лактальбумин - регуляторными и т. д.
Общий белок 3,2%
Подкисление, рН 4,6
Осадок: Фильтрат:
 казеин 2,6% сывороточные белки 0,6%
казеин 2,6% сывороточные белки 0,6%
Нагревание до 93-95°С, раскисление
Осадок: Фильтрат:
лактоферрин, β-лактоглобулин, протеоз-пептоны 0,06%
иммуноглобулины, α-лактальбумин
0,54% действие
трихлоруксусной кислоты
Рис. 4. Схема фракционного состава белков молока
3.3 Казеин
Казеин является главным белком молока, его содержание колеблется от 2,1 до 2,9%. Элементарный состав казеина (в %) следующий: углерод - 53,1; водород - 7,1; кислород - 22,8; азот - 15,4; сера - 0,8; фосфор - 0,8. Он содержит несколько фракций, отличающихся аминокислотным составом, отношением к ионам кальция и сычужному ферменту.
В молоке казеин находится в виде специфических частиц, или мицелл, представляющих собой сложные комплексы фракций казеина с коллоидным фосфатом кальция.
Казеин – комплекс 4 фракций: αs1, αs2, β, χ. Фракции имеют различный аминокислотный состав и отличаются друг от лруга заменой одного или двух аминокислотных остатков в полипептидной цепи. αs - и β – Казеины наиболее чувствительны к ионам кальция и в присутствии их они агрегируют и выпадают в осадок. χ - Казеин не осаждается ионами кальция и в казеиновых мицеллах, располагаясь на поверхности, выполняет защитную роль по отношению к чувствительным . αs - и β – казеину. Однако χ – казеин чувствителен к сычужному ферменту и под его воздействием распадается на 2 части: гидрофобный пара -χ-казеин и гидрофильный макропротеид.
Полярные группы, находящиеся на поверхности и внутри казеиновых мицелл (NH2, COOH, ОН и др.), связывают значительное количество воды — около 3,7 г на 1 г белка. Способность казеина связывать воду характеризует его гидрофильные свой ства. Гидрофильные свойства казеина зависят от структуры, величины заряда белковой молекулы, рН среды, концентрации солей и других факторов. Они имеют большое практическое значение. От гидрофильных свойств казеина зависит устойчивость казеиновых мицелл в молоке. Гидрофильные свойства казеина влияют на способность кислотного и кислотно-сычужного сгустка удерживать и выделять влагу. Изменение гидрофильных свойств казеина необходимо учитывать при выборе режима пастеризации в процессе производства кисломолочных продуктов и молочных консервов. От гидрофильных свойств казеина и продуктов его распада зависят водосвязывающая и влагоудерживающая способность сырной массы при созревании сыров, консистенция готового продукта.
Казеин в молоке содержится в виде сложного комплекса казеината кальция с коллоидным фосфатом кальция, так называемого казеинаткальцийфосфатного комплекса (ККФК). В состав ККФК также входит небольшое количество лимонной кислоты, магния, калия и натрия.
3.4 Сывороточные белки
После осаждения казеина из молока кислотой (при рН 4,6 - 4,7) в сыворотке остается около 0,6 % белков, которые называют сывороточны ми. Они состоят из |β-лактоглобулина, α-лактальбумина, иммуноглобулинов, альбумина сыворотки крови, лактоферрина.
β-Лактоглобулин, α-лактальбумин и иммуноглобулины выполняют важные биологические функции и имеют большое промышленное значение, вследствие высокого содержания незаменимых и серосодержащих аминокислот. Из сыворотки их выделяют в нативном состоянии с помощью ультрафильтрации и применяют для обогащения различных пищевых продуктов.
Альбумин сыворотки крови содержится в молоке в незначительных количествах и не имеет практического значения. Лактоферрин, несмотря на малое содержание, выполняет важные биологические функции и необходим для организма новорожденного.
β-Лактоглобулин. β-Лактоглобулин составляет 50 - 54% белков сыворотки (или 7 - 12% всех белков молока). Он имеет изоэлектрическую точку при рН 5,1. При пастеризации молока денатурированный β-лактоглобулин вместе с Са3(Р04)2 выпадает в осадок в составе молочного камня и образует комплексы с χ-казеином казеиновых мицелл (осаждаясь вместе с ними при коагуляции казеина). Он не свертывается сычужным ферментом и не коагулирует в изоэлектрической точке в силу своей большой гидратированности.
α-Лактальбумин. В сывороточных белках α-лактальбумин занимает второе место после β-лактоглобулина (его содержание составляет 20 - 25% сывороточных белков, или 2 - 5% общего количества белков). α-Лактальбумин устойчив к нагреванию, он является самой термостабильной частью сывороточных белков. Он является специфическим белком, необходимым для синтеза лактозы из галактозы и глюкозы.