Жиры. УГЛЕВОДЫ. ГЛЮКОЗА. Дисахариды. Химические свойства
Жиры – сложные эфиры глицерина и высших одноосновных карбоновых кислот (так называемых ЖИРНЫХ кислот).
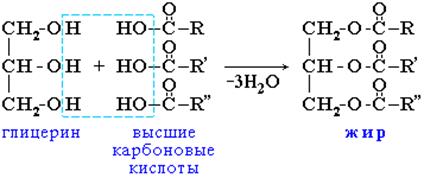
Общее название таких соединений – триглицериды или триацилглицерины, где ацил – остаток карбоновой кислоты –
- С= О
ô
R
Жирные кислоты.
| Предельные кислоты: | Непредельные кислоты: |
| 1. Масляная кислота С3Н7 -СООН 2. Пальмитиновая кислота С15Н31 - СООН 3. Стеариновая кислота С17Н35 - СООН | 5. Олеиновая кислота С17Н33СООН (1 = связь) СН3—(СН2)7—СН = СН—(СН2)7—СООН 6. Линолевая кислота С17Н31СООН (2 = связи) СН3-(СН2)4-СН = СН-СН2-СН = СН-СООН 7. Линоленовая кислота С17Н29СООН (3 = связи) СН3СН2СН = CHCH2CH = CHCH2CH=СН(СН2)4СООН |
Физические свойства.
| Животные жиры | Растительные жиры (масла) |
| Твёрдые, образованы предельными кислотами – стеариновой и пальмитиновой. | Жидкие, образованы непредельными кислотами – олеиновой, линолевой и другими. |
Жиры растворимы в органических растворителях и нерастворимы в воде.
Химические свойства.
1. Гидролиз (омыление) жиров в кислой или в щелочной среде, или под действием ферментов:
а) кислотный гидролиз : под действием кислоты жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
б) щелочной гидролиз – омыление. Получается глицерин и СОЛИ карбоновых кислот, входивших в состав жира.
Кислотный гидролиз

Щелочной гидролиз
В щелочной среде образуются мыла – соли высших жирных кислот (натриевые – твёрдые, калиевые – жидкие).
2. Гидрирование (гидрогенизация) – процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жира.
При этом остатки непредельных кислот переходят в остатки предельных, жидкие растительные жиры превращаются в твёрдые (маргарин).
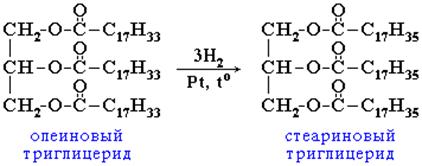
Количественной характеристикой степени ненасыщенности жиров служит йодное число, показывающее сколько г йода может присоединиться по двойным связям к 100 г жира.
Синтетические моющие средства.
| Обычное мыло плохо стирает в жёсткой воде и совсем не стирает в морской воде, так как содержащие в ней ионы кальция и магния дают с высшими кислотами нерастворимые в воде соли: С17Н35COONa + CaSO4à (С17Н35COO)2Ca↓ + Na2SO4 Поэтому наряду с мылом из синтетических кислот производят синтетические моющие средства из других видов сырья, например из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты. В общем виде образование таких солей можно изобразить уравнениями: R-CH2-OH + H2SO4 à R-CH2-O-SO2-OH + H2O спирт серная кислота алкилсерная кислота R-CH2-O-SO2-OH + NaOH à R-CH2-O-SO2-ONa + H2O алкилсульфат Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках. |
УГЛЕВОДЫ
Углеводы (сахара) – органические соединения, имеющие сходное строение и свойства, состав большинства которых отражает формула Cx(H2O)y, где x, y ≥ 3.
Исключение составляет дезоксирибоза, которая имеют формулу С5Н10O4.
НЕКОТОРЫЕ ВАЖНЕЙШИЕ УГЛЕВОДЫ
| Моносахариды | Олигосахариды | Полисахариды |
| Глюкоза С6Н12О6 Фруктоза С6Н12О6 Рибоза С5Н10О5 Дезоксирибоза С5Н10О4 | Сахароза (дисахарид) С12Н22О11 Лактоза – молочный сахар (дисахарид) С12Н22О11 | Целлюлоза (С6Н10О5)n Крахмал (С6Н10О5)n Гликоген (С6Н10О5)n |
Моносахариды
Моносахариды – гетерофункциональные соединения, в состав их молекул входит одна карбонильная группа (альдегидная или кетонная) и несколько гидроксильных.
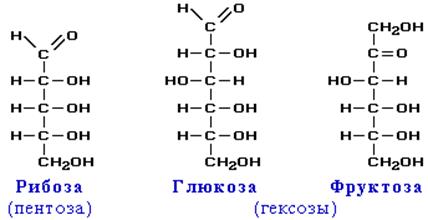
ГЛЮКОЗА.
Получение.
1. Гидролиз крахмала:
(C6H10O5)n + H2O à C6H12O6
2. Синтез из формальдегида: 6Н2С=О –Са(ОН)2à С6Н12О6
Реакция была впервые изучена А. М. Бутлеровым.
3.В растениях углеводы образуются в результате реакции фотосинтеза из CO2 и Н2О:
6CO2 + 6 H2O –(хлорофилл, свет)à C6H12O6 + 6O2








