Рентгено –структурыный анализ- это методы исследования структуры вещества по распределию в пространстве и интенсивностям рассеянного на анализируемом обьекте рентгентовского излучения.
Ренгентовские лучи –электромагнитное ионизируещее излучение занимающее спектральную область между гамма и ультрафиолтовым излучением в пределах длин волн от 10 *-12 до 10*-15. Рентгеноструктурный анализ наряду с нейронографией и электронографией является дифракционным структурным методом. В его основе дежит взаимодействие рентгеновского излучения с электронами вещейства, в результате которого возникает дифракция ренгентовских лучей.
Преимущества метода. Заключается в возможности изучить пространственное расположение молекул,точно изменить расстояние м\д ними ,оценить внутримолекулярную структуру ,а так же опредеделить структру молекулярных компонентов мембраны в нефиксированных клеточных препаратах.
Ø метод флюоресцентных зондов
Для регистрации изменений многих клеточных процессов и характеристики вязкости, мембранного потенциала, внутриклеточного или связанного содержания ионов используют метод флуоресцентных зондов (например, такие зонды, как fura-2, хлортетрациклин, 9-аминоакридин и флуоресцеиндиацетат).
В основе метода флуоресцентного определения мембраносвязанного кальция лежит способность антибиотика ХТЦ, локализованного в мембране, образовывать комплекс с ионом кальция, что приводит к увеличению квантового выхода флуоресценции зонда. Его свечение регистрируют с одного и того же участка клетки в течение всего времени эксперимента с помощью люминесцентного микроскопа. Возбуждение флуоресценции ХТЦ вызывают с помощью галогенной лампы накаливания, выделяя полосу за счет комбинации фильтров. Регистрацию свечения проводят с помощью фотометрической насадки, выделяя полосу с помощью интерференционных светофильтров при длине волны максимального пропускания светового пучка 490 и 550 нм.
При регистрации внутриклеточного рН в качестве зонда используют ФДА в конечной концентрации 10-5 моль. После 20 мин инкубации (время, необходимое для накопления в объекте достаточного для флуориметрии количества флуоресценции) клетки тщательно отмывают от экстраклеточного ФДА. Для обеспечения постоянного рН экстраклеточной среды при инкубации клеток добавляют 50 ммоль HEPES, доводя рН раствора до 6,2 - 8,5. Спектры флуоресценции препаратов регистрируют с помощью инвертированного микроспектрофлуориметра: возбуждение флуоресценции препаратов осуществляют обычно с помощью галогенной лампы накаливания и комбинации стеклянных светофильтров. Размер фотометрируемого участка клетки составляет, как правило, 60 ч 60 мкм (при объективе ч 10). Значение внутриклеточного рН определяют по величине отношения интенсивностей флуоресценции окрашенного препарата при длинах волн 516 и 570 нм, сопоставляя его со значениями соответствующей калибровочной кривой, представляющей собой зависимость величины этого отношения от значений рН буферных растворов флуоресцеина.
Для регистрации внутриклеточного Са2+ после загрузки и перед началом опыта клетки промывают исходным раствором и выдерживают 30-40 мин для деэтерифицировапия и достижения равновесного распределения между связанной и свободной формами молекул зонда (fura-2) внутри клетки. Для определения содержания кальция в клетке применяют микроспектрофлуориметрический метод. Клетки помещают в перфузируемую ячейку на предметном столике инвертировагаюго микроскопа, совмещенного со спектрофлуориметром, оснащенным ксеноновой лампой, разделителем лучей, двумя монохроматорами и двойным зеркальным чопперным механизмом, позволяющим чередовать возбуждение молекул fura-2 лучами двух длин воли - 340 и 380 нм (с частотой 100 Гц). Ширина полосы возбуждения не должна превышать 3,5 нм. Концентрацию Са2+ рассчитывают по отношению интенсивностей флуоресценции (505 нм) в ответ на возбуждение, вызванное лучами с длинами волн 340 и 380 нм.
Ø метод восстановленной флуоресценции после фотоотбеливания
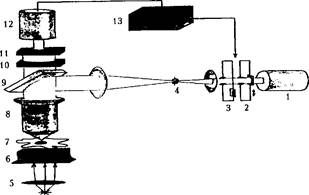
Упрощенная схема установки для исследования восстановленной флуоресценции после фотоотбеливания: 1 - лазер; 2,3 - аттенюаторы (ослабители луча); 4 - диафрагма; 5 - осветитель; 6 - конденсатор микроскопа; 7 - исследуемая клетка; 8 - объектив микроскопа; 9 - дихроичное зеркало, отражающее падающий свет и пропускающее свет возбужденной флуоресценции; 10 - отсекающий светофильтр; 11 - "зонд" - узкая диафрагма, выделяющая флуоресценцию с исследуемого участка; 12 - ФЭУ; 13 - блок регистрации и управления установкой
Метод восстановленной флуоресценции после фотоотбеливания используется в биофизике клетки для измерения коэффициента латеральной диффузии белков и липидов в плазматических мембранах. Если пометить интересующие нас белки или фосфолипиды флуоресцентной меткой, например производным флуоресцеина, и ввести их в клетку, то при регистрации с помощью флуоресцентного микроскопа наблюдается флуоресценция, величину которой можно оценить фотоэлектронным умножителем и проанализировать на персональном компьютере.
Возбуждающий флуоресценцию луч лазера фокусируется на участке плазматической мембраны (порядка нескольких квадратных микрон). Далее этот луч должен быть ослаблен аттенюаторами настолько, чтобы вызвать лишь флуоресценцию метки, но не фотоокисление компонентов мембраны.
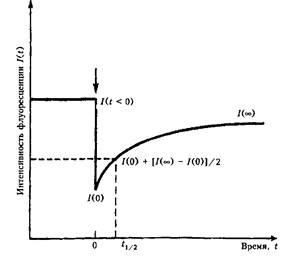
Восстановление интенсивности флуоресценции после фотоотбеливания. Метод расчета данных по трем точкам: 7 (Я < 0) - интенсивность флуоресценции до фотоотбеливания; 7 (0) - интенсивность флуоресценции непосредственно после фотоотбеливания. Стрелкой отмечен момент фотоотбеливания
В начале эксперимента интенсивность возбуждающего луча на несколько десятков миллисекунд увеличивают настолько, чтобы вызвать фотоокисление флуоресцентной метки (фотоотбеливание). Вслед за этим его интенсивность возвращают к исходному уровню и регистрируют интенсивность флуоресценции участка клетки после фотоокисления метки. Так как продукт фотоокисления не флуоресцирует, то восстановление исходного уровня флуоресценции наступает вследствие латеральной диффузии меченых молекул белка или липида из соседних областей клетки. Таким образом, регистрация скорости восстановления исходного уровня флуоресценции участка мембраны клетки после фотоотбеливания позволяет определить коэффициенты диффузии мембранных белков и липидов.
Ø метод конфокальной лазерной сканирующей микроскопии
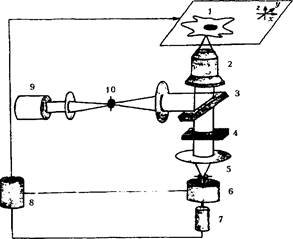
Конфокальный лазерный сканирующий микроскоп: 1 - сканируемый в 3 направлениях предметный столик; 2 - объектив микроскопа (инвертированного); 3 - дихроичное зеркало; 4 - отсекающий фильтр; 5 - диафрагма детектора; 6 - спектрограф (для выделения нужной полосы флуоресценции); 7 - ФЭУ; 8 - блок регистрации и управления установкой; 9 - лазер; 10 - диафрагма осветителя
Конфокальный микроскоп- Оптический микроскоп,обладающий значительным контрастом по сравнению с обычным микроскопом,что достигается использованием апертуры, размещенной в плоскости изображения и ограничивающей поток фонового рассеянного света.
Преимущества в биологии перед другими микроскопами: Показатель преломления биологич обьектов почти такой же как у стекла ,поэтому наблюдение этих обьектов находящихтся на поверх-ти предметного стекла,в обычном микроскопе весьма затруднено. Конфокальный микроскоп ,имеющий высокий контраст, дает две неоцененные возможности :он позволяет исследовать ткани на клеточном уровне в состоянии физиологчиеской жизнедеят-ти (т.е клеточной активности) в четырех измерениях- высота.ширина,глубина и время.
- ядерно-магнитный резонанс
Ядерно-магнитный резонанс(ЯМР)- резонансное поглощение или излучение электромагнитной энергии веществом,содержащим ядра с ненулевымспином во внешнем магнитном поле,на частоте м(называемой частотой ЯМР), обусловленное переориентацией магнитных моментов ядер.
Явление ядерного магнитного резонанса основано на том, что ядра атомов большинства химических элементов (за исключением ядер с четным числом протонов и нейтронов) обладают так называемым спином, то есть моментом количества движения и обусловленным им постоянным магнитным моментом. При помещении в постоянное магнитное поле магнитный момент системы ядер подобно вращающемуся волчку, выведенному из вертикального положения, движется по поверхности конуса вращения вокруг оси направления поля (прецессионное движение) с частотой со = у • Н0, где у — константа для каждого вида ядер, а Н0 — напряженность постоянного магнитного поля. Воздействие внешнего переменного электромагнитного излучения с данной частотой на ядра, находящиеся в постоянном магнитном поле, приводит к избирательному (резонансному) поглощению энергии электромагнитного излучения и появлению сигнала ЯМР. Разным ядрам соответствуют различные частоты резонанса.
Аппаратура для регистрации спектров ЯМР включает магнит, создающий поле напряженностью до 10 тл и более, генератор радиочастотных колебаний, приемник, в катушку которого помещается исследуемый объект, и регистрирующее устройство. Запись спектров проводят либо при изменении величины магнитного поля и последовательном создании резонансных условий для разных линий в спектре ЯМР, либо путем возбуждения резонанса сразу во всей полосе спектра с помощью мощного радиочастотного импульса, что резко сокращает время измерений. Исходный спектр ЯМР затем получают по специальной программе с помощью ЭВМ.
Сердцем спектра ЯМР явл-ся мощный магнит . В эксперименте спервые осущ-м на практике Парселом,образец помещенный в стеклянную ампулу диаметром около 5 мм,заключается между полюсами сильного электромагнита. Традиционный метод Ямр-спектроскопии имеет множество недостатков.
Во-первых, он требует большого количества времени для постоения кажлого спектра.
Во- сторых, он очень требователен к отсутствию внешних помех,и как правило получаемые спектры имеют значит.шумы.
В-третьих он непригоден для создания спектрометров высоких частот (300,400,500 МГц). Поэтому в современных приборах ЯМР исп-ся метод так называемой импульсной спектроскопии ,основанной на фурье-пробразованих полученного сигнала. В наст вр все ЯМР- спектрометры строятся на основе мощных сверхпроводящих мангитов с постоянной величиной магн.Поля
Для качественного анализа с помощью ЯМР исп-т анализ спектров,основанный на таких свостввах данного метода
1. сигналы ядер атомов,входящих в определенные функциональные группы ,лежат в строго определенных участках спектра
2. интегральная площадь,ограниченная пиком,строго пропорциональная количеству резонирующих атомов
3. ядра,лежащие через 1-4 связи,способны давать мультиплетные сигналы в результате т.н расщепления друг на друге.
3. Методы изучения структуры мембран:
- метод спектроскопии комбинационного рассеяния
Рамановская спектроскопия (спектроскопия комбинационного рассеяния) — это метод молекулярной спектроскопии, основанный на взаимодействии света с веществом. Рамановская спектроскопия основана на изучении рассеянного света.
Комбинационное рассеяние света - это рассеяние света молекулами вещества с изменением частоты излучения.
Для усиления комбинационного рассеяния исп-ют наночастицы благородных металлов, которые можно ввести в клетку, и с их помощью изучать различные внутриклеточные свойства.
Принцип рамановской спектроскопии: Когда свет взаимодействует с молекулами в газе, жидкости или твердом теле, подавляющее большинство фотонов рассеивается, имея ту же энергию, что и падающие фотоны. Этот процесс называется упругим (рэлеевским) рассеянием. Некоторые фотоны — примерно один из 10 миллионов — после рассеяния приобретают частоту, отличную от частоты падающего фотона. Этот процесс называется неупругим рассеянием или эффектом Рамана.
Процесс комбинационного (рамановского) рассеяния:
С точки зрения квантовой механики процесс рамановского (комбинационного) рассеяния заключается в том, что при взаимодействии фотонов с молекулой та может перейти в виртуальное состояние с более высокой энергией. Существует несколько вероятных сценариев выхода молекулы из этого состояния. В одном из них молекула может перейти в состояние с уровнем колебательной энергии, который отличается от начального уровня, испустив при этом фотон с другой энергией. Разница между энергией падающего фотона и энергией рассеянного фотона называется рамановским сдвигом.
Если энергия рассеянного света уменьшается, такое рассеяние называют стоксовым. Некоторые молекулы изначально находятся в возбужденном колебательном состоянии, и тогда после перехода в виртуальное состояние с более высокой энергией они могут перейти в конечное состояние с энергией ниже, чем у исходного возбужденного состояния. Такое рассеяние называется антистоксовым.
ИСПОЛЬЗУЕТСЯ ПРИ исследовании полимерных биологических макромолекул – полипептидов, полинуклеотидов и полисахаридов.
Важной особенностью КР является возможность следить за такими группами, как дисульфидная, пероксидная. Это позволяет следить за дисульфидными мостиками в белках.
- микроспектроскопия комбинационного рассеяния
Спектры КР от отдельных участков клетки получают на КР-микроспектрометре с тройным монохроматоров и фотоэлектронной регистрацией сигнала. Запись и обработку спектров проводят с помощью компьютера.
В качестве источника возбуждения используют аргоновый лазер.
Аргоновый лазер — ионный газовый лазер, который способен излучать свет с различными длинами волн в видимой и ультрафиолетовой областях. Это непрерывный лазер, мощность которого может достигать нескольких сотен Ватт.
С целью устранения плазменных линий, расположенных вблизи от возбуждающей линии, перед кюветным отделением помещают предмонохроматор или интерференционный фильтр.
Для получения спектров с пространственным разрешением применяют РКР-спектрометр, состыкованный с оптическим микроскопом.
При работе с клетками устанавливают водоиммерсионный объектив 100х с числовой аппертурой 0,95.
- метод динамической фазовой микроскопии
Для исследования формы клетки или отдельных ее частей используют лазерный фазовый микроскоп. Он представляет собой модифицированный интерференционный микроскоп с модуляцией фазы референтной волны, с гелий-неоновым лазером для когерентного освещения объекта и диссектором в качестве координатно-чувствительного фотоприемника.
Измерение проводят в оранжевом свете.
Микроскоп позволяет получать изображения в виде оцифрованного двумерного распределения фазы h (х,у), которая измерялась в единицах длины в реальном времени.
Метод ОСНОВАН НА периодических измерениях фазы вдоль произвольно установленного сегмента (сканлинии) в изображении объекта.
Полученная трек-диаграмма содержит информацию об изменениях локальной фазовой высоты в точках скан-линии за время измерений.
- электронный парамагнитный резонанс
ЭЛЕКТРОННЫЙ ПАРАМАГНИТНЫЙ РЕЗОНАНС - явление резонансного поглощения электромагнитного излучения парамагнитными частицами, помещенными в постоянное магнитное поле; и обусловленное квантовыми переходами между энергетическими подуровнями, связанными с наличием магнитного момента у электронных систем.
Спектроскопию ЭПР применяют при изучении структуры молекул, сод-их парамагнитные частицы, а также кинетики изменений положения частицы при модификации конформации самой молекулы или ее соседей.
В биол.объектах парамагнитными частицами явл. свободные радикалы и ионы Fe, Co, Ni, Cu, Mn.
Метод ЭПР дает возможность наблюдать их окислительно-восстановительные превращения и судить об изменении конформации включающих ее комплексов.
4. Развитие представлений о строении биомембран. Модель Зингера - Никольсона.
Наличие мембран вокруг живых клеток было установлено более ста лет назад в работах Негели К., который в 1855 г. обнаружил, что неповрежденные клетки могут изменять свой объем при изменении осмотического давления окружающей среды. Эти исследования были продолжены Овертоном Е., показавшим, что неполярные молекулы легче проходят через клеточную мембрану, чем полярные соединения.
На основе этих наблюдений он впервые высказал предположение, что клеточная мембрана имеет липидную природу. Развитие идей о структуре мембран существенно продвинулось благодаря работам Гортера Е. и Грендела Ф., проведенным в 1925 г. Эти авторы впервые выдвинули концепцию липидного бислоя. Идея возникла на основе простого эксперимента. Липиды эритроцитов экстрагировали ацетоном и затем получали из них тонкую пленку на поверхности воды.
С помощью поплавка сжимали слой липидных молекул на границе раздела вода–воздух до тех пор, пока этот слой не начинал оказывать сопротивление дальнейшему сжатию; это явление было объяснено образованием плотно упакованной мономолекулярной липидной пленки. Измерение площади, занимаемой липидами, и сравнение ее с площадью поверхности эритроцитов, из которых эти липиды были экстрагированы, дали соотношение 2:1. Отсюда был сделан вывод, что мембрана эритроцитов состоит из липидных молекул, расположенных в два слоя.
Мысль о том, что с мембранами связаны белки, высказана десятью годами позже Даниелли Дж. в связи с необходимостью объяснить явное расхождение между поверхностным натяжением на границах раздела масло–вода и мембрана–вода. Была высказана гипотеза, что мембрана состоит из двойного липидного слоя, и предположено, что белок располагается на ее поверхности – модель Даниелли–Дэвисона, или модель «сэндвича»








