Тема :Электрический ток в жидкостях. Закон электролиза.
| Класс | 10_____ |
| Дата | «_____»_____20___ |
Урок _______
Тема :Электрический ток в жидкостях. Закон электролиза.
Цель урока: Разъяснить физическую природу электропроводности жидких проводников, осуществить вывод закона электролиза в свете электронных представлений, научить учащихся применять закон при решении задач .
Задачи урока:
образовательные: формирование понятий “электролиты, электрическая диссоциация, степень диссоциации”; рассмотрение явления электролиза, вывод закона Фарадея; применение электролиза в технике.
развивающие: выделение существенных признаков явлений и отражение их в определении понятий;
- развитие умения моделировать и проводить мысленный и практический эксперимент;
- установление логической взаимосвязи наблюдаемых явлений и состояний окружающего мира;
воспитательные: формирование отношения учащихся к ценности физического знания для человека;
- воспитание понимания ценности научного (исследовательского) подхода к изучению явлений
окружающего мира;
- стремление находить объяснения наблюдаемых явлений; ;
Планируемый результат.
Метапредметные результаты.
1.сформированность познавательных интересов, направленных на развитие представлений об электрическом токе;
2.умение работать с источниками информации;
3.умение преобразовывать информацию из одной формы в другую.
Предметные результаты.
1.правильное понимание, того как протекает электролиз.
2.знание закона Фарадея.
3.применение новых знаний в новой ситуации.
УУД
Личностные. Формируются ответственное отношение к учению и коммуникативная компетентность в общении и сотрудничестве со сверстниками в процессе образовательной деятельности.
Познавательные. Выделяют и формулируют познавательную цель. Строят логические цепи рассуждений. Производят анализ и преобразование информации.
Регулятивные. Учатся определять цель своей деятельности, на основе соотнесения того, что уже усвоено, и того, что еще неизвестно, оценивать и корректировать полученный результат.
Коммуникативные. Формируются речевые умения: учатся высказывать суждения с использованием физических терминов и понятий, формулировать вопросы и ответы в ходе выполнения задания, обмениваться знаниями.
Планируемый
результат.
Метапредметные
результаты.
1.сформированность
познавательных
интересов, направленных
на развитие
представлений об
Планируемый
результат.
Метапредметные
результаты.
1.сформированность
познавательных
интересов, направленных
на развитие
представлений об
Ход урока.
1.Организационный момент.
2. Актуализация опорных знаний
1. *Эл. ток в газах – это. .
*Проводимость –
*Носители эл. заряда –
*Примеры -
3 Постановка цели деятельности
Ситуационная задача.
«Дождливый день. На остановке троллейбуса люди складывают зонтики и заходят в салон. Вот один из них поставил ногу на ступеньку и тут же отпрянул: «Ой, током бьет!» Как же ток добрался до пассажира?»
Обсуждение задачи.
Еще давно ученые заметили, что электрический ток могут проводить не только металлы, но и растворы, например, кислот, щелочей или водные растворы солей. Хотя растворы уксусной кислоты, углекислого и сернистого газа проводят его намного хуже. А вот растворы спирта, сахара и большинства других органических соединений вовсе не проводят электрический ток. Поэтому, как и твердые тела, жидкости можно разделить на три типа: полупроводники; диалектики; проводники. К проводникам можно отнести растворы и расплавы электролитов. Слово «электролит» произошло от греч. «lysis» – разрушение, растворение. Как вы думаете, что сегодня на уроке нам предстоит узнать, какие задачи решить? Сформулируйте тему урока и цели.
Электрический ток в жидкостях – это движение заряженных ионов, то есть атомов или молекул, которые по какой-либо причине потеряли или приобрели электроны. Процесс разложения молекул раствора на положительные и отрицательные заряженные ионы называется электролитической диссоциации. При разложении отрицательно заряженные ионы будут двигаться в сторону положительного источника тока (аноду), а положительные, наоборот, к отрицательному (катоду). Изучением данного вопроса долгое время занимался знаменитый английский физик Майкл Фарадей. С помощью многочисленных экспериментов ему удалось вывести законы электролиза. Сегодня на
1) Какие тела являются проводниками электрического тока?
2) Какой проводимостью обладают жидкие металлы?
Электрическая диссоциация – расщепление молекул электролита на положительные и отрицательные ионы под действием растворителя.
Вопрос: От каких параметров зависит растворимость вещества? (От температуры)
Степень диссоциации – отношение числа молекул, диссоциировавших на ионы, к общему количеству молекул данного вещества.
Рекомбинация – процесс объединения ионов разных знаков в нейтральные молекулы.
4. Изучение нового материала
На данном уроке мы рассмотрим очередную среду, пропускающую электрический ток, – жидкость. Мы рассмотрим механизм образования свободных носителей заряда в жидкости и их дальнейшего движения. Рассмотрим процесс электролиза: его законы (законы Фарадея) и его применение в технике.
Ток в жидкостях
Жидкости, как и твердые тела, могут быть проводниками, полупроводниками и диэлектриками. В этом уроке речь пойдет о жидкостях-проводниках. Причем не о жидкостях с электронной проводимостью (расплавленные металлы), а о жидкостях-проводниках второго рода (растворы и расплавы солей, кислот, оснований). Тип проводимости таких проводников – ионный.
Определение. Проводники второго рода – такие проводники, в которых при протекании тока происходят химические процессы.
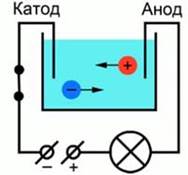 Для лучшего понимания процесса проводимости тока в жидкостях, можно представить следующий опыт: В ванну с водой поместили два электрода, подключенные к источнику тока, в цепи в качестве индикатора тока можно взять лампочку. Если замкнуть такую цепь, лампа гореть не будет, что означает отсутствие тока, а это значит, что в цепи есть разрыв, и вода сама по себе ток не проводит. Но если в ванную поместить некоторое количество
Для лучшего понимания процесса проводимости тока в жидкостях, можно представить следующий опыт: В ванну с водой поместили два электрода, подключенные к источнику тока, в цепи в качестве индикатора тока можно взять лампочку. Если замкнуть такую цепь, лампа гореть не будет, что означает отсутствие тока, а это значит, что в цепи есть разрыв, и вода сама по себе ток не проводит. Но если в ванную поместить некоторое количество 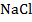 – поваренной соли – и повторить замыкание, то лампочка загорится. Это значит, что в ванной между катодом и анодом начали двигаться свободные носители заряда, в данном случае ионы (рис. 1).
– поваренной соли – и повторить замыкание, то лампочка загорится. Это значит, что в ванной между катодом и анодом начали двигаться свободные носители заряда, в данном случае ионы (рис. 1).
Рис. 1. Схема опыта
Проводимость электролитов
Откуда во втором случае берутся свободные заряды? Как было сказано в одном из предыдущих уроков, некоторые диэлектрики – полярные. Вода имеет как раз-таки полярные молекулы (рис. 2).
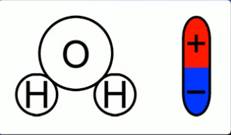
Рис. 2. Полярность молекулы воды
При внесении в воду соли молекулы воды ориентируются таким образом, что их отрицательные полюса находятся возле натрия, положительные – возле хлора. В результате взаимодействий между зарядами молекулы воды разрывают молекулы соли на пары разноименных ионов. Ион натрия имеет положительный заряд, ион хлора – отрицательный (рис. 3). Именно эти ионы и будут двигаться между электродами под действием электрического поля.
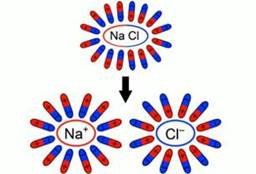
Рис. 3. Схема образования свободных ионов
При подходе ионов натрия к катоду он получает свои недостающие электроны, ионы хлора при достижении анода отдают свои.
Электролиз
Так как протекание тока в жидкостях связано с переносом вещества, при таком токе имеет место процесс электролиза.
Определение. Электролиз – процесс, связанный с окислительно-восстановительными реакциями, при которых на электродах выделяется вещество.
Вещества, которые в результате подобных расщеплений обеспечивают ионную проводимость, называются электролитами. Такое название предложил английский физик Майкл Фарадей (рис. 4).,
Электролиз позволяет получать из растворов вещества в достаточно чистом виде, поэтому его применяют для получения редких материалов, как натрий, кальций… в чистом виде. Этим занимается так называемая электролитическая металлургия.








