2. Атом элемента стремится насытить не только главные, но и побочные валентности.
3. Побочные валентности атома строго фиксированы в пространстве и определяют геометрию комплекса и его различные свойства.
В современной химии синонимом главной валентности является степень окисления элемента, а побочная валентность определяется как координационное число, то есть количество атомов непосредственно связанных с металлом при насыщении его побочной валентности.
В последнем соединении все три хлора участвуют не только в насыщении главной, но и побочных валентностей. В связи с этим в нем нет «подвижных» ионов хлора и он не способен на ионные реакции и не проводит электрический ток.
Главная валентность обусловлена, как уже упоминалось, степенью окисления кобальта (+3), то есть электростатическим притяжением трех однозарядных ионов хлора и одного трехзарядного иона кобальта. Побочная же валентность обусловлена так называемым явлением координации, которое, с современных позиций, может иметь различную природу. Те ионы, атомы, молекулы, которые координируются ионом металла называют лигандами; вместе с ионом металла они образуют так называемую внутреннюю координационную сферу. Не трудно заметить, что, несмотря на различие в строении комплексов, количество лигандов в каждом случае равно шести, однако в первом из соединений ни один из ионов хлора не является лигандом, так как не входит во внутреннюю координационную сферу, а образует так называемую внешнюю сферу противоионов, которая для последнего из соединений в ряду полностью отсутствует.
Ионы, не входящие во внутреннюю координационную сферу, при растворении комплекса обуславливают его электропроводность. В соответствии с этим диссоциацию комплексов можно записать так:
[Co(NH3)6]Cl3 ↔ [Co(NH3)6]3+ + 3Cl-
[Co(NH3)5Cl]Cl2 ↔ [Co(NH3)5Cl]2+ + 2Cl-
[Co(NH3)4Cl2]Cl ↔ [Co(NH3)4Cl2]+ + Cl-
[Ir(NH3)3Cl3] – не диссоциирует
Таким образом, первые два тезиса теории Вернера закрывают вопросы 1 – 3. Остановимся подробнее на третьем тезисе теории Вернера, а именно на том, что побочные валентности фиксированы в пространстве и определяют геометрию комплекса и его стереохимию.
При координационном числе 6, возможны три способа расположения шести точек в пространстве, относительно центра координации – то есть атома металла. Это правильный шестиугольник, правильный (или искаженный) октаэдр и центрированная правильная трехгранная призма.
Во времена Вернера рентгено-струкутрный анализ еще не был разработан, как метод определения пространственной структуры соединений, поэтому был использован следующий «остроумный» способ определения геометрии комплексов. Он состоял в сравнении количества реально существующих изомеров комплекса (полученных при всевозможных вариациях условий синтеза) с теоретически найденным числом изомеров, возможных только исходя из предполагаемой геометрической модели. При этом варьировалось также количество различных по типу лигандов, которые мы назовем X и Y.
Комплексное соединение– химическое вещество, в состав которого входят комплексные частицы. В настоящее время строгого определения понятия " комплексная частица" нет. Обычно используется следующее определение.
Комплексная частица – сложная частица, способная к самостоятельному существованию в кристалле или растворе, образованная из других, более простых частиц, также способных к самостоятельному существованию.
Например, гидратированный ион меди [Cu(H2O)4]2+ – комплексная частица, так как она реально существует в растворах и некоторых кристаллогидратах, образована из ионов Cu2+ и молекул H2O, молекулы воды – реально существующие молекулы, а ионы Cu2+ существуют в кристаллах многих соединений меди. Напротив, ион SO42- не является комплексной частицей, так как, хоть ионы O2- в кристаллах встречаются, ион S6+ в химических системах не существует.
Примеры других комплексных частиц: [Zn(OH)4]2-, [Al(H2O)6]3+, [Cu(H2O)2Br2], [HgI4]2- .
Вместе с тем к комплексным частицам относят ионы NH4+ и H3O+, хотя ионы H+ в химических системах не существуют.
Иногда комплексными частицами называют сложные химические частицы, все или часть связей в которых образованы по донорно-акцепторному механизму. В большинстве комплексных частиц так и есть, но, например, в алюмокалиевых квасцах [K(H2O)6][Al(H2O)6]SO4 в комплексной частице [Al(H2O)6]3+ связь между атомами Al и O действительно образована по донорно-акцепторному механизму, а в комплексной частице [K(H2O)6]+ имеется лишь электростатическое (ион-дипольное) взаимодействие. Подтверждение этого – существование в железоаммонийных квасцах аналогичной по строению комплексной частицы [NH4(H2O)6]+, в которой между молекулами воды и ионом NH4+ возможно только ион-дипольное взаимодействие.
По заряду комплексные частицы могут быть катионами, анионами, а также нейтральными молекулами. Комплексные соединения, включающие такие частицы, могут относиться к различным классам химических веществ (кислотам, основаниям, солям). Примеры: (H3O)[AuCl4] – кислота, [Ag(NH3)2]OH – основание, NH4Cl и K3[Fe(CN)6] – соли.
Комплексообразователь– центральный атом комплексной частицы.
Обычно комплексообразователь – атом элемента, образующего металл, но это может быть и атом кислорода, азота, серы, йода и других элементов, образующих неметаллы. Степень окисления комплексообразователя может быть положительной, отрицательной или равной нулю; при образовании комплексного соединения из более простых веществ она не меняется.
Лиганды– атомы или изолированные группы атомов, располагающиеся вокруг комплексообразователя.
Лигандами могут быть частицы, до образования комплексного соединения представлявшие собой молекулы (H2O, CO, NH3 и др.), анионы (OH , Cl , PO43 и др.), а также катион водорода. Различают унидентатные или монодентатные лиганды (связанные с центральным атомом через один из своих атомов, то есть, одной -связью), бидентатные(связанные с центральным атомом через два своих атома, то есть, двумя связями), тридентатные и т. д.
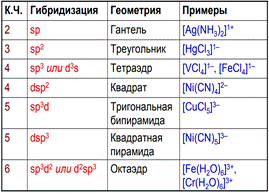
Координационное число (КЧ) – число связей, образуемых центральным атомом с лигандами.
Если лиганды унидентатные, то координационное число равно числу таких лигандов.
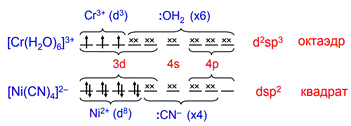
КЧ зависит от электронного строения центрального атома, от его степени окисления, размеров центрального атома и лигандов, условий образования комплексного соединения, температуры и других факторов. КЧ может принимать значения от 2 до 12. Чаще всего оно равно шести, несколько реже – четырем.
Существуют комплексные частицы и с несколькими центральными атомами.
Внутренняя сфера комплексного соединения – центральный атом со связанными с ним лигандами, то есть, собственно комплексная частица.
Внешняя сфера комплексного соединения – остальные частицы, связанные с комплексной частицей ионной или межмолекулярными связями, включая водородные.
Наиболее часто встречаются комплексы с координационными числами 4 и 6. Расположение лигандов в таких комплексах квадратно-плоскостное (КЧ = 4), тетраэдрическое (КЧ = 4) и октаэдрическое (КЧ = 6) соответственно
Существуют лиганды, которые занимают не оно, а два и более координационных мест. Число связей, образуемых лигандом с комплексообразователем называют координационной емкостью или дентатностью лиганда. Монодентатные лиганды образуют только одну связь с комплексообразователем и занимают одно координационное место (H2O, OH–, NH3, CN–, Cl– и т.д.). Бидентатные лиганды образуют две связи с комплексообразователем и занимают два координационных места (например, диметилглиоксим). Существуют тридентатные, тетрадентатные и т.д. лиганды.Заряды комплексных ионов равны алгебраической сумме зарядов комплексообразователя и лигандов. Заряд [Fe(CN)6]4– определяется по сумме зарядов ионов: (2+) + (6–) = 4–.
Если в молекуле в качестве лиганда имеются нейтральные молекулы, их присутствие не отражается на заряде комплекса. Например, заряд иона [Cu(NH3)4]2+ является равным заряду Сu2+иона, т. е. комплексообразователя.
Заряд комплекса можно также определить по составу внешней сферы, после чего, найдя заряд комплексного иона, легко определить степень окисления комплексообразователя. Например, в соединении K4[Fe(CN)6] заряд внешней сферы равен 4+, следовательно, внутренняя сфера имеет заряд 4–.Соединение в целом электронейтрально. Заряд иона CN– равен –1, во внутренней сфере имеется 6 ионов CN–, следовательно комплексообразователь должен иметь заряд, равный 2+.
Используются два вида структурных формул комплексных частиц: с указанием формального заряда центрального атома и лигандов, или с указанием формального заряда всей комплексной частицы.
Для характеристики формы комплексной частицы используется представление о координационном полиэдре (многограннике).
Координационный полиэдр – воображаемый многогранник, в центре которого расположен атом-комплексообразователь, а в вершинах – атомы лигандов, непосредственно связанные с комплексообразователем.
К координационным полиэдрам относят также квадрат (КЧ = 4), треугольник (КЧ = 3) и гантель (КЧ = 2), хотя эти фигуры и не являются многогранниками.
Дентатность лигандов
Чаще всего лиганд бывает связан с комплексообразователем через один из своих атомов одной двухцентровой химической связью. Такого рода лиганды получили название монодентатных. К числу монодентатных лигандов относятся все галогенид-ионы, цианид-ион, аммиак, вода и другие.
Некоторые распространенные лиганды типа молекул воды H2O, гидроксид-иона OH, тиоцианат-иона NCS, амид-иона NH2, монооксида углерода CO в комплексах преимущественно монодентатны, хотя в отдельных случаях (в мостиковых структурах) становятся бидентатными.
Существует целый ряд лигандов, которые в комплексах являются практически всегда бидентатными. Это этилендиамин, карбонат-ион, оксалат-ион и т.п. Каждая молекула или ион бидентатного лиганда образует с комплексообразователем две химические связи в соответствии с особенностями своего строения:
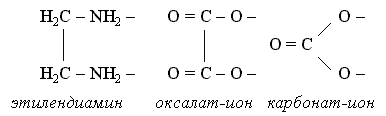
Двойные соли
Двойными солями называются комплексные соединения с неустойчивой внутренней сферой. К ним относятся в основном комплексные соединения амфотерных элементов. В отличие от обычных комплексных соединений двойные соли в водных растворах дисоциируют нацело. Наряду с незначительной концентрацией комплексного иона в растворе содержатся все продукты его полной диссоциации.
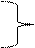
K2SO4 Al2(SO4)3
K[AL2(SO4)3]= 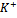 +
+ 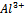 +SO
+SO 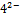 дисульфаталлюминат калия
дисульфаталлюминат калия
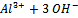 =Al(OH)3
=Al(OH)3
SO 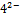 +
+ 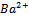 =BaSO4 доказательство
=BaSO4 доказательство
3 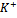 +[Co(NO2)6]
+[Co(NO2)6] 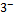 =K3[Co(NO2)6]
=K3[Co(NO2)6]
[Fe(CN)6] 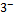 +OH
+OH 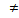
Аналитически в растворе КС практически не содержатся продукты диссоциации коплекс-иона и аналитически обнаружить ионы Fe3+ и CN3- невозможно, а в растворе ДС обнаружены как внутренние, так и внешние сферы с помощью качественных реакций.
7) Классификация и номенклатура комплексных соединений.
Классификация комплексных соединений проводится по различным признакам.
По заряду комплексного иона различают:
катионные - [Cu(NH3)4](2)
анионные - [Co(NO3)6](3-)
нейтральные - [Pt(NH3)Cl2](0)
По характеру лигандов различают:
акво- [Сu(H2O)4]SO4
аммино-[Cu(NH3)4]SO4
ацидо- К2[Cu(Cl)4]
гидроксо-K2[Cu(OH)4]
По структуре внутренней сферы различают внутрикомплексные(циклические) соединения. Например, в живом организме встречаются клешневидные (хелатные) пятичленные циклы. Они образуются катионом металла и ɑ-аминокислотами. К ним относятся гемоглобин, хлорофилл, витамин В12.
При составлении названия комплексных соединений руководствуются следующими правилами:
Сначала называют внутреннюю сферу.
Составные части её называют в следующей последовательности: лиганды анионы, лиганды – молекулы, комплексообразователь. Записывают формулу в обратной последовательности.
К названиям лигандов – ионов добавляют окончание «о» (Сl—хлоро-, СN—циано-). Нейтральные молекулы сохраняют свои названия, за исключением Н2О – акво, NН3 – амин.
Число лигандов указывают греческими числительными: ди, три-, тетра-, пента-, гекса- и т.д.
В последнюю очередь называют ионы внешней сферы.
Пример: катионные –[Cu(NH3)4 ]SO4 – тетраамминокупрат (II) сульфат; анионные – Na3[Co(NO2)6] –гексанитрокобольтат (III) натрия; нейтральные [Pt(NH3)]Cl2 - дихлородиамминоплатина.
8) Строение комплексных соединений с позиций МВС.
Донорно -акцепторное взаимодействие между - центральным атомом (акцептор ) - лигандами (доноры )
1) Все связи 2c–2e –
2) Принимается гибридизация орбиталей d-металла
По уровню участвующих в гибридизации орбиталей различают комплексы внешнеорбитальные и внутриорбитальные
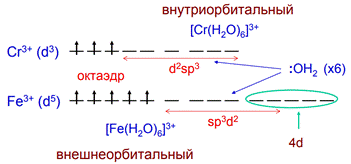
Внутриорбитальный = низкоспиновый = ковалентный
Внешнеорбитальный = высокоспиновый = ионный
Но: слишком велико различие в энергии 3d
и 4d орбиталей
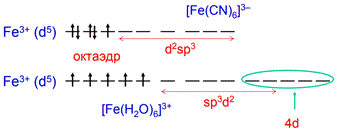
Комплексы внутриорбитальные, одинаковая электронность 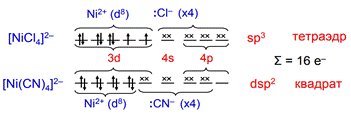
Ограничения МВС:
МВС– очень наглядный метод, объясняет
геометрическое строение известных комплексов
Но:
1. Не имеет предсказательной силы
2. Описывает магнитные свойства комплексов только
в простейших случаях
3. Не объясняет окраску комплексов
4. Не объясняет причину различной устойчивости
комплексов
5. Не имеет энергетических параметров
9) Свойства комплексных соединений, их диссоциация в растворе. Константа нестойкости, константа устойчивости. Разрушение комплексных соединений.
В растворах комплексные соединения могут подвергаться первичной и вторичной диссоциации.
Первичная диссоциация комплексного соединения - это его распад на комплексный ион, образованный внутренней сферой и ионы внешней сферы. В водных растворах первичная диссоциация комплексных соединений обусловлена разрывом ионной связи между внутренней и внешней сферами, она практически необратима:
K3[Fe(CN)6] 3K(+) + [Fe(CN)6](3–)
Na[Al(OH)4] Na(+) + [Al(OH)4](–)
[Cu(NH3)4]SO4 [Cu(NH3)4](2+) + SO4(2–)
[Pt(NH3)4Cl2]Cl2 [Pt(NH3)4Cl2](2+) + 2Cl(–)
Образующийся комплексный ион ведет себя как целая самостоятельная частица с характерными для нее свойствами. Поэтому в водных растворах комплексных соединений, как правило, нельзя обнаружить присутствие ионов или молекул, входящих в состав внутренней сферы. В растворе красной кровяной соли нельзя обнаружить присутствие ионов Fe(3+) и CN(–), а в 1М растворе хлорида дихлоротетраамминплатины(IV) [Pt(NH3)4Cl2]Cl2 обнаруживается только присутствие 2 моль хлорид-ионов, а не 4 моль.
Но насколько устойчива внутренняя сфера комплекса? Может ли происходить отщепление лигандов от комплексообразователя? Действительно, это возможный процесс, он называется вторичной диссоциацией комплексного соединения.
Вторичная диссоциация комплексного соединения – это распад внутренней сферы комплекса на составляющие ее компоненты.
Так как при этом разрушаются не ионные, а ковалентные связи комплексообразователя с лигандами, этот процесс затруднен и обратим. Он происходит ступенчато:
[Ag(NH3)2](+) ? [Ag(NH3)](+) + NH3 1-ая ступень
[Ag(NH3)](+) ? Ag(+) + NH3 2-ая ступень
Вторичная диссоциация характеризуется константой равновесия, причем для каждой из стадий можно вычислить свою константу. Для количественной оценки устойчивости внутренней сферы комплексного соединения используют константу равновесия, описывающую полную ее диссоциацию. Эту константу называют константой нестойкости комплекса Кнест. В соответствии с законом действующих масс для приведенного нами выше примера диссоциации иона диамминсеребра выражение для константы нестойкости принимает вид:
Чем ниже Kнест, тем прочнее и стабильнее внутренняя сфера комплексного соединения, тем в меньшей мере происходит вторичная диссоциация комплексного соединения в растворе.
Диссоциация комплекса идет лишь в незначительной степени и может быть охарактеризована величиной общей константы ионизации данного комплекса, которая определяется как произведение констант диссоциации по отдельным ступеням. Так, в данном примере
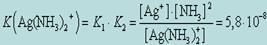
Чем больше величина этой константы, тем сильнее комплекс диссоциирует, тем менее он устойчив. Эта константа называется константой нестойкости. Обратная величина константы нестойкости называется константой устойчивости
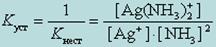
Константы нестойкости для различных комплексных ионов различны и могут служить мерой устойчивости комплекса.
Способы разрушения комплексных соединений:
1. Нагревание:
[Ag(NH3)2]NO3 2 NH3↑ + Ag NO3
2. Образование более прочного комплекса:
[Ag(NH3)2]NO3 + 2NaCN = Na[Ag(CN)2] + NaNO3 + 2NH3
Кн = 6,810–8Кн = 110–21
3.Окислительно-восстановительные процессы:
Окисление
2K2[Ni(CN)4] + Br2 + 6KOH = 2Ni(OH)3 + 8KCN + 2KBr
Ni(+2) – 1ē = Ni(+3)
Восстановление
Zn + 2K[Au(CN)2] = 2Au + K2[Zn(CN)4]
(Au(+1)+ 1ē = Au
4. Связывание комплексообразователя:
[Ag(NH3)2]NO3 + KI = AgI↓ + 2 NH3↑ + KNO3
Связывание лигандов:
Na[Al(OH)4] + 4HCl = 4H2O + NaCl + AlCl3
10) Свойство комплексных соединений –изомерия ( приведите примеры).
Изомеры-вещества, имеющие одинаковый состав, но разно строение и свойства.
Полимеры- соединения с относительной молекулярной массой кратной отношению молекулярной массе некоторого простого соединения того же состава.
[PtCl2(NH3)2] мономер
[Pt(NH3)4][PtCl4] полимер
1.Гидратная изомерия отличается количеством воды во внутренней и внешней сферах:
CrCl*6H2O [Cr(H2O)6]Cl3
[Cr(H2O)5]Cl2*H2O
[Cr(H2O)4]Cl2*2H2O
2.Ионизационная изомерия – изомеры отличаются друг от друга тем, что ионы внешней сферы имеют свои металлы с лигандами.
[Co(NH3)5Br]SO4 [Co(NH3)5SO4]Br
3.Координационная изомерия – составные части КС одинаково распределены по координационным сферам.
[Co(NH3)6][Cr(CN)6] [Cr (NH3)6][Co(CN)6]
4.Геометрическая
Вызвана неодинаковым размещением лигандов во внутренней сфере относительно друг друга.Необходимое условие - наличие во внутренней координационной сфере не менее двух различных лигандов. Проявляется у комплексных соединений, имеющих октаэдрическое строение , строение плоского квадрата или квадратной пирамиды.
Если одинаковые лиганды находятся по одну сторону от комплексообразователя, то образуется цис-изомер, а если по разные стороны, - образуется транс-изомер.
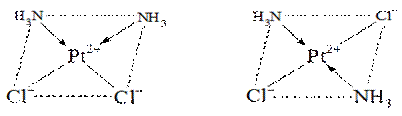
цис-изомер транс-изомер
Оптическая изомерия связана со способностью некоторых комплексных соединений существовать в виде двух форм, не совмещаемых в трёхмерном пространстве и являющихся зеркальным отображением друг друга. Её иногда называют зеркальной.
5. Оптическая изомерия.
Оптическая изомерия возникает у комплексных соединений, структуры внутренних сфер которых не совмещаются в трехмерном пространстве и являются как бы зеркальным отображением друг друга. Оптическая изомерия комплексных соединений возможна только тогда, когда внутренняя сфера не имеет ни одной плоскости симметрии, т.е. плоскости, которая разделила бы ее на две одинаковые части.
6. Сольватная изомерия.
Причиной возникновения сольватной изомерии является неодинаковое распределение молекул растворителя между внутренней и внешней сферами.
Например, для хлорида гексааквахрома (III) известны 3 изомера:
[Cr(H2O)6]Cl3 (кристаллы серо-сиреневого цвета);
[Cr(H2O)5Cl]Cl2×H2O (кристаллы светло-зеленого цвета);
[Cr(H2O)4Cl2]Cl×2H2O (кристаллы изумрудно-зеленого цвета).
Доказательством существования этих форм является то, что раствор нитрата серебра в первом случае осаждает все ионы хлора, во втором - ⅔, а в третьем - ⅓ часть хлора.
При высушивании гидраты теряют только ту воду, которая находится во внешней сфере.
11) Строение комплексных соединений с позиций ТКП.
Теория кристаллического поля основывается на допущении, что связь между комплексообразователем и лигандами частично ионная. Однако принимается во внимание влияние электростатического поля лигандов на энергетическое состояние электронов центрального иона.
Рассмотрим две комплексные соли: K2[Zn(CN)4] и K3[Fe(CN)6].
K2[Zn(CN)4] – имеет тетраэдрическую пространственную структуру (sp3— гибридизация)
K3[Fe(CN)6] – имеет октаэдрическую пространственную структуру (sp3d2-гибридизация)
Комплексообразователи имеют следующую электронную конфигурацию:

d – электроны одного и того же энергетического уровня одинаковы в случае свободного атома или иона. Но действие электростатического поля лигандов способствует расщеплению энергетических уровней d – орбиталей в центральном ионе. И расщепление тем больше (при одном и том же комплексообразователе), чем сильнее поле, создаваемое лигандами. По своей способности вызывать расщепление энергетических уровней лиганды располагаются в ряд:
CN— > NO2— > NH3 > SCN— > H2O > OH— > F— > Cl— > Br— > I—
Строение комплексного иона влияет на характер расщепления энергетических уровней комплексообразователя.
Энергию расщепления Δ определяют экспериментально по спектрам поглощения веществом квантов света, энергия которых равна энергии соответствующих электронных переходов. Спектр поглощения, а также и окраска комплексных соединений d-элементов, обусловлены переходом электронов с d-орбитали низшей энергии на d-орбиталь с более высокой энергией.
12)
13) Соединения железа в с.о. +2, +3: оксиды, гидроксиды, соли, роль соединений в ОВ - реакциях. Качественные реакции на ионы железа.
1)FeO – оксид железа(II), черный; Fe(OH)2 — гидроксид железа(II), белый; проявляют основные свойства;
2) Fe2О3 — оксид железа(III), красно-бурый; Fe(OH)3 – гидроксид железа(III), бурый; проявляют амфотерные свойства.
Химические свойства
1. Растворимые соли ионов железа Fe(2+) и Fe(3+) реагируют с растворами щелочей при комнатной температуре:
FeSO4 +2NaOH = Fe(OH)2 + Na2SO4 белый, зеленеет
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCL бурый
2. Гидроксид и оксид железа(II) вступают в реакцию с кислотами:
Fe(OH)2 + 2HC1 = FeCl2 + 2H2O, FeO + H2SO4 = FeSO4 + H2O
Гидроксид железа(III) амфотерен, т.е. вступает в реакции с кислотами и концентрированными растворами щелочей:
Fe(OH)3 + 3HCl = FeCl3 +3H2O, Fe(OH)3 + 3NaOH = Na3[Fe(OH)6].
Оксид железа(III) реагирует с кислотами и с основными оксидами:
Fe2O3 + 6HСl = 2FeCl3 + 3H2O
3. Гидроксиды железа(ІІ) и (ІІІ) разлагаются при нагревании:
Fe(OH)2 = FeO+H2O 2Fe(OH)3 = Fe2O3+3H2O
4. Катионы железа(II) легко окисляются кислородом воздуха или другими окислителями до катионов железа(III). Поэтому белый осадок гидроксида железа(II) на воздухе сначала приобретает зеленую окраску, а затем становится бурым, превращаясь в гидроксид железа(III):
4Fe(OH)2+2 H2O+O2 = 4 Fe(OH)3
1)4FeCl3 + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3+ 12KCl.
Это качественная реакция нa ионы Fe(3+)
2) 3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN)6]2+ 3K2SO4.
Это качественная реакция на ионы Fe(2+)
Получение:
FeSO4 + 2KOH → Fe(OH)2 (осадок) + K2SO4
2) Осаждение из раствора солей железа(III) гидрата Fe2O3 · nH2O и его частичное обезвоживание.
В природе — оксидная руда железа лимонит Fe2O3 · nH2O и минерал гётит FeO(OH).
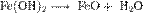
14. Соединения кобальта в с.о. +2, +3: оксиды, гидроксиды, соли, роль соединений в ОВ-реакциях.
Основание Со(ОН)2 — слабое, трудно окисляется кислородом воздуха:
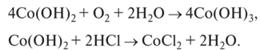
Соединения Со203 и Со(ОН)3 — сильные окислители:
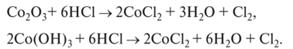
Кобальт образует большое количество комплексных соединений. Наиболее устойчивы комплексные соединения кобальта (III).
Оксиды обладают слабовыраженными амфотерными свойствами с преобладанием основных. Практически не растворяются в воде, реагируют с кислотами с образованием солей, например:
CoO + 2HCl = CoCl2 + H2O.
Растворяются в расплавах щелочей, а при доступе воздуха – в водном растворе аммиака:
CoO + Ba(OH)2 = BaCoO2 + H2O.
Гидроксиды практически не растворимы в воде, проявляют в основном основные свойства. Реагируют с кислотами, например:
Co(OH)2 + 2HCl = CoCl2 + 2H2O.
Растворяются в водных растворах аммиака с образованием аммиачных комплексов, например:
Co(OH)2 + 6NH3 = [Co(NH3)6](OH)2.
Гидроксид кобальта растворяется в концентрированных растворах щелочей с образованием гексагидроксокобальтата (II) натрия, что свидетельствует о проявлении слабовыраженных кислотных свойств:
Co(OH)2 + 4NaOH = Na4[Co(OH)6].
При нагревании гидроксиды разлагаются, например:
Co(OH)2 = CoO + H2O.
Аналогично гидроксиду железа (II), гидроксид кобальта (II) медленно окисляется кислородом воздуха:
4Сo(OH)2 + O2 + 2H2O = 4Co(OH)3.
Кобальт (II) образует соли практически со всеми анионами. Обычно соли кристаллизуются в виде розовых или красных кристаллогидратов: Co(NO3)2·6H2O, CoSO4·7H2O, CoCl2·6H2O и др. Растворы солей имеют ярко-розовую окраску, характерную для аквакомплексов кобальта (II).
15. Соединения никеля в с.о. +2, +3: оксиды, гидроксиды, соли, роль соединений в ОВ- реакциях.
Оксиды обладают слабовыраженными амфотерными свойствами с преобладанием основных. Практически не растворяются в воде, реагируют с кислотами с образованием солей, например:
NiO+ 2HCl = NiCl2 + H2O.
Растворяются в расплавах щелочей, а при доступе воздуха – в водном растворе аммиака:
NiO + Ba(OH)2 = BaNiO2 + H2O.
Гидроксиды практически не растворимы в воде, проявляют в основном основные свойства. Реагируют с кислотами, например:
Ni(OH)2 + 2HCl = NiCl2 + 2H2O.
Растворяются в водных растворах аммиака с образованием аммиачных комплексов, например:
Ni(OH)2 + 6NH3 = [Ni(NH3)6](OH)2.
При нагревании гидроксиды разлагаются, например:
Ni(OH)2 = NiO + H2O.
Гидроксид никеля (II) на воздухе устойчив.
Никель (II) также образует большое количество солей. Обычно соли кристаллизуются в виде зеленых кристаллогидратов (различных оттенков): Ni(NO3)2·6H2O, NiSO4·6H2O, Fe(ClO4)2·6H2O, K2Ni(SO4)2·6H2O и др. Растворы солей имеют ярко-зеленую окраску, характерную для аквакомплексов никеля (II).
16. Соединения марганца в с.о. +2: оксид, гидроксид, соли, роль соединений в ОВ- реакциях, зависимость глубины окисления от силы окислителя и реакции среды.
Mn образует основной оксид переменного состава – MnO - MnO1,5, гидроксид - Mn(OH)2
Оксид Mn (II) образуется при прокаливании карбоната марганца в атмосфере азота или водорода:
MnСО3 = MnO +СО2.
Так как гидроксид марганца нерастворим в воде, его получают косвенным путем:
Mn2++ 2OH¯= Mn(OH)2
Он легко растворяется в кислотах, со щелочами реагирует только при сильном и длительном нагревании:
Mn(OH)2+ 2H+ = Mn2+ + 2H2O
Mn(OH)2 + 4OH ¯(конц.) = [Mn (ОН)6] 4 –
Гидроксид в степени окисления +2 неустойчив и окисляется на воздухе, значительно легче идет окисление галогенами:
Mn(ОН)2 + Br2 + 2NaOH→ MnO2 + 2 NaBr +2H2O
В зависимости от силы окислителя и рН среды ион Mn2+ может окисляться до степеней окисления +4, +6 и +7:
3MnSO4 + 2KMnO4 +3H2O = 5MnO2↓ + K2SO4 + 3H2SO4
3MnSO4 + 2KС1O3 + 12KOH сплав 3K2MnO4 +3K2SO4 + 2KCI + 6H2O
2Mn(NO3)2 + 5NaBiO3 + 16HNO3 → 2HMnO4+ 5Bi(NO3)3+ 5NaNO3 + 7H2O
Последняя реакция используется в аналитической химии как качественная реакция на соединения марганца.
Из комплексных соединений Mn2+ устойчивы только цианиды, остальные манганаты (II) в разбавленных водных растворах распадаются.
17. Соединения марганца в c.о. +4: роль соединений в ОВ- реакциях, зависимость глубины окисления от силы окислителя и реакции среды.
Наиболее устойчивым соединением марганца в степени окисления +4 является MnO2-черно-бурое твердое вещество, обычно переменного состава, оно широко распространено в земной коре. Кристаллы MnО2 построены по типу кристаллов рутила. При обычных температурах MnО2 в воде не растворяется и довольно инертен - без нагревания устойчив к действию большинства кислот. По химической природе оксид марганца (IV ) – амфотерен. При сплавлении со щелочами или основными оксидами образуются оксоманганаты (IV):
MnО2 + СаО = Са MnО4.
Соединения Mn(IV) сильные окислители:
MnO2 + 4HCl = MnCl2 + Cl2↑ + 2H2O
При этом аквакомплексы не образуются. При взаимодействии с горячей серной или азотной кислотой диоксид марганца разлагается с выделение кислорода. В качестве дешевого окислителя диоксид марганца широко используется в технике и лабораторной практике.
При взаимодействии MnО2 с наиболее сильными окислителями проявляет восстановительные свойства, образуются производные марганца (VI) и (VII), например
3MnO2 + КС1О3+6KOH сплав 3K2MnO4 + КС1 + 3H2O
2MnО2 + 3PbO2 + 6HNO3 → 2НMnO4 +3Pb(NO3)2 + 2H2O
18. Соединения марганца в с.о. +7: оксид, гидроксид, соли, роль соединений в ОВ- реакциях, зависимость глубины окисления от силы окислителя и реакции среды.
Оксид Mn (VII) можно получить по реакции:
2KMnO4 (тверд.) + Н2 SO4 → Mn2O7 + К2 SO4 + Н2О.
Оксидам Э(VII) соответствуют кислоты НЭO4 , которые существуют в растворе. Кислотам отвечают соли КЭO4, большинство из которых растворимы в воде.
KMnO4 легко разлагается при нагревании: 2KMnO4 → K2MnO4 + MnO2 +О2.
Соединения Mn(VII) являются сильными окислителями. Глубина восстановления перманганата зависит от реакции среды и силы восстановителя, наиболее сильным окислителем он является в кислой среде.
5Na2SO3 + 2KMnO4 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + 3H2O
3 Na2SO3 + 2KMnO4 + H2O = 2MnO2↓ + 3Na2SO4 + 2KOH
Na2SO3 + 2KMnO4 + 2КOН → 2K2MnO4+ Na2SO4 + H2O
19. Соединения хрома в степени окисления +3: оксид, гидроксид, доказать их кислотно-основные свойства, соли, роль в ОВ реакциях.
Для хрома степень окисления +3 является наиболее устойчивой. Координационное число хрома (111) равно шести, его комплексы имеют структуру октаэдра. Оксид хрома (III) –химически устойчивый, нерастворимый в воде и кислотах зеленый порошок. Он тугоплавок, твердоссть его кристаллов соизмерима с твердостью корунда. Оксид хрома (111) можно получить по следующим реакциям:
Na2Cr2O7 + 2C tº Cr2O3 + Na2CO3 + CO
(NH4)2Cr2O7 tº Cr2O3 + N2 + 4H2O
Амфотерная природа Сr2О3 проявляется при сплавлении со щелочами и пиросульфатом калия:
Cr2O3 + 2NaОНà 2 NaCrO2 + Н2O
Cr2O3 + 3 K2S2O3 à(tº) Cr2(SO4)3 + 3K2SO4
K2S2O3à K2SO4 + SO3
Cr2O3 + 3SO3 à(tº) Cr2 (SO4)3
Оксиду Cr2O3 соответствует гидроксид хром [Cr(OH)3] n – это многоядерный слоистый полимер серо-зеленого цвета, в котором роль лигандов играют ионы гидроксила и молекулы воды, а роль мостиков - группы ОН-. Его состав и структура зависят от условий получения. При старении и, особенно при нагревании, гидроксид хрома. Свежеосажденный гидроксид хрома хорошо растворяется в кислотах и щелочах, которые вызывают разрыв связей в слоистом полимере:
Cr(OH)3 + 3HCl + 3 H2O = [Cr(H2O)6]Cl3
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Для солей хрома характерна гидратная изомерия, в зависимости от числа моль воды во внутренней сфере они окрашены в разные цвета, например,
[Cr(H2O)5Cl]Cl2-светло-зеленый
[Cr(H2O)4Cl2]Cl·2H2O – темно – зеленый
[Cr(H2O)6]Cl3 –фиолетовый
Соли хрома легко подвергаются гидролизу:
CrCl3 + H2O CrOHCl2 + НCl
2 CrCl3 + 3Na2СO3 +3H2O = 2Cr (OH)3 + 3CO2 + 6NaCl
Хром (III) весьма склонен к образованию комплексов как анионного, так и катионного типа, координационное число равно шести, что соответствует d2sp3 – гибридизации.
Соединения Сr3+ являются восстановителями:
2CrCl3 + 3H2O2 + 10 NaOHà 2NaCrO4 + 6 NaCl + 8H2O
2 Na3[Cr(OH)6] +6Br2 +4NaОН = Na2CrO4 +6NaBr +8Н2О
20. Соединения хрома в с.о. +6: оксид, гидроксиды, соли, роль соединений в ОВ-реакциях.
Соединения хрома в степени окисления +6 многочисленны.
CrO3 получают по реакции:
K2Cr2O7 (тверд.) + H2SO4 (к) = K2SO4 + 2СrО3 + H2O.
Триоксиды – кристаллические вещества CrO3 – темно-красный
CrO3 имеет цепочечную структуру, образованную тетраэдрами CrO4. При нагревании CrO3 довольно легко разлагается с выделением кислорода:
4CrO3 2Cr2O3 + 3O2↑
Со многими окисляющимися веществами CrO3 взаимодействует со взрывом.
CrO3 – ядовит!
CrO3 легко растворяется в воде, образуя хромовую кислоту:
CrO3 + Н2О = Н2CrO4
Хромовая кислота в свободном виде не выделена, она существует только в водном растворе.
Способность к полимеризации у иона CrO4 2- выражена менее отчетливо, тем не менее известны, например, дихромат-K2Cr2O7, трихромат - K2Cr3O10. Полихроматы образуются при действии кислот на хроматы, при этом желтая окраска хроматов изменяется на оранжевую.
2H+ + 2CrO42- ↔ Cr2O72- + H2O.
В результате дальнейшего подкисления раствора концентрированной кислотой при охлаждении выделяются темно- красные кристаллы CrO3:
K2Cr2O7 + H2SO4 = 2CrO3 + K2SO4 + H2O.
Если же на растворы полихроматов действовать щелочью, процесс идет в обратном направлении:
Cr2O72- + 2 OH¯ = 2CrO42- + H2O.
Из оксохроматов наибольшее значение имеют соли натрия и калия, которые получают сплавлением Cr2O3 с соответствующими карбонатами на воздухе при 1000-13000С.
Cr2O3 + 2Na2CO3 + 3O2 = 2Na2CrO4 + 2CO2.
Все соли, содержащие Сr (VI), являются сильными окислителями. В кислой среде образуются производные катионного комплекса [Cr(H2O)6]3-:
K2Cr2O7 +3Na2SO4 +4H2SO4 =Cr2(SO4)3 + 3Na2SO4 + K2SO4 +4H2O
В нейтральной среде образуется гидроксид хрома (lll) :
3(NH4)2S + K2Cr2O7 + 7H2O = 2Cr(OH)3↓ + 6 NH4ОН + 3S↓ + 2KOH
В щелочной – производные комплекса [Cr(OH)6]3-:
3(NH4)2S + K2Cr2O7 + 4 KOH + 7H2O = 2K3[Cr(OH)6] + 3S↓ + 6NH4ОН
Наибольшая окислительная активность соединений Сr6+ проявляется в кислой среде.
21. Соединения меди в с.о.+1, +2, +3: оксиды, гидроксиды, соли, роль соединений в ОВ- реакциях.
Степень окисления +1
4CuCl + O2 +6 HCl = 4CuCl2 + 2H2O
Гидроксиды ЭОН неустойчивы, являются слабыми основаниями!
Аммиачные комплексы значительно более устойчивы и по силе приближаются к щелочам
Степень окисления +2
Cu(OH)2 + 2H+ = Cu 2+ + 2H2O
Cu(OH)2 + 2 OH- (конц.) = [Cu(OH)4 ] 2-
Cu(II) в ОВР проявляют как окислительные, так и восстановительные свойства:
2Cu(OH)2 + NaClO + 2NaOH = 2NaCuO2 + NaCl + 3H2O
2CuCl2 + 4 KI → 2Cu2I2 + I2 + 4KCl
Комплексные соединения Cu (+2)
• CuSO4 + 5H2O = [Cu(H2O)4]SO4 *H2O
• CuSO4 + 4NH3 (конц.) = [Cu(NH3)4]SO4
Степень окисления +3
Соединения Cu(III) – куприты – неустойчивы, существуют только в сильно щелочных растворах: 4NaCuO2 + 12HCl = 4NaCl + 4CuCl2 + 6H2O + O2
Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
Оксид меди(III) не получен. Под этим названием описаны различные купраты(III).
Гексафторкупраты(III) и (IV) получают действием фтора на соли меди и щелочных металлов при нагревании под давлением. Они бурно реагируют с водой и являются сильными окислителями.
Комплексы меди(III) с ортопериодатами и теллуратами относительно стабильны и предложены как окислители в аналитической химии. Описано много комплексов меди(III) с аминокислотами и пептидами.
22. Соединения цинка, кадмия и ртути в с.о. +2: оксиды, гидроксиды, соли, роль соединений в ртути ОВ- реакциях.
Получение:
Гидроэлектрометаллургический:
окисление: 2ZnS + 3O2 = 2ZnO + 2SO2↑
обработка H2SO4 (р): ZnS + H2SO4 = ZnSO4 + H2O
электролиз раствора ZnSO4: K(–) Zn2+ + 2ē =Zn0
Пирометаллургический:
ZnS + 3O2 = 2ZnO + 2SO2↑
ZnO + C = Zn↑ + CO↑
HgS + O2 = Hg + SO2
В ряду ZnО, СdO, HgО термическая устойчивость оксидов уменьшается
• 2Zn + O2 = 2ZnO
• 2Cd + O2 = 2CdO
В ряду ZnS – CdS – HgS растворимость понижается
ZnS + 2HCl(p.) = ZnCl2 + H2 S↑
CdS+ 4 HCl(K.)= H2 [CdCl4 ] + H2 S↑
3HgS + 8HNO3 = 3Hg(NO3 )2 +3S↓ + 2NO +4H2O
Zn2+ + 2OH- = Zn(OH)2↓
Cd 2+ + 2 OH- = Cd(OH)2↓
В ряду Zn(ОН)2 – Сd(ОН)2 основные свойства усиливаются. Устойчивость соединений снижается при переходе от Сd к Нg. Zn(ОН)2 и Сd(ОН)2 устойчивы, а гидроксид Hg (II) неизвестен.
Hg(NO3 )2 + 2NaOH = HgO↓ + NaNO3+ H2O
Hg2(NO3)2 + 2NaOH = 2NaNO3 + Hg2O ↓ + H2O
Zn(OH)2 + 2H+ = Zn2+ + 2H2O
Zn(OH)2 + 2OH‾ = [Zn(OH)4 ] 2-
ZnCl2 + H2O ↔ ZnOHCl + HCl
Zn2+ +НОН↔ ZnOH+ + H+
При длительном нагревании: Cd(OH)2 + 4 NaOH (конц.) = Na4 [Cd(OH)6 ]
Комплексообразование ионов Zn2+, Cd2+, Hg2+
Zn(OH)2 + 4NH4OH = [Zn(NH3 )4 ](OH)2 + 4H2O
Hg(NO3 )2 +2KI = 2KNO3 + HgI2↓
2KI + HgI2 = K2 [HgI4]
В отличие от сульфидов цинка и кадмия, HgS растворяется в избытке сульфидов щелочных металлов с образованием КС: HgS + K2 S = K2 [HgS2]
Особенности соединений ртути
Hg2(NO3)2 + 2NaCl = Hg2Cl2↓ + 2NaNO3
2HgCl2 + SnCl2 = Hg2Cl2↓ + SnCl4
Hg2Cl2 + Cl2 = 2HgCl2 +1 Hg2Cl2 + SnCl2 = + SnCl4 + 2Hg0↓
Для Соединений ртути (I) характерны реакции диспропорционирования:
Hg2 (NO3 )2 + H2 S = Hg0 + HgS + 2HNO3
23. Химия s- элементов. Жесткость воды.

Окрашивание пламени:

Все s- металлы на свежем разрезе имеют блестящую поверхность, однако быстро тускнеют, вступая в контакт с кислородом воздуха, поэтому их, за исключением, бериллия и магния следует хранить под слоем керосина или жидкого парафина. На поверхности бериллия и магния образуется защитный оксидный слой, поэтому они корродируют сравнительно медленнее.
Химические свойства
При сгорании при атмосферном давлении могут образовываться оксиды состава:
Ме2О (1-группа) или МеО (II группа);
пероксиды состава Ме2О2 и МеО 2 соответственно;
супероксиды состава МеО 2 и МеО 4
Например, только литий сгорает на воздухе с образованием оксида
4Li + О2 = 2Li2О
а натрий образует смесь пероксида и супероксида:
3Na + 2О2 = Nа2О2 + NаО2
Оксиды натрия и калия могут быть получены только при нагревании смеси пероксида с избытком металла в отсутствие кислорода:

Жесткость воды
Жесткость природных вод и их специфические свойства определяются содержанием ионов Са2+ и Мg2+. Согласно принятому в России стандарту жесткость воды выражают числом эквивалентов ионов Са2+ и Мg2+ в 1л воды.

Жесткость воды
2C11H35COONa + CaSO4 → (C11H35COO)2Ca↓ + Na2SO4
Сумма концентраций ионов кальция и магния в воде называется общей жесткостью воды. Общая жесткость складывается из временной, или карбонатной, жесткости и постоянной, или некарбонатной, жесткости. В зависимости от жесткости природные воды классифицируются на несколько групп:








