Металл малоактивный
3Ag + 4HNO3(разб.) → 3AgNO3 + 2H2O + NO
«Царская водка»
«Царская водка» представляет собой смесь одного объема азотной кислоты и трех-четырех объемов концентрированной соляной кислоты, обладающую очень высокой окислительной активностью. Такая смесь способна растворять некоторые малоактивные металлы, не взаимодействующие с азотной кислотой. Среди них и «царь металлов» - золото. Такое действие «царской водки» объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота (III), или хлорида нитрозила – NOCl:
HNO3 + 3 HCl → Cl2 + 2 H2O + NOCl
Хлорид нитрозила далее разлагается по схеме:
2 NOCl → 2 NO + Cl2
Хлор в момент выделения состоит из атомов. Атомарный хлор является сильнейшим окислителем, что и позволяет «царской водке» воздействовать даже на самые инертные «благородные металлы».
Реакции окисления золота и платины протекают согласно следующим уравнениям:
Au + HNO3 + 4 HCl → H[AuCl4] + NO + 2H2O
3Pt + 4HNO3 + 18HCl → 3H2[PtCl6] + 4NO + 8H2O
На Ru, Os, Rh и Ir «царская водка» не действует.
4) Равновесие на границе металл–раствор. Электродный потенциал. Водородный электрод сравнения. Ряд напряжений.

Электродный потенциал
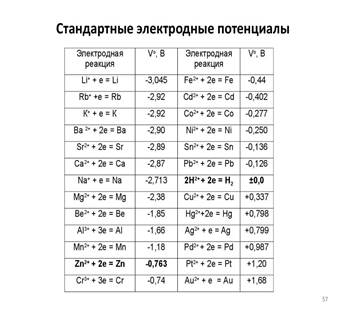
Электродный потенциал — ЭДС элемента, составленного из данного электрода и стандартного водородного электрода, электродный потенциал которого принят равным нулю.
Электрод сравнения - электрохимические полуэлементы электрохимического круга, применяемые при измерении электродных потенциалов как их эталон. Потенциал электрода сравнения имеет постоянное значение и не зависит от изменения концентрации раствора электролита электрохимического круга. Необходимость использования данного понятия обусловлена невозможностью измерения абсолютных потенциалов отдельных электродов и создание электрода с величиной потенциала, равна нулю.
Электроды сравнения должны удовлетворять следующим требованиям:
● Иметь высокую воспроизводимость потенциала
● Малую зависимость потенциала от температуры
● Постоянство всех характеристик в течение длительного времени
● Быть простыми в изготовлении и эксплуатации
Водородный электрод сравнения - небольшая платиновая пластинка или сетка, электролитически покрытая платиновой чернью и частично погружена в раствор.
При стандартных условиях, то есть при aH + = 1 и PH2 = 1 атм., Е = 0, так стандартный электродный потенциал водородного электрода условно считается равным нулю при всех температурах. Такой электрод называют стандартным водородным электродом. Потенциалы других электродов, измеренные относительно водородного, составляют шкалу стандартных электродных потенциалов. Воспроизводимость водородного электрода составляет 0,01 мВ. Но это возможно только в случае выполнения целого ряда условий: обеспечение высокой чистоты водорода и поверхности электрода, отсутствия в растворах веществ- «ядов»: CN-, H2S, Ag +, Hg2 +, NO3-, ароматических соединений, солей мышьяка.

Ряд напряжений металлов используется на практике для относительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе.
Восстановительная активность металлов (свойство отдавать электроны) уменьшается, а окислительная способность их катионов (свойство присоединять электроны) увеличивается в указанном ряду слева направо.
Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu2+ → Zn2+ + Cu возможно только в прямом направлении. Цинк вытесняет медь из водного раствора её соли. При этом цинковая пластинка растворяется, а металлическая медь выделяется из раствора.
● Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu2+ → Zn2+ + Cu возможно только в прямом направлении. Цинк вытесняет медь из водного раствора её соли. При этом цинковая пластинка растворяется, а металлическая медь выделяется из раствора.
● Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой.
● Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют.
● При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей.
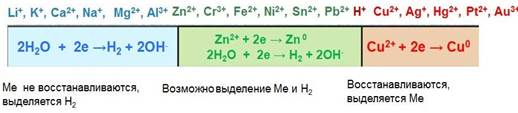
5) Гальванические элементы. Электродвижущая сила.
Если окислительно-восстановительную реакцию осуществить так, чтобы процессы окисления и восстановления были пространственно разделены, и создать возможность перехода электронов от восстановителя к окислителю по проводнику (внешней цепи), то во внешней цепи возникает направленное движение электронов электрический ток. Устройства, в которых энергия химической реакции превращается в электрическую энергию, называются химическими источниками тока или гальваническими элементами.
Всякий гальванический элемент состоит из двух электродов, соединенных между собой металлическим проводником и солевым мостиком.
При схематическом изображении гальванического элемента граница раздела межу металлом и раствором обозначается вертикальной чертой, граница между растворами электролитов - двойной вертикальной чертой. Например, схема гальванического элемента, в основе работы которого лежит реакция
Zn + 2AgNO3 > Zn(NO3)2 + 2Ag,
изображается следующим образом:
Zn | Zn(NO3)2 || AgNO3 | Ag
или
Zn | Zn(2+) || Ag(+) | Ag.

6) Комплексные соединения: теория Вернера. Понятия: комплексное соединение, внутренняя и внешняя сферы, лиганд, комплексообразователь, координационное число. Дентатность лигандов. Двойные соли
Теория координационных соединений, предложенная А. Вернером координационных соединений (для комплексов определенного вида). Рассмотрим ее основные положения.
1. Большинство элементов проявляет два типа валентности – главную и побочную.








