Металл средней активности
2Cr + 4 H2SO4(конц.)→ Cr2(SO4)3 + 4 H2O + S
Металл малоактивный
2Bi + 6H2SO4(конц.)→ Bi2(SO4)3 + 6H2O + 3SO2
Азотная кислота (HNO3)
Особенностью азотной кислоты является то, что азот, входящий в состав NO3- имеет высшую степень окисления +5 и поэтому обладает сильными окислительными свойствами. Максимальное значение электродного потенциала для нитрат-иона равно 0,96 В, поэтому азотная кислота – более сильный окислитель, чем серная. Роль окислителя в реакциях взаимодействия металлов с азотной кислотой выполняет N5+. Следовательно, водород H2 никогда не выделяется при взаимодействии металлов с азотной кислотой (независимо от концентрации). Процесс протекает по схеме:
Me + HNO3 --> соль + вода + продукт восстановления HNO3
Продукты восстановления HNO3:
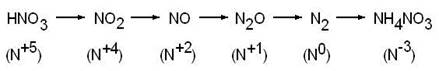
Обычно при взаимодействии азотной кислоты с металлом образуется смесь продуктов восстановления, но как правило, один из них является преобладающим. Какой из продуктов будет основным, зависит от концентрации кислоты и активности металла.
Концентрированная азотная кислота
Концентрированным считают раствор кислоты плотностью ρ > 1,25 кг/м3, что соответствует
концентрации > 40%. Независимо от активности металла реакция взаимодействия с HNO3 (конц.) протекает по схеме:
Me + HNO3(конц.) → соль + вода + NO2
С концентрированной азотной кислотой не взаимодействуют благородные металлы (Au, Ru, Os, Rh, Ir, Pt), а ряд металлов (Al, Ti, Cr, Fe, Co, Ni) при низкой температуре пассивируются концентрированной азотной кислотой. Реакция возможна при повышении температуры, она протекает по схеме, представленной выше.
Примеры:
Активный металл
Al + 6HNO3(конц.) → Al(NO3)3 + 3H2O + 3NO2↑
Металл средней активности
Fe + 6HNO3(конц.) → Fe(NO3)3 + 3H2O + 3NO↑
Металл малоактивный
Ag + 2HNO3(конц.) → AgNO3 + H2O + NO2↑
Разбавленная азотная кислота
Продукт восстановления азотной кислоты в разбавленном растворе зависит от активности металла, участвующего в реакции:
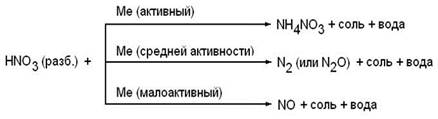
Примеры:
Активный металл
8Al + 30HNO3(разб.) → 8Al(NO3)3 + 9H2O + 3NH4NO3
Выделяющийся в процессе восстановления азотной кислоты аммиак сразу взаимодействует с избытком азотной кислоты, образуя соль – нитрат аммония NH4NO3:
NH3 + HNO3 → NH4NO3.
Металл средней активности
10Cr + 36HNO3(разб.) → 10Cr(NO3)3 + 18H2O + 3N2
Кроме молекулярного азота (N2) при взаимодействии металлов средней активности с разбавленной азотной кислотой образуется в равном количестве оксид азота (I) – N2O. В уравнении реакции нужно писать одно из этих веществ.








