Разбавленная серная кислота
В разбавленном водном растворе серной кислоты большинство ее молекул диссоциируют:
H2SO4 H(+) + HSO4-
HSO4- H(+) + SO42-
Образующиеся ионы Н(+) выполняют функцию окислителя.
Как и соляная кислота, разбавленный раствор серной кислоты взаимодействует только с металлами активными и средней активности (расположенными в ряду активности до водорода).
Химическая реакция протекает по схеме:
Ме + H2SO4(разб.) → соль + H2↑
Пример:
2 Al + 3 H2SO4(разб.) → Al2(SO4)3 + 3 H2↑
Металлы с переменной валентностью окисляются разбавленным раствором серной кислоты до низших положительных степеней окисления:
Fe(0) → Fe(2+)
Co(0) → Co(2+)
Ni(0) → Ni(2+)
Cr(0) → Cr(2+)
Mn(0) → Mn(2+)
Свинец (Pb) не растворяется в серной кислоте (если ее концентрация ниже 80%), так как образующаяся соль PbSO4 нерастворима и создает на поверхности металла защитную пленку.
Концентрированная серная кислота
В концентрированном растворе серной кислоты (выше 68%) большинство молекул находятся в недиссоциированном состоянии, поэтому функцию окислителя выполняет сера, находящаяся в высшей степени окисления (S+6). Концентрированная H2SO4 окисляет все металлы, стандартный электродный потенциал которых меньше потенциала окислителя – сульфат-иона SO42- (0,36 В). В связи с этим, с концентрированной серной кислотой реагируют и некоторые малоактивные металлы.
Процесс взаимодействия металлов с концентрированной серной кислотой в большинстве случаев протекает по схеме:
Me + H2SO4 (конц.) --> соль + вода + продукт восстановления H2SO4
Продуктами восстановления серной кислоты могут быть следующие соединения серы:
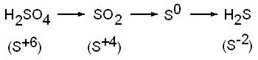
Практика показала, что при взаимодействии металла с концентрированной серной кислотой выделяется смесь продуктов восстановления, состоящая из H2S, S и SO2. Однако один из этих продуктов образуется в преобладающем количестве. Природа основного продукта определяется активностью металла: чем выше активность, тем глубже процесс восстановления серы в серной кислоте.
Взаимодействие металлов различной активности с концентрированной серной кислотой можно представить схемой:

Алюминий (Al) и железо (Fe) не реагируют с холодной концентрированной H2SO4, покрываясь плотными оксидными пленками, однако при нагревании реакция протекает.
Ag, Au, Ru, Os, Rh, Ir, Pt не реагируют с серной кислотой.
Концентрированная серная кислота является сильным окислителем, поэтому при взаимодействии с ней металлов, обладающих переменной валентностью, последние окисляются до более высоких степеней окисления, чем в случае с разбавленным раствором кислоты:
Fe(0) → Fe(3+),
Cr(0) → Cr(3+),
Mn(0) → Mn(4+),
Sn(0) → Sn(4+)
Свинец (Pb) окисляется до двухвалентного состояния с образованием растворимого гидросульфата свинца Pb(HSO4)2.
Примеры:
Активный металл
8 A1 + 15 H2SO4(конц.)→4A12(SO4)3 + 12H2O + 3H2S








