7. Какой металл известен своим антибактериальным действием?
8. Где в ряду активности металлов находится железо и как это определяет его отношение к кислотам?
9. Почему железо подвергается коррозии на воздухе, а химически более активные металлы алюминий и магний устойчивы к коррозии?
10. Какие металлы являются источником энергии в тепловыделяющих элементах атомных электростанций?
Упражнения
1. Нарисуйте модель кристаллической решетки металла. Покажите характер изменения состояния кристаллической решетки металла: а) при электропроводности; б) теплопроводности.
2. Нарисуйте схему электролизера и напишите электродные реакции, протекающие на катоде и аноде при получении металлического натрия.
3. Напишите реакцию восстановления железа из оксида железа в доменной печи.
4. Выскажите предположение, почему зола, образующаяся при сжигании каменного угля на электростанциях, имеет повышенную радиоактивность по сравнению с естественным радиоактивным фоном окружающей среды.
5. Вычислите время, необходимое для радиоактивного превращения металлического полония-210 на 99%, если известно, что период полураспада  Ро равен 138 дней. Какое вещество образуется при радиоактивном распаде
Ро равен 138 дней. Какое вещество образуется при радиоактивном распаде  Ро, если известно, что полоний a-излучатель?
Ро, если известно, что полоний a-излучатель?
ТЕМА 6
НЕМЕТАЛЛЫ
Неметаллы представлены 22 элементами периодической системы. За исключением водорода (s-элемента) остальные неметаллы – р-элементы. Кислород и кремний составляют почти 78 мас.% земной коры. В этом легко убедиться, если рассчитать долю кислорода и кремния в наиболее распространенных минералах горных пород (силикатах и алюмосиликатах), например, таких, как каолинит Al2[Si2O5](OH)4, ортоклаз К[AlSi3O8], анортит Ca[Al2Si2O8], кварцевый песок SiO2.
Отметим два признака, которые отличают неметаллы от металлов. В пределах одного периода:
1) радиусы атомов неметаллов меньше радиусов атомов металлов;
2) энергия ионизации атомов неметаллов больше энергии ионизации атомов металлов, поэтому в окислительно-восстановительных реакциях с металлами неметаллы выступают как окислители.
Положение металлов и неметаллов в периодической системе элементов является следствием заполнения электронных оболочек атомов в соответствии с квантовыми правилами. Периодичность изменения электронной конфигурации атомов приводит к повторению физических и химических свойств элементов через правильные интервалы. Каждый новый период открывается щелочным металлом и завершается благородным газом (неметаллом). Переход от одного периода к следующему происходит скачком. В этом легко убедиться, сравнивая изменение атомных радиусов и энергии ионизации от заряда ядра атома (рис. 51 и 52).
6.1. Элементы 18 группы. Благородные газы
Благородные газы (гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радон Rn) входят в 18 группу периодической системы, они завершают периоды. Атомы элементов имеют электронную конфигурацию с полностью заполненной np6-орбиталью (у гелия 1s2-орбиталь). Такая конфигурация электронных оболочек определяет химическую инертность одноатомных благородных газов.
В природе благородные газы находятся в атмосфере, гидросфере и литосфере. Самым распространенным среди них является аргон, его содержание в атмосфере составляет ~1 % по объему, точнее 0.934 об.%. Гелий He выделяют из гелионосных горючих газов. Радон получают как побочный продукт при переработке ураносодержащих руд. Неон, аргон, ксенон и криптон получают из воздуха как побочные продукты разделения воздуха на азот и кислород.
Гелий применяется в качестве носителя в хроматографии. Смесь кислорода и гелия используется вместо воздуха водолазами.
Аргон используется для создания инертной атмосферы при сварочных работах.
Неон и криптон используют в газоразрядных трубках (реклама).
Радон – радиоактивный газ (a-излучатель). Период полураспада самого долгоживущего радионуклида Rn-222 3.8 сут.
6.2. Элементы 17 группы. Галогены
Галогены (фтор F, хлор Cl, бром Br, йод I и астат At) входят в 17 группу периодической системы. Атомы элементов имеют электронную конфигурацию ns 2 p5. Такая конфигурация электронных оболочек определяет химическую активность галогенов. В окислительно-восстановительных реакциях галогены выступают в качестве окислителей и в свободном состоянии [F2(г), Cl2(г), Br2(ж), I2(т)] в природе не встречаются.
Астат At(т) - радиоактивный элемент (a-, b-излучатель). Он был получен в циклотроне в результате бомбардировки висмута-209 a-частицами. Период полураспада самого долгоживущего радионуклида астата-210 всего 8.6 ч.
В горных породах, морской и минерализованной воде нефтяных скважин галогены встречаются в виде солей. Фтор и хлор получают электролизом расплавов солей, например расплавов KH2F3 и NaCl. Бром получают из морской воды обменной реакцией:
2Br-(р-р) + Cl2(р-р) ® 2Cl-(р-р) + Br2(р-р).
Аналогично получают йод из минерализованной воды нефтяных скважин.
Фтор F2 самый реакционноспособный среди галогенов. Он вступает в химические реакции с металлами и неметаллами, с водой, кварцевым песком. Например:
3F2(г) + 2Fe(т) ® 2FeF3(т)
F2(г) + Н2(г) ® 2НF(г)
2F2(г) + 2Н2О(ж) ® 4НF(р-р) + О2(г)
2F2(г) + SiO2(т) ® SiF4(г) + О2(г).
В силу высокой реакционной способности фтор хранят в металлических сосудах из сплавов медь-никель или никель-железо-марганец, устойчивых к фтору, благодаря пассивации внутренней поверхности сосуда.
Фтор широко используют для производства фторорганических соединений, например политетрафторэтилена
–[CF2 – CF2]n– (тефлона):
СН4 + F2(Cl2) ® CF2HCl
2CF2HCl ® CF2 = CF2 + 2HCl
nCF2 = CF2 ® –[CF2 – CF2]n–
тефлон
Тефлон обладает низким коэффициентом трения, стойкостью к действию кислот и щелочей, высокой термостойкостью (разлагается при 425 оС). Он пригоден к длительной эксплуатации в интервале температур от – 260 до + 260 оС.
Фтористый водород HF - исходный продукт для получения гексафторида урана UF6 и последующего производства чистого урана, обогащенного изотопом уран-235. Последний используется в виде металла (атомные бомбы) или оксида урана (тепловыделяющие элементы атомных электростанций).
Хлор Cl2 менее реакционноспособный галоген по сравнению с фтором. Реагирует с металлами и неметаллами лишь при высокой температуре (более 200 0С). С кварцем не реагирует. Медленно взаимодействует с холодной водой:
Cl2(г) + Н2О(ж) ® 2Н+(р-р) + 2Cl-(р-р) + HClO(р-р).
Получаемый по этой реакции NaClO (гипохлорит натрия) используется в промышленности в качестве отбеливателя тканей и бумажной массы, благодаря атомам кислорода, выделяющимся при разложении этой соли:
NaClO(р-р) ® Na+(р-р) + Cl-(р-р) + O(р-р).
Атомы кислорода – активные реагенты, способные разрушать органические красящие вещества. На принципе окислительного разрушения органических соединений построено уничтожение бактерий при хлорировании питьевой воды, а также при хлорировании промышленных и бытовых стоков на очистных станциях аэрации.
Уничтожая болезнетворные бактерии хлорированием воды, мы создаем другую проблему. В воде образуются хлорорганические продукты опасные для здоровья человека, если они попадают с питьевой водой в организм. Основной путь уничтожения болезнетворных бактерий в питьевой воде – озонирование. Источником атомов кислорода, уничтожающих бактерии, является реакция разложения растворенного в воде озона:
О3(р-р) ® О2(р-р) + О(р-р).
Хлор используется для промышленного получения хлороводорода (водный раствор – соляная кислота):
Cl2(г) + Н2(г) ® 2НCl(г),
а также в производстве полимера – поливинилхлорида -[CH2-CHСl]n-.
Применение брома и йода ограничено. Водноспиртовые и спиртовые растворы йода используются в качестве антисептика (химический метод уничтожения болезнетворных микроорганизмов при смазывании ран).
6.3. Элементы 16 группы. Кислород. Сера
Среди неметаллов 16 группы периодической системы элементов (кислород О, сера S, селен Se, теллур Te), имеющих электронную конфигурацию ns2p4, рассмотрим кислород и серу.
Кислород О2 получают в промышленности из воздуха Для этого воздух при охлаждении переводят в жидкое состояние и методом низкотемпературной ректификации выделяют газообразный азот N2, Ткип. N2(ж) = -196 оС, и газообразный кислород O2, Ткип О2(ж) = -183 оС.
При выплавке чугуна и стали используется почти половина производимого промышленностью кислорода, поэтому металлургические заводы имеют установки низкотемпературной ректификации воздуха. На 1 т стали расходуется примерно 1 т О2.
Кислород выполняет функцию окислителя при термитной сварке и резке металлов. В медицине кислород назначается в лечебных целях. Он используется также в дыхательных аппаратах различного назначения.
Применяется жидкий кислород в космических ракетах. Известно, например, что американские ракеты «Сатурн», доставлявшие космонавтов на Луну, имели стартовую массу ~ 2950 т. Значительная масса ракеты приходилась на жидкий О2 (2200 т). Он расходовался на сжигание 450 т керосина (первая и вторая ступени ракеты). Остальное количество О2 расходовалось при сжигании жидкого Н2 (третья ступень ракеты) и на дыхание трех космонавтов, находившихся в головной части ракеты массой ~ 50 т.
Сера кристаллическая состоит из молекул S8. При комнатной температуре термодинамически устойчивой формой является ромбическая сера.
В природе сера встречается в виде подземных залежей, а также в виде сульфидных и сульфатных минералов. В основном сера используется для получения серной кислоты согласно следующим реакциям:
S(т) + О2(г) ® SO2(г),
катализатор V2O5, T
2SO2(г) + 3О2(г) ® 2SO3(г),
SO3(г) + Н2О(ж) ® Н2SO4(ж).
Значительное количество серы расходуется при вулканизации каучука – химического процесса превращения пластичного каучука в резину, используемую для изготовления автомобильных шин и др.
S (сера)
-[СН2С=СНСН2]n- ® Резина (эластичный материал)
ï
CH3
изопреновый каучук
6.4. Элементы 15 группы. Азот
Среди неметаллов 15 группы периодической системы элементов (азот N, фосфор Р, мышьяк As, сурьма Sb), имеющих электронную конфигурацию ns2p3, рассмотрим азот.
Наибольшая часть азота N2(г) находится в свободном состоянии в атмосфере Земли. Он извлекается из воздуха методом низкотемпературной ректификации при температуре кипения -196 оС. Основная область использования N2 – получение аммиака:
р=30 МПа, Т=400-500 оС, катализатор
2N2(г) + 3Н2(г) ® 2NH3(г)
и азотной кислоты:
Рt катализатор
4NH3(г) + 5О2(г) ® 4NО(г) + 6Н2О(ж),
2NО(г) +О2(г) ® 2NО2(г),
3NО2(г) +Н2О(ж) ® 2НNО3(р-р) + NO(г).
6.5. Элементы 14 группы. Углерод. Кремний
Атомы неметаллов 14 группы периодической системы углерод С и кремний Si имеют электронную конфигурацию ns2p2.
Углерод. Содержание углерода в земной коре невелико и составляет ~ 0.32 мас.%. Основная масса углерода встречается в виде карбонатных горных пород – известняков СаСО3 и доломитов СаMg[СО3]2, каменного угля, содержащего 75 – 95 % углерода и природного газа (СН4).
Атом углерода по размеру и структуре обладает идеальной электронной оболочкой среди всех элементов периодической системы (рис. 60).
Достаточно сравнить электронную конфигурацию атома углерода с электронными структурами соседей по второму периоду и 14 группе, чтобы убедиться в этом.
У бора валентных электронов меньше, чем валентных орбиталей. У азота, наоборот, валентных электронов больше, чем орбиталей. Указанные особенности углерода сказались самым благоприятным образом на построении громадного числа разнообразных по структуре и составу органических соединений.
В группе соседом углерода является кремний. У него так же, как у углерода, число валентных электронов совпадает с числом валентных орбиталей. Но атомный радиус кремния больше атомного радиуса углерода, и между ядром и валентными электронами располагается не два, а десять экранирующих ядро электронов.
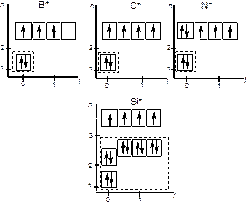
Рис. 60. Электронные модели атомов бора, углерода, азота и кремния в возбужденном состоянии. Пунктирной линией выделены электроны, экранирующие ядро атома по отношению к валентным электронам
Модели атомов можно также изобразить символами химических элементов в окружении валентных электронов (рис. 61).
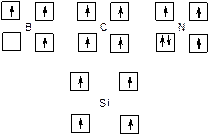
Рис. 61. Модели, демонстрирующие число валентных электронов и заполнение квантовых ячеек валентными электронами в атомах бора, углерода, азота и кремния в возбужденном состоянии
Указанные модели помогают показать преимущества атома углерода перед соседними атомами в периоде и группе, реализующиеся при образовании четырех прочных ковалентных связей в молекулах органических соединений.








