Химическая коррозия металла происходит при непосредственном контакте металла с окислителем. Окислителями выступают многие соединения и в первую очередь кислород.
Металлы, соприкасающиеся с воздухом, особенно при высокой температуре, подвергаются газовой коррозии. Так происходит окисление железа:
4Fe(т) + 3O2(г)= 2Fe2O3(т).
На поверхности железа образуется рыхлая пленка оксида, которая не защищает металл от дальнейшего окисления.
На поверхности таких металлов, как Be, Al, Ti, Cr, Ni, Cu, Zn и др., образуется тонкая и прочная пленка оксида, препятствующая дальнейшему окислению металла.
Электрохимическая коррозия – это разрушение металла в окислительно-восстановительной реакции в микрогальваническом элементе, возникающем на поверхности металла. Капли воды на поверхности металла способствуют возникновению электрохимической коррозии (рис. 54). Ионы железа Fe2+ переходят с поверхности металлической кристаллической решетки в водный раствор в зоне, которая соответствует аноду:
анод (окисление железа): 2Fe ® 2Fe2+ + 4е-.
Избыток электронов, возникший в металле, устремляется к участку поверхности металла, выполняющему функцию катода. Происходит восстановление кислорода, растворенного в воде:
катод (восстановление): О2 + 2Н2О(ж) + 4е- ® 4ОН-(р-р).
В капле раствора идет следующая реакция:
2Fe2+(р-р) + 4НО-(р-р) ® 2Fe(OH)2(т).
Гидроксид железа (II) окисляется кислородом, растворенным в воде, и превращается в гидроксид железа (III) буро-красного цвета:
4Fe(OH)2(т)+ O2 + 2H2O(ж) ® 4Fe(OH)3(т).
Последний разлагается до оксида железа (III):
2Fe(OH)3(т) ® Fe2O3×H2O (бурый осадок) + 2Н2О(ж).
Появление на поверхности металла ржавчины в виде небольших буро-коричневых точек является результатом действия на данном участке микрогальванического элемента.
Ржавление происходит на любом доступном каплям воды участке металлической поверхности. Под каплей постепенно уменьшается толщина стенки металла и образуется лунка. Вероятность попадания влаги в образовавшуюся лунку возрастает, и ржавление продолжается до полного разрушения данного небольшого участка металла.
Защита железа от коррозии осуществляется:
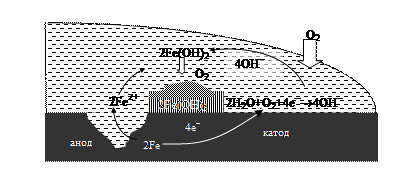
Рис. 54. Электрохимическая коррозия железа
1) покрытием металла красками, грунтовками по ржавчине. В последнем случае к водной поливинилацетатной дисперсии добавляют небольшое количество NaH2PO4. Образующееся при взаимодействии NaH2PO4 с ржавчиной фосфорнокислое железо Fe(H2PO4)3 не растворяется в воде и выполняет функцию защитного покрытия, предотвращающего дальнейшее ржавление металла.
2) покрытием железа цинком (цинкованная листовая сталь используется в автомобилестроении, а также как кровельный материал), оловом (белая жесть - листовая сталь, покрытая слоем олова, широко используется при изготовлении консервных банок), хромом. Указанные покрытия образуют при взаимодействии с кислородом воздуха прочную тонкую оксидную пленку, которая защищает железо от коррозии.
3) легированием, например получением сплава железа, содержащего 18 мас.% никеля и 8 мас.% хрома (нержавеющая сталь). Предотвращение ржавления стали происходит по тому же принципу, что и при покрытии железа хромом.
4) катодная или электрохимическая защита широко используется для предотвращения коррозии стальных трубопроводов, по которым перекачивается нефть и природный газ (рис. 55).
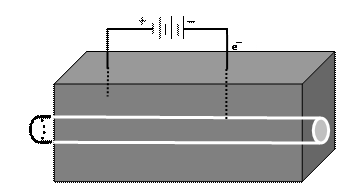
Рис. 55. Электрохимическая (катодная) защита стального трубопровода
При катодной защите стальной трубопровод подсоединяется к катоду источника постоянного тока и на металле возникает отрицательный заряд. Он затрудняет переход положительно заряженных ионов железа в раствор.
5.7. Металлы f -элементов
Металлы f-элементов включают: лантаноиды и актиноиды – элементы 6 и 7 периодов, в атомах которых заполняются соответственно 4f- и 5f-орбитали.
Среди металлов f-элементов рассмотрим уран U и плутоний Pu, точнее радионуклид 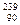 Pu, получаемый в ядерных реакторах при длительном облучении нейтронами урана-238.
Pu, получаемый в ядерных реакторах при длительном облучении нейтронами урана-238.
Уран изменил жизнь человечества в середине ХХ в. Группой физиков во главе с Э. Ферми был запущен первый атомный реактор в Чикаго в 1942 г. в период Второй мировой войны. А в 1945 г. американцами были сброшены атомные бомбы на японские города Хиросима и Нагасаки.
Перед человечеством возникла реальная угроза погибнуть в ядерной катастрофе в случае применения ядерного и термоядерного оружия в военном конфликте.
Важнейшими рудами урана являются настуран U3O8, и уранинит (U,Th)O2. В рассеянном виде в толще земной коры содержатся, главным образом радиоактивные соединения урана U, тория Th и калия К.
Отступление. Ядра атомов химических элементов, содержащие 84 и более протонов, неустойчивы и самопроизвольно распадаются. Все элементы периодической системы, начиная с полония Ро (заряд ядра 84) и завершающим 7 период элементом с зарядом ядра 118, состоят исключительно из радиоактивных нуклидов (nuclear - ядро).








