Среди химических свойств металлов основным является способность отдавать валентные электроны, т.е. выступать в качестве восстановителя в окислительно-восстановительных реакциях .
Большие радиусы (r) атомов металлов (рис. 51) и небольшие значения энергии ионизации (Еи) по сравнению с атомами неметаллов (рис. 52) объясняют высокие восстановительные свойства металлов в окислительно-восстановительных реакциях.
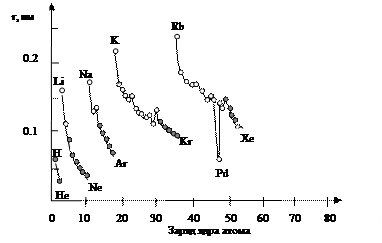 |
Рис. 51. Зависимость радиусов атомов от заряда ядра (приведены 1-5 периоды); светлыми точками выделены атомы металлов
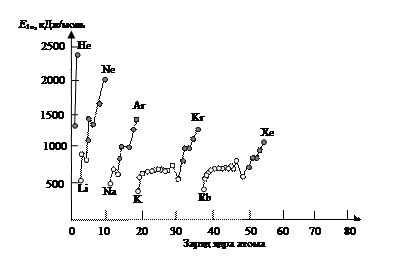
Рис. 52. Зависимость первой энергии ионизации атомов от заряда ядра (светлые точки - атомы металлов, темные - неметаллов)
На рис. 53 представлено положение металлов и неметаллов в периодической системе элементов. Вертикальными жирными стрелками указано направление уменьшения атомных радиусов в группах и периодах.
s-элементы p-элементы
 | |||
 | |||
1 18
|
2 13 14 15 16 17 |
| |||||||||||||||||||

|
d-элементы
3 4 5 6 7 8 9 10 11 12 | ||||||||||||||||||||
| |||||||||||||||||||||

| 
| 
| |||||||||||||||||||
| |||||||||||||||||||||
|
| ||||||||||||||||||||

f-элементы
 |
| Лантаноиды | |||||||||||||||
| Актиноиды |
Рис. 53. Положение металлов и неметаллов в периодической системе элементов; пунктирными стрелками указано положение лантаноидов и актиноидов
Т а б л и ц а 11