7. Какой вид проводимости (ионная или электронная) осуществляется в растворе электролита?
8. Будет ли работать гальванический элемент без солевого мостика?
9. Чем отличается электролизер от гальванического элемента?
10. Какие два признака отличают электрохимическую реакцию от химической?
11. Какое численное значение имеет степень окисления простых веществ?
12. Гидролиз каких солей приводит к появлению в водном растворе ионов ОН-, ионов Н+?
13. Почему соли, образованные сильной кислотой и сильным основанием, в растворе не подвергаются гидролизу?
Упражнения
1. Для растворов следующих солей укажите реакцию среды:
а) сульфат калия; б) нитрат меди (II); в) хлорид цинка; г) силикат натрия. Напишите сокращенные ионные уравнения первой ступени гидролиза.
2. При электролизе водного раствора NiSO4 использованы платиновые электроды. На катоде выделился никель, на аноде – газообразный кислород. Напишите уравнения реакций, протекающих на электродах, и объясните выделение этих продуктов.
3. Среди водных растворов солей Li2SO4, CuCl2, Ca(NO3)2, Na2SO4 выберите растворы, электролиз которых приводит к разложению воды.
4. Напишите уравнения реакций, сопровождающих электролиз водного раствора хлорида цинка.
5. Определите, какой газ выделился на катоде и аноде при электролизе водного раствора KCl.
6. Вычислите стандартную ЭДС гальванического элемента
(-) Ni½NiSO4½½CuSO4½Cu (+),
пользуясь таблицей стандартных электродных потенциалов.
ТЕМА 5
МЕТАЛЛЫ
Современной науке известно 111 элементов (включая полученные искусственно): 89 металлов и 22 неметалла.
Среди химических элементов на долю 8 элементов приходится ~ 99% массы земной коры (табл. 9).
Т а б л и ц а 9
Содержание основных элементов земной коры (по Ярошевскому)
| Элемент | O | Si | Al | Fe | Ca | K | Na | Mg |
| мас. % | 47.9 | 29.9 | 7.8 | 4.02 | 2.9 | 2.32 | 2.21 | 1.7 |
Остальные элементы составляют всего 1 мас.% земной коры (рис. 47).
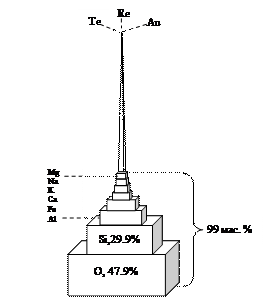
Рис. 47. Модель, демонстрирующая количественные соотношения химических элементов в земной коре (по Ярошевскому)
В табл. 10 приведены некоторые минералы горных пород.
Т а б л и ц а 10
Одна из химических классификаций минералов земной коры
| Минералы | Примеры |
| Самородные элементы | Au, Ag, Cu, Pt, Pd, S |
| Сульфиды | FeS2 – пирит, PbS – галенит, CuFeS2 – халькопирит |
| Галогениды | CaF2 – флюорит, NaCl – галит (каменная соль), KCl – сильвин |
| Оксиды и гидроксиды | Fe3O4 – магнетит, Fe2O3 – гётит, Al(OH)3 – в составе боксита |
| Кислородсодержащие соли: -нитраты -карбонаты -сульфаты -фосфаты -силикаты и алюмосиликаты | NaNO3 – чилийская селитра CaCO3 – известняк, мел, мрамор, МgCO3–магнезит CaSO4×2H2O – гипс Ca5[PO4]3(Cl,F) - апатит Al2[Si2O5](OH)4– каолинит, Zr(SiO4) –циркон, К[AlSi3O8]–ортоклаз, КAl2[AlSi3O10](OH)2 – мусковит |
Сырьем для получения металлов и неметаллов служат разнообразные руды (природные минеральные образования, залегающие в горных породах в концентрациях, экономически выгодных для их извлечения и переработки). Очень редко встречаются в горных породах самородные элементы неметаллы (алмаз, графит, S, Se, Te, As, Sb) и металлы (Au, Ag, Cu, Pt, Pd, Ir, Fe, Ta, Pb, Zn, Sn, Hg, Bi).
Технологические процессы переработки руд с целью извлечения металлов и придания им нужных свойств осуществляются металлургической промышленностью.
Металлы представлены s-, p-, d-, и f- элементами в периодической системе элементов. Они обладают электропроводностью, теплопроводностью, пластичностью и специфическим типом химической связи.
Металлическая связь – это химическая связь, обусловленная взаимодействием валентных электронов с положительно заряженными ионами металла. Внешние (валентные) электроны атомов относительно свободно перемещаются в металлическом кристалле. Фактически структуру кристалла металла следует рассматривать как гигантскую молекулу, в которой электронное облако внешних электронов охватывает положительно заряженные ионы металла и удерживает их в узлах кристаллической решетки.
Металлы, за исключением ртути (Hg), щелочных металлов (Li, Na, K, Rb, Cs) и галлия (Ga), имеют высокую температуру плавления от нескольких сот до нескольких тысяч градусов и высокую плотность, превосходящую плотность воды в 2-20 раз. Отсюда можно сделать вывод, что электронное облако прочно связывает положительно заряженные ионы в кристаллической решетке металла.
Гигантская молекула-кристалл металла способна взаимодействовать с окружающей средой как целое и проявлять специфические физические и химические свойства.
5.1. Физические свойства металлов
Всем металлам присущи следующие физические свойства:
а) твердость (кроме жидкой ртути Hg);
б) пластичность (деформация под давлением), ковкость (изменение геометрической конфигурации при ударе);
в) электропроводность;
г) теплопроводность.
Указанные свойства объясняет модель кристаллической структуры металла (рис. 48). В любом виде пластической деформации (сжатие, удар, сдвиг) решающую роль в сохранении кристаллической решетки играют валентные электроны. Вследствие своей подвижности они успевают переместиться в деформированной кристаллической решетке и удерживать ионы металла в новом положении.
Твердость в сочетании с пластичностью (рис. 48) выдвигает металлы на первое место в качестве конструкционных материалов. Большинство машин и механизмов изготавливаются из металлов и их сплавов.
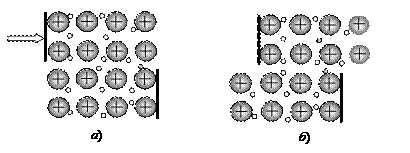
Рис. 48. Демонстрация твердости (а) и пластичности (б) кристаллической решетки металла. Электроны обозначены мелкими точками
Сочетание твердости с упругостью делает некоторые металлы и их сплавы незаменимым материалом, например в рессорах автомобилей. При нагрузке или ударах рессоры прогибаются, но не разрушаются. При уменьшении нагрузки они принимают первоначальную форму изгиба.
Электропроводность металлического проводника связана с направленным движением электронов при подключении металла к внешнему источнику электрической энергии. При отсутствии разности потенциалов электроны беспорядочно движутся в разных направлениях. При наложении разности потенциалов (рис. 49) осуществляется направленное движение электронов в кристалле металла от (-) к (+).

Рис. 49. Взаимодействие металла с внешним источником электрического тока. Стрелками показано направление движения электронов
Теплопроводность металла обеспечивают электроны, которые воспринимают энергию движения микрочастиц от нагревателя (рис. 50). Скорость хаотического движения электронов увеличивается и быстро распространяется по всему объему металла. Увеличивается также колебательное движение ионов в узлах кристаллической решетки.

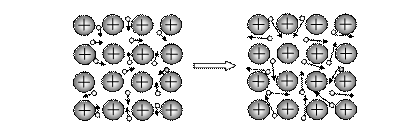
Рис. 50. Демонстрация теплопроводности металлов
5.2. Химические свойства металлов








