Электродные реакции при электролизе водных растворов
электролитов
| Катионы | Катодная реакция восстановления |
| Li+, K+, Ca2+, Na+, Mg2+, Al3+ | Восстановление воды: 2Н2О(ж) + 2е- ® Н2(г) + 2ОН- |
| Mn2+, Zn2+, Cr3+, Ni2+, Sn2+, Pb2+, H+ | Параллельное восстановление катионов металла и воды: Mz+ + ze- ® M 2Н2О(ж) + 2е- ® Н2(г) + 2ОН- |
| Cu2+, Hg22+, Ag+, Pt2+, Au3+ | Восстановление катионов металла: Mz+ + ze- ® M |
| Анионы | Анодная реакция окисления |
| I-, Br-, Cl-, S2- (А--анион) | Окисление анионов галогена и серы: АZ- ® А + ze- |
| SO42-, NO3-, CO32-, PO43-, F- | Окисление воды: 2Н2О(ж) ® Н+(р-р) + О2(г) + 2е- |
Если проводить электролиз водного раствора Na2SO4, то в процессе электролиза будут участвовать только молекулы воды, давая на катоде водород, а на аноде кислород:
катод (восстановление): 2Н2О(ж)+2е-®Н2(г)+2ОН-(р-р);
анод (окисление): 2Н2О(ж) ® 4Н+(р-р) + О2(г) + 2е-.
Экспериментальные исследования показали:
1) катионы металлов, имеющие небольшой стандартный электродный потенциал (от Li+ до Al3+), не восстанавливаются на катоде, вместо них восстанавливаются молекулы воды с выделением водорода. Катионы металлов, имеющие стандартный электродный потенциал больший, чем у Al3+, но меньший, чем у Н+, восстанавливаются на катоде параллельно с молекулами воды.
2) катионы таких металлов, как Cu2+, Ag+, Pt2+, Au3+, имеющие больший, чем у водорода, стандартный электродный потенциал, при электролизе восстанавливаются на катоде до металлов.
3) Анионы бескислородных кислот (I-, Br-, Cl-, S2-) легко окисляются на инертном нерастворимом аноде.
4) Если в растворе находятся анионы кислородных кислот SO42-, NO3-, CO32-, PO43-, а также F-, то на инертном аноде окисляются не эти анионы, а молекулы воды с выделением кислорода.
Очистка (рафинирование) меди
При электролизе водных растворов с использованием металлических электродов анод может окисляться, если его окислительный потенциал выше потенциала воды. Например, медь окисляется легче, чем вода. Свойство металлических электродов участвовать в окислительно-восстановительных реакциях находит применение в процессах очистки металлов от примесей или покрытия одних металлов другими.
Обычно медь в промышленности получают из сульфида меди по реакции:
Cu2S(ж) + O2(г) ® 2Сu(ж) + SO2(г).
Такая медь называется губчатой, она содержит до 1% примесей других металлов, главным образом железа, цинка, серебра и золота. Чтобы использовать медь для изготовления электротехнических изделий, проводят рафинирование (очистку) губчатой меди в электролизере (рис. 46). Анод делают из губчатой меди, катод из чистой меди. Электролитом служит водный раствор CuSO4 с добавлением небольшого количества серной кислоты. При электролизе медь анода растворяется, и чистая медь осаждается на катоде:
анод (окисление): Cu(т)® Cu2+(р-р) + 2е-;
катод (восстановление): Cu2+(р-р) + 2е- ® Cu(т).
Золото и серебро окисляются труднее, чем медь, и в виде незначительных по массе частичек металлов собираются на дне электролизера. В растворе остаются ионы железа и цинка.
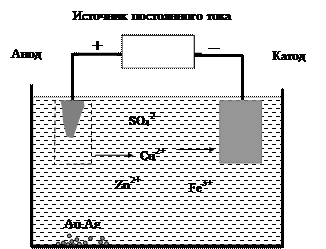 |
Рис. 46. Рафинирование меди
Покрытие одних металлов другими называется гальваническим покрытием или электроосаждением. При электроосаждении металл, который наносят на поверхность другого металла, выполняет роль анода. Например, если медные изделия покрывают слоем серебра, то анодом является серебряная пластина.
Краткий итог темы
1. Электролитами являются главным образом водные растворы солей, кислот, щелочей, а также расплавы солей. В отличие от металлов (электронная проводимость), электролиты проявляют ионную проводимость.
2. Сильные электролиты полностью распадаются в воде на ионы, слабые электролиты лишь частично диссоциируют на ионы при растворении в воде. Для сильного электролита степень диссоциации (a) равна или близка 1. Для слабых электролитов величина a существенно меньше 1.
3. Вода – слабый электролит. Ионное произведение воды (К W) при 25 оС, равное произведению концентраций ионов водорода и гидроксила сН+ сОН -,есть величина постоянная, равная 10-14.
4. Концентрацию ионов водорода принято выражать водородным показателем рН = -lg CH +. В кислой среде рН < 7, в щелочной рН > 7, в нейтральной рН = 7.
5. Ионные реакции, идущие с образованием нерастворимых в воде веществ, улетучивающихся газов или малодиссоциирующих соединений, являются необратимыми.
6. Реакции, протекающие с изменением степени окисления атомов, входящих в состав химических соединений, называются окислительно-восстановительными. Важно знать, что окислители в химических реакциях присоединяют электроны, а восстановители отдают электроны.
7. Гидролиз солей изменяет рН среды. Соли, образованные слабыми кислотами и сильными основаниями, при гидролизе создают щелочную среду; соли, образованные сильными кислотами и слабыми основаниями, – кислую среду. Соли сильных кислот и сильных оснований гидролизу не подвергаются.
8. Гальванические, топливные элементы и аккумуляторы служат источником электрической энергии. Они производятся в промышленных масштабах и служат источником энергии в электронных устройствах, в том числе на космических кораблях (топливные элементы), автомобилях (аккумуляторы).
9. В электролизерах электрическая энергия используется для получения вещества. Электролиз в промышленности используется для получения щелочных и щелочно-земельных металлов, алюминия, галогенов.
Термины для запоминания
Аккумуляторы - химические источники электрического тока многократного действия.
Водородный показатель рН определяет концентрацию ионов водорода в данной среде и вычисляется как -lg CH +
Валентность численно равна количеству связей, образуемых элементом в соединении.
Гальванические элементы - химические источники электрического тока, предназначенные для однократного (непрерывного или прерывистого) действия.
Ионное произведение воды есть произведение концентраций ионов водорода и гидроксила сН+ сОН -, равное 1 10-14.








