Промышленное получение хлора, щелочи и водорода
Электролиз водного раствора NaCl используется для промышленного получения Cl2, NaOH и Н2 (рис. 45).
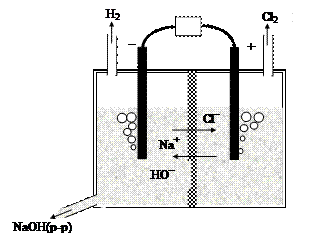 |
Рис. 45. Схема промышленного электролизера для получения хлора, водорода и гидроксида натрия из водного раствора NaCl
При электролизе водного раствора NaCl катионы Na+ проводят электрический ток, но не участвуют в окислительно-восстановительных реакциях на электродах. Для восстановления Na+ необходим электродный потенциал -2,71В, а для восстановления воды достаточен электродный потенциал -0,83В. Поэтому вместо восстановления ионов натрия до металлического натрия идет реакция восстановления водорода из воды:
катод (восстановление): 2Н2О(ж)+2е- ® Н2(г)+2ОН-(р-р).
На аноде окисляются ионы хлора:
анод (окисление): 2Cl-(ж) ® Cl2(г) + 2е-.
Суммарная реакция электролиза раствора NaCl:
2Н2О(ж) + 2Cl-(р-р) ® Н2(г) + Cl2(г) + 2ОН-(р-р)
или
2Н2О(ж)+2Na+(р-р)+ 2Cl-(р-р)®Н2(г) + Cl2(г) + 2NaОН(р-р).
В растворе вблизи катода накапливается гидроксид натрия NaOH, так как в катодном пространстве находятся катионы Na+ и выделяющиеся в результате катодной реакции анионы ОН-.
В современных электролизерах для получения хлора используют металлические электроды. Особенно сильно изнашивается анод. Его изготавливают из титанового сплава, содержащего платину и иридий или рутений и иридий.
Окислительно-восстановительное действие электрического тока намного эффективнее действия химических окислителей и восстановителей. Например, известно, что ни один химический окислитель не может «отнять» электрон у фторид-иона F-. Чистый фтор удалось получить лишь при электролизе раствора фторида калия (KF) во фтористоводородной кислоте (HF). На аноде выделяется фтор, а на катоде – водород:
катод (восстановление): 2Н+(ж) + 2е- ® Н2(г);
анод (окисление): 2F-(ж) ® F2(г) + 2е-.
Восстановление воды на катоде и окисление ее на аноде - довольно частое явление в электролизе водных растворов солей. В таких случаях электролит играет роль ионного проводника, обеспечивающего ионную проводимость водного раствора при электролизе воды.
В табл. 8 приведены основные электродные реакции, протекающие при электролизе водных растворов различных электролитов.
Т а б л и ц а 8








