Промышленное получение натрия
Промышленное получение металлического натрия осуществляют пропусканием электрического тока через расплав хлорида натрия NaCl (температура плавления хлорида натрия 8010С). Энергия внешнего источника электрической энергии расходуется на восстановление ионов натрия до металла и ионов хлора до молекулярного хлора (рис. 43).
Электролиз расплава NaCl используется для промышленного получения металлического натрия и газообразного хлора Cl2. В промышленной конструкции электролизера предусматривается защита расплавленного натрия от контакта с кислородом воздуха и хлором. Для этого катодное и анодное пространства разделены перегородкой. На катоде выделяется металлический натрий, на аноде – газообразный хлор:
катод (восстановление): 2Na+(ж) + 2е- ® 2Na(ж).
анод (окисление): 2 Cl - (ж) ® Cl2(г) + 2е - .
2Na+(ж) + 2Cl-(ж) ® 2Na(ж) + Cl2(г).
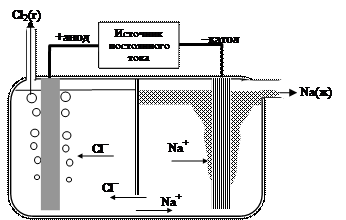 |
Рис. 43. Схема промышленного электролизера для получения металлического натрия (и сопутствующего Cl2) . Анод – графитовый, катод – железный
Промышленное получение алюминия
Исходным сырьем для электрохимического получения металлического алюминия в промышленных масштабах служит оксид алюминия. Бесцветные кристаллы Al2O3 плавятся при температуре 2044 оС. Это слишком высокая температура для технического осуществления электролиза. Нужно было найти способ понижения температуры расплава. И он был найден. Оказалось, что оксид алюминия хорошо растворяется в расплавленном гексафторалюминате натрия Na3[AlF6] – минерале криолите, который плавится при 1011 оС. Температура плавления смеси оксида алюминия и криолита понижается. Фактически электролиз высокотемпературного раствора (расплава) осуществляют при 950 – 980 оС (рис. 44).
В расплаве криолита оксид алюминия находится в ионном состоянии. Равновесная диссоциация оксида алюминия происходит согласно следующим реакциям:
Al2O3 ⇄ AlO+ + AlO2-
AlO2- ⇄ Al+3 + 2O-2
AlO+ ⇄ Al+3 + O-2
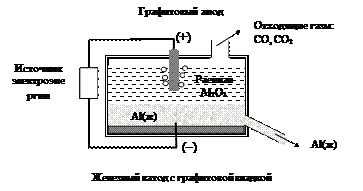 |
Рис. 44. Схема электрохимического получения алюминия
На электродах идут реакции, изменяющие степень окисления алюминия и кислорода:
на катоде: Al+3(р-р) + 3e- = Al0(ж) ÷ х4
на аноде: 2 O -2 (р-р) = O 2 0 (г) + 4е- ÷ х3
4Al+3(р-р ) + 12е- + 6O-2(р-р ) = 4Al0(ж) + 3O20(г) + 12е-
2Al2O3(р-р) = 4Al(ж) + 3O20(г).
Параллельно анод при высокой температуре реагирует с выделяющимся на нем кислородом:
С(т) + О2(г) ® 2СО(г).
С(т) + О2(г) = СО2(г).
По мере сгорания графитового анода его приходится периодически заменять на новый.
При получении металлического алюминия металл опускается на дно электролизера, так как он тяжелее расплава оксида алюминия в криолите.








