Топливные элементы
Рассмотрим работу водородно-кислородного топливного элемента, в котором энергия горения водорода
Н2(г) + 1/2О2(г) = Н2О(ж); D Gr = - 237.2 кДж
превращается в электрическую энергию. Схема устройства топливного элемента представлена на рис. 41.
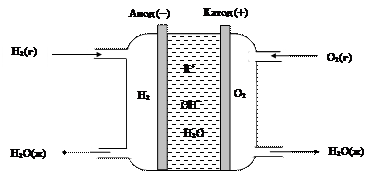
Рис. 41. Схема водородно-кислородного топливного элемента с пористыми никелевыми электродами
В топливном элементе
(-) (Ni) Н2(г)½КОН (р-р) ½½О2(г) (Ni) (+)
осуществляются раздельно протекающие реакции:
анод (окисление): 2Н2(г)+4ОН-(р-р) ®4Н2О(ж)+4е-;
катод (восстановление): О2(г)+ 2Н2О(ж)+ 4е-®4ОН-(р-р).
Сложение анодной и катодной реакций приводит к результату, который отвечает горению водорода в кислороде.
Водородно-кислородные элементы нашли применение для питания бортовой аппаратуры космических кораблей.
Аккумуляторы
Аккумуляторы - химические источники электрической энергии многократного действия.
В каждом автомобиле устанавливается аккумулятор. Масштабы производства аккумуляторов сравнимы с производством автомобилей и других механических устройств, которые используют электрический ток для запуска двигателя. Аккумулятор как источник электрической энергии многократного действия имеет несомненные преимущества перед гальваническими элементами.
В свинцовом аккумуляторе (рис. 42) электроды представляют собой пластины из пористого свинца. Анод - пористый свинец, катод - также пористый свинец, содержащий в порах оксид свинца PbO2. Оба электрода прочно установлены в плоской пластмассовой банке, заполненной 35 – 40%-ным водным раствором серной кислоты. Аккумулятор, подсоединенный к стартеру, при включении запускает двигатель автомобиля. Энергия электрохимического процесса (разрядка аккумулятора) превращается в механическую работу.
При разрядке аккумулятора на катоде идет реакция восстановления. Степень окисления свинца изменяется от +4 в PbO2 до +2 в PbSO4):
Pb+4O2-2(т)+HSO4-(р-р)+3H+(р-р)+2e- = Pb+2SO4-2(т) + 2H2O(ж).
На аноде идет реакция окисления. Степень окисления свинца изменяется от 0 в Pb до +2 в PbSO4:
Pb0(т) + HSO4-(р-р) = Pb+2SO4-2(т) + H+(р-р) + 2e-.
Суммарная окислительно-восстановительная реакция:
PbO2 + 2HSO4- + 3H+ + Pb⇄ 2PbSO4 + 2H2O + H+.
В процессе разрядки электродные реакции протекают слева направо, в процессе зарядки - справа налево. При работе аккумулятора происходит изменение состава электродов. На обоих электродах образуется сульфат свинца PbSO4.
Обычно каждая банка аккумулятора дает напряжение примерно 2В. Комплектуют аккумуляторную батарею из 6 банок, соединенных последовательно. Напряжение на концах аккумуляторной батареи 12В.
124Разрядка аккумулятора (при запуске двигателя) и зарядка аккумулятора (при работе двигателя внутреннего сгорания) осуществляются в процессе эксплуатации транспортного средства в течение многих лет.
|

Рис. 42. Свинцовый аккумулятор
4.6. Превращение электрической энергии в электролизерах
Самопроизвольные окислительно-восстановительные реакции используются в гальванических элементах для получения электрической энергии.
В электролизерах осуществляется химическое превращение, которое не может протекать самопроизвольно. Лишь внешний источник электрической энергии «заставляет» идти процесс в нужном направлении.
Электролизер – устройство, в котором электрическая энергия расходуется на превращение химических веществ в расплаве или водном растворе.








