Самопроизвольные окислительно-восстановительные реакции используются в гальванических элементах – устройствах превращающих энергию химической реакции в электрическую энергию.
Рассмотрим процесс возникновения отрицательно заряда на металлическом электроде, опущенном в раствор соли этого металла (рис. 36).
Пластинка металла, опущенная в раствор соли оказывается в неустойчивом состоянии (рис. 36, а). Об этом можно судить по наблюдаемому процессу окисления:
М1 ® М1+ + е-.
Частицы металла М1 в виде ионов переходят в раствор, оставляя электроны на электроде. Процесс растворения прекращается, когда отрицательный заряд электрода достигнет величины, препятствующей дальнейшему переходу положительно заряженных ионов в раствор.
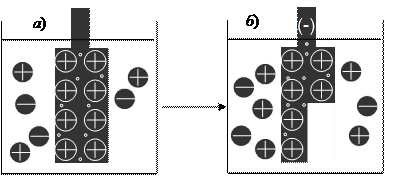 |
Рис. 36. Модель возникновения отрицательного заряда на металле, опущенном в раствор соли: а) электронейтральный электрод; б) отрицательно заряженный электрод
Электрод, на котором происходит реакция окисления, называется анодом.
Природа металла определяет направления окислительно-восстановительного процесса. Для некоторых металлов при прочих равных условиях наблюдаются реакции восстановления, если опустить металл М2 в раствор его соли:
М2+ + е-® М2.
Электрод приобретает положительный заряд в случае протекания на электроде восстановительной реакции (рис. 37). Катионы металла М2+ поступают из раствора, достраивают кристаллическую решетку электрода и создают некоторый недостаток электронов на нем.
Электрод, на котором происходит реакция восстановления, называется катодом.
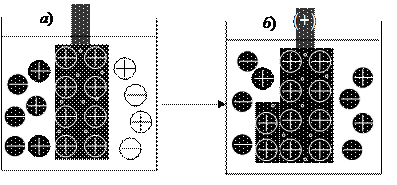 |
Рис. 37. Возникновение положительного заряда на металле, опущенном в раствор соли данного металла: а) электронейтральный электрод; б) положительно заряженный электрод
Положительно и отрицательно заряженные электроды, соединенные между собой в электрическую цепь, представляют собой гальванический элемент (рис. 38). В замкнутой электрической цепи на электродах самопроизвольно протекают окислительно-восстановительные реакции. Они сопровождаются движением электронов (по металлическому проводнику), а также катионов и анионов (по мостику, содержащему раствор электролита).
Раздельное течение электродных реакций в катодном и анодном пространстве осуществляется в результате растворения металлического анода и осаждения металла на катоде. Энергия движения электронов во внешней цепи может быть превращена в механическую энергию (электромотор) или энергию электромагнитного излучения (свечение лампочки накаливания).
Электрохимическая реакция в гальваническом элементе отличается от химической реакции двумя характерными признаками. Во-первых, отсутствием непосредственного контакта между реагентами и, во-вторых, генерированием электрической энергии.
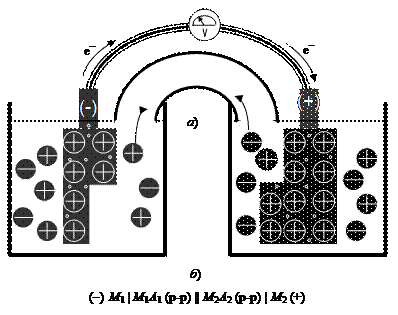
Рис. 38. Модель гальванического элемента: а) электроды соединены в электрическую цепь металлическим проводником, обладающим электронной проводимостью, и солевым мостиком, обладающим ионной проводимостью; б) гальванический элемент, записанный в строчку
Конкретным примером, подтверждающим высказанные выше положения, служит реакция между металлическим цинком и раствором сульфата меди:
При непосредственном контакте между реагентами можно наблюдать, как на поверхности растворяющихся кусочков цинка появляются розовато-красные отложения металлической меди:
Zn(т) + CuSO4(р-р) ® ZnSO4(р-р) +Cu(т)
или в ионном виде:
Zn(т) + Cu2+(р-р) ® Zn2+(р-р) +Cu(т).
В гальваническом элементе, составленном из цинкового и медного электродов:
(-) Zn(т) | ZnSO4(р-р) || CuSO4(р-р) | Cu(т) (+)
непосредственный контакт между реагентами исключается. Раздельно идут анодная и катодная реакции:
анод (окисление): Zn0(т)= Zn2+(р-р) + 2е-
катод (восстановление): Cu 2+ (р-р) + 2е - = С u 0 (т)
Zn0(т) + Cu2+(р-р) ® Zn2+(р-р) +Cu0(т)
или
Zn(т) + CuSO4(р-р) ® ZnSO4(р-р) +Cu(т).
В таком гальваническом элементе генерируется электрическая энергия.
4.4. Электродные потенциалы и электродвижущая сила
Когда мы говорим об относительной легкости, с которой металлы отдают электроны, то подразумеваем, что в ряду металлов существует определенный порядок в способности отдавать электроны. Это свойство металлов в окислительно-восстановительных реакциях характеризуется значениями их стандартных электродных потенциалов j.
Электродные потенциалы металлов определяют в гальваническом элементе, устройство которого представлено на рис. 39.
Электродные потенциалы сравнивают со стандартным потенциалом водородного электрода.
Водородный электрод представляет собой платиновую пластинку, опущенную в водный раствор соляной кислоты (сHCl = 1 моль/л). Через раствор пропускают пузырьки водорода при давлении р(Н2) = 1 атм. Водород в незначительных количествах растворяется в платине. Чтобы растворимость водорода увеличить, платиновую пластинку покрывают пористой платиной (платиновой чернью). Такой электрод называют стандартным водородным электродом. Условились потенциал водородного электрода j0(Н2) считать равным нулю, если концентрация ионов водорода равна 1 моль/л. Платина в таком электроде играет роль электрического проводника и не участвует в химических реакциях.
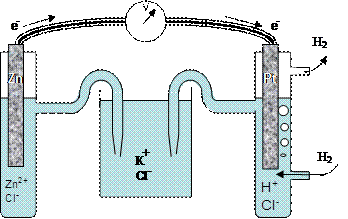 |
Рис. 39. Гальванический элемент для измерения электродного потенциала цинка, составленный из стандартного водородного электрода (справа) и цинкового электрода (слева). Электроны во внешней цепи движутся от цинкового к водородному электроду
Другой электрод, потенциал которого следует измерить относительно стандартного водородного электрода, представляет собой металл, опущенный в раствор соли данного металла.
Таким металлом может быть цинковая пластинка, опущенная в раствор соли ZnCl2. Потенциал цинкового электрода считается стандартным, если концентрация ионов цинка в растворе 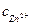 = 1 моль/л.
= 1 моль/л.
С помощью гальванометра измеряют разность электродных потенциалов в вольтах (В). Электродвижущую силу (ЭДС) гальванического элемента обозначают Е. Значение стандартного электродного потенциала цинкового электрода j0(Zn) вычисляют по уравнению:
Е= j0(Н2) - j0(Zn),
где Е - экспериментально измеренное значение ЭДС гальванического элемента равное 0.76 В, j0(Н2) = 0.
0.76 = 0 – j0(Zn)
j0(Zn) = – 0.76 В.
Стандартные электродные потенциалы металлов в водном растворе равны электродвижущей силе гальванического элемента Е, составленного из данного металлического электрода и стандартного водородного электрода.
Значения стандартных электродных потенциалов некоторых металлов приведены в табл. 7.
Т а б л и ц а 7
Стандартные электродные потенциалы при 25 оС (с = 1 моль/л),
р = 1 атм (для газов)
| Электрод | Электродная реакция | j0, В |
| Li+|Li | Li+ + e- = Li | - 3.04 |
| K+|K | K+ + e- = K | - 2.92 |
| Ca2+|Ca | Ca2+ + 2e- = Ca | - 2.87 |
| Na+|Na | Na+ + e- = Na | - 2.71 |
| Mg2+|Mg | Mg2+ + 2e- = Mg | - 2.37 |
| Al3+|Al | Al3+ + 3e- = Al | - 1.66 |
| Mn2+|Mn | Mn2+ + 2e- = Mn | - 1.18 |
| Zn2+|Zn | Zn2+ + 2e- = Zn | - 0.76 |
| Fe2+|Fe | Fe2+ + 2e- = Fe | - 0.44 |
| Ni2+|Ni | Ni2+ + 2e- = Ni | - 0.25 |
| Sn2+|Sn | Sn2+ + 2e- = Sn | - 0.14 |
| Pb2+|Pb | Pb2+ + 2e- = Pb | - 0.13 |
| H+|H2(Pt)* | H+ + + e- = 1/2H2 | 0.00 |
| Cu+|Cu | Cu2+ + 2e- = Cu | + 0.34 |
| OH-|O2(Pt)* | 1/2O2 + Н2О + 2e- = 2 OH-| | + 0.401 |
| Hg22+|Hg | Hg22+ + 2e- = Hg | + 0.79 |
| Ag+|Ag | Ag+ + e- = Ag | + 0.80 |
| Au+|Au | Au+ + e- = Au | + 1.50 |
*) указаны водородный и кислородный электроды.
Ряд стандартных электродных потенциалов характеризует активность металлов в электрохимических и химических превращениях. Из табл. 7 следует, что окислительные свойства ионов металлов увеличиваются в последовательности от Li+ к Au3+, а восстановительные свойства металлов возрастают от Au к Li
Свойство одних металлов вытеснять ионы других металлов из растворов их солей мы уже наблюдали на примере электрохимической реакции в гальваническом элементе, составленном из цинкового и медного электродов.
Электродные потенциалы щелочных и щелочноземельных металлов невозможно определить в гальваническом элементе, так как они реагируют с водой. Для них электродные потенциалы вычислены теоретически.
Вычисление электродных потенциалов
Рассмотрим работу медно-цинкового гальванического элемента
(-) Zn | ZnSO4(р-р) || CuSO4(р-р) | Cu (+).
Анодное окисление: Zn ® Zn2+ + 2e–.
Катодное восстановление: Cu2+ + 2e–® Cu.
Суммарная реакция: Zn(т) + Cu2+ (р-р) = Zn2+(р-р) + Cu(т).
Количество электрической энергии в форме работы, получаемой от гальванического элемента, вычисляется по уравнению:
A = zFE ,
где z– число моль электронов, переносимых окислительно-восстановительной реакцией; F = 96500 [Дж/В] - число Фарадея или электрический заряд одного моль электронов; Е - электродвижущая сила (ЭДС) элемента [В].
Функция Гиббса для термодинамически обратимой химической реакции
Zn + Cu2+ = Zn2+ + Cu; DG < 0,
протекающей в гальваническом элементе, равна максимальной работе, совершаемой этой реакцией:
DG = – Amax = – zFE.
Отступление. Связь между ЭДС гальванической цепи и концентрациями реагентов легко установить, если воспользоваться уравнением изотермы химической реакции:
DG = DG0 + RTln 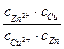
DG = – zFE, DG0 = – zFE0, отсюда
–zFE = –zFE0 + RTln 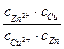
Е = Е0 - 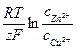 , (4.1)
, (4.1)
где Е0 – ЭДС элемента для концентраций катионов в водном растворе, равных 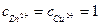 моль/л. «Концентрации» атомов индивидуальных металлов условно приняты равными единице
моль/л. «Концентрации» атомов индивидуальных металлов условно приняты равными единице 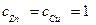 .
.
Электродные потенциалы гальванического элемента вычисляются по уравнению Нернста:
j(Zn) = j0(Zn) - RT / zF lnCZn2+,
j(Cu) = j0(Cu) - RT / zF lnCCu2+,
где j0 – стандартные электродные потенциалы при концентрации электролита, равной 1 моль/л; j – электродные потенциалы при концентрации электролита, отличающейся от 1 моль/л.
Из уравнения Нернста следует, что электродный потенциал зависит от температуры раствора и природы электролита.
Для расчета электродвижущей силы гальванического элемента Е, составленного из стандартных цинкового и медного электродов, вычитают из потенциала положительно заряженного электрода потенциал более электроотрицательного электрода:
Е = jCu2+/ Cu – jZn2+/ Zn
Пользуясь табл. 7 стандартных электродных потенциалов, несложно вычислить стандартную Е0 для вышеуказанного гальванического элемента.
Е0 = 0,34 – (–0,76) = 1,10 В.
4.5. Источники превращения энергии химической реакции в электрическую энергию
Гальванические элементы – источники энергии одноразового использования. После окончания срока работы они выбрасываются. Их мировое производство достигает примерно 10 млрд штук в год.
В гальваническом элементе не происходит никаких химических превращений, если элемент не подсоединен к потребителю электрической энергии (рис. 40).
В гальваническом элементе, показанном на рис. 40, включенном в электрическую цепь с потребителем энергии (калькулятором, фонарем и др.), одновременно осуществляются две химические реакции. На катоде идет реакция восстановления Mn+4 пиролюзита MnO2 в Mn+3 манганита Mn2O3:
2NH4+(р-р)+2МnO2(т)+2е-® Mn2O3(т)+ 2NH3(г)+Н2О(ж).
На аноде идет реакция окисления Zn в Zn2+. Она происходит на внутренней поверхности цинкового корпуса, выступающего в роли анода, при этом цинковая оболочка элемента истончается:
Zn(т) ® Zn2+(р-р) + 2е-.
Результатом электродных процессов является реакция:
2MnO2(т)+2NH4Cl(р-р)+Zn=Mn2O3(т)+2NH3(г)+ZnCl2(р-р) + Н2О(ж), D Gr <0.
Вещества, расположенные у катода и анода, между собой не перемешиваются, так как они представляют собой густые пасты. Такие гальванические элементы называют «сухими». В пастах происходит движение ионов, только с меньшей скоростью, чем в водных растворах.
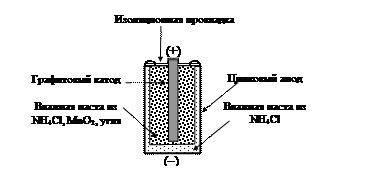
Рис. 40. Сухой гальванический элемент. В качестве загустителя водного раствора электролита и превращения электролита в пасту может быть использована мука
Этой скорости перемещения ионов достаточно для проведения электрохимических реакций.
Раздельное проведение реакций окисления на аноде и восстановления на катоде позволяет создать разность потенциалов на электродах и преобразовать энергию химической реакции в электрическую энергию гальванического элемента. Газообразный аммиак, который образуется в результате химической реакции в гальваническом элементе, связывается с помощью ZnCl2 в комплексную соль:
4NH3(г) + ZnCl2(р-р) = Zn[(NH3)4]Cl2(р-р).
Кроме приведенного марганцево-цинкового гальванического элемента, существует множество модификаций сухих элементов, электролитом в которых служат не только соли, но и щелочи. Наиболее распространенные сухие элементы имеют разность потенциалов между электродами Е, равную 1,5 В.








