Основность кислоты определяется числом ионов водорода, которые образуются при её диссоциации.
1) Реакции диссоциации слабых кислот
Диссоциация одноосновной циановодородной кислоты:
HCN ⇄ H+ + CN Kc = 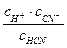 .
.
Диссоциация двухосновной угольной кислоты:
Н2СО3 ⇄ H+ + НСО3- К1
НСО3- ⇄ H+ + СО32- К2 (К1>К2)
Диссоциация трехосновной ортофосфорной кислоты:
Н3РО4 ⇄ H+ + Н2РО4- К1
Н2РО4-⇄ H+ + НРО42- К2
НРО42-⇄ H+ + РО43- К3 (К1>К2>К3)
2) Необратимые реакции нейтрализации сильной кислоты сильной щелочью сопровождаются образованием соли и воды. Раствор становится нейтральным (рН = 7):
НСl(р-р) + КОН(р-р) ® КСl(р-р) + Н2О(ж)
Полное ионное уравнение выглядит следующим образом:
Н+(р-р) + Сl-(р-р) + К+(р-р)+ОН-(р-р)®К+(р-р)+Сl-(р-р)+Н2О(ж)
Ионное уравнение в сокращенном виде:
Н+(р-р) + ОН-(р-р) ® Н2О(ж)
3) Реакции гидролиза
Соли – сильные электролиты. При растворении в воде они образуют гидратированные катионы и анионы. Если катионы или анионы соли при взаимодействии с водой образуют слабый электролит, то среда раствора становится либо щелочной, либо кислой.
Гидролизом называют реакцию ионов солей с водой, изменяющую рН среды с электронейтральной на кислую или щелочную.
Приведем примеры реакций гидролиза солей.
а) Гидролиз соли, образованной слабой кислотой и сильным основанием:
СН3СООNa(р-р) + Н2О(ж) ⇄ СН3СООН(р-р) +NaOH(р-р)
Полное ионное уравнение:
СН3СОО-(р-р)+Na+(р)+Н2О(ж)⇄СН3СООН(р-р)+Na+(р-р)+ОН-
Ионное уравнение в сокращенном виде:
СН3СОО-(р-р)+Н2О(ж)⇄ СН3СООН(р-р)+ +ОН-
Соли, образованные слабыми кислотами и сильными основаниями, гидролизуются с образованием ионов гидроксида ОН -, среда становится щелочной (рН > 7).
б) Гидролиз соли, образованной сильной кислотой и слабым основанием:
NH4Cl(р-р) + H2O(ж) ⇄ HCl(р-р) + NH4OH(р-р)
Полное ионное уравнение:
NH4+(р-р)+Cl-(р-р)+H2O(ж) ⇄ H+(р-р) + Cl-(р-р) + NH4OH(р-р)
Ионное уравнение в сокращенном виде:
NH4+(р-р) + H2O(ж) ⇄ H+(р-р) + NH4OH(р-р)
Соли, образованные сильными кислотами и слабыми основаниями, гидролизуются с образованием ионов водорода Н+, среда становится кислой (pH < 7).
Аналогично проходит реакция гидролиза AlCl3:
AlCl3(р-р) + H2O(ж) ⇄ Al(OH)Cl2(р-р)+ H+(р-р)+ Cl-(р-р)
Полное ионное уравнение:
Al3+(р-р)+3Cl-(р-р)+ H2O(ж) ⇄Al(OH)Cl2(р-р)+ H+(р-р)+ Cl-(р-р)
Ионное уравнение в сокращенном виде:
Al3+(р-р)+2Cl-(р-р) + H2O(ж) ⇄Al(OH)Cl2(р-р)+ H+(р-р)
Среда в растворе кислая.
Заметим, что соли, образованные сильными кислотами и сильными основаниями, например такие, как NaCl, не гидролизуются и не изменяют рН раствора (рН = 7).
Легко происходит гидролиз солей, образованных слабыми кислотами и слабыми основаниями. В зависимости от относительной силы кислоты или основания будет меняться кислотность водного раствора.
4) Реакции осаждения (образование нерастворимой соли)
СаСl2(р-р) + Na2SO4(р-р) ® 2NaCl(р-р) + CaSO4(т)¯
Полное ионное уравнение:
Ca2+(р-р)+2Сl-(р)+2Na+(р-р)+SO4(р-р)®2Na+(р-р)+2Cl-(р-р)+CaSO4(т)¯
Ионное уравнение в сокращенном виде:
Ca2+(р-р)+ SO4(р-р)® CaSO4(т)¯
5) Реакции образования газообразного вещества
СaCO3(т) + 2HCl(р-р) ® CaCl2(р-р) + Н2О(ж) + CO2(г)
Полное ионное уравнение:
СaCO3(т)+2H+(р-р)+2Cl-(р-р)®Ca2+(р-р) +2Cl-(р-р) +Н2О(ж)+CO2(г)
Ионное уравнение в сокращенном виде:
СaCO3(т) + 2H+(р-р) ® Ca2+(р-р) + Н2О(ж)+ CO2(г)
Ионные реакции, идущие с образованием нерастворимых в воде веществ, улетучивающихся из раствора газов, или малодиссоциирующих соединений, являются необратимыми.
Если малодиссоциирующие соединения есть в левой и правой частях уравнения, то реакция обратимая.
6) Окислительно-восстановительные реакции
При образовании веществ с ионной связью валентные электроны практически полностью переходят от атома одного элемента к атому другого. Например, взаимодействие металлического лития с газообразным молекулярным фтором есть окислительно-восстановительная реакция:
2Li0(т) + F20(г) ® 2Li+1F-1(т)
Атом лития отдает электрон (окисление) и при этом изменяет степень окисления от 0 до +1. Атомы в молекуле фтора принимают электроны (восстановление). Каждый из них изменяет степень окисления от 0 до -1.
Степень окисления - это условный, воображаемый заряд атома в химическом соединении, который определяется, исходя из предположения, что соединение состоит из ионов. При обозначении степени окисления положительный или отрицательный знак ставится обычно перед цифрой.
До участия в окислительно-восстановительной реакции электронная плотность в металле литии и в молекуле фтора (простые вещества) равномерно распределена. Для атомов, входящих в состав простых веществ, степень окисления равна нулю.
Многие окислительно-восстановительные реакции приводят к образованию химических соединений, в которых существуют ковалентные связи между атомами в молекуле. Например, реакция горения водорода (окисление) в кислороде (восстановление):
Н20(г) + О20(г) ® 2Н2О(ж).
В данной реакции степень окисления водорода и кислорода в молекуле воды – это условный заряд атомов Н2+1О-2. Некоторые соединения, проявляющие окислительные и восстановительные свойства приведены в табл. 6.
Т а б л и ц а 6








