По степени диссоциации электролиты делят на сильные и слабые. Степень диссоциации a электролита выражается отношением числа молекул, распавшихся на ионы, к общему числу молекул, введенных в раствор.
Сильные электролиты полностью распадаются на ионы при растворении в воде (a = 1). К сильным электролитам относятся:
1) соли: NaCl, КCl, CaCl2, MgCl2, CaSO4 и др.
2) основания щелочных и щелочноземельных металлов, например NaOH, КОН, Ca(OH)2.
3) многие неорганические кислоты, например серная H2SO4, азотная HNO3, соляная HCl.
Соли и основания щелочных и щелочноземельных металлов в кристаллическом виде имеют ионную кристаллическую решетку. Жидкие вещества, например серная кислота, практически на 100% состоит из молекулы H2SO4.
В воде сильные электролиты диссоциирует на ионы, например:
NaCl (кр.) ® Na+(р-р) + Cl-(р-р)
NaOH (кр.) ® Na+(р-р) + OH-(р-р)
H2SO4 (ж) ® Н+(р-р) + НSO4-(р-р)
К слабым электролитам (a<<1) относятся:
1) вода Н2О;
2) некоторые неорганические кислоты, например, синильная кислота HCN, сероводородная H2S, угольная кислота Н2СО3;
3) многие основания металлов, кроме щелочных и щелочноземельных, например Al(OH)3;
4) аммиачная вода, NH3(р-р) или NH4OH;
5) некоторые органические кислоты, например бензойная С6Н5СООН, уксусная СН3СООН.
Слабые электролиты частично диссоциируют на ионы при растворении в воде.
Н2СО3 (р-р) ⇄ Н+(р-р) + НСО3-(р-р).
Особое место среди слабых электролитов занимает вода. Электролитическая диссоциация воды описывается уравнениями:
Н2О + Н2О ⇄ Н3О+ + ОН- или
Н2О(ж) ⇄ Н+(р-р) + ОН-(р-р).
Константа равновесия Кс электролитической диссоциации воды выражается уравнением:
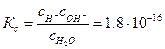 ,
,
где 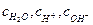 - равновесные концентрации воды и соответствующих ионов. Реакция диссоциации настолько сильно сдвинута влево, что концентрацию молекул недиссоциированной воды можно считать равной количеству моль воды, содержащихся в 1000 г (1 литре воды):
- равновесные концентрации воды и соответствующих ионов. Реакция диссоциации настолько сильно сдвинута влево, что концентрацию молекул недиссоциированной воды можно считать равной количеству моль воды, содержащихся в 1000 г (1 литре воды):
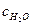 = 1000 г/18 г/моль = 55,6 моль.
= 1000 г/18 г/моль = 55,6 моль.
Произведение двух постоянных Кс × 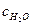 называют ионным произведением воды: К W = Кс ×
называют ионным произведением воды: К W = Кс × 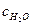
К W = 1,8 10-16 55,6 = 1×10-14
или
К W = 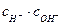 =1×10-14
=1×10-14
Ионное произведение воды (К W) при 250С есть величина постоянная. В нейтральной среде концентрация ионов водорода и ионов гидроксида одинакова и равна
СН+ × = СОН - = 10-7 моль/л
Концентрацию ионов водорода принято выражать водородным показателем рН, который вычисляется по уравнению:
pН = -lg CH +
В зависимости от кислотности шкала рН среды меняется в широких пределах (рис. 35).
В чистой воде концентрация ионов водорода равна СН+×=10-7 моль/л и рН нейтральной среды равна 7:
pН = -lg CH + = -lg 10-7 = -(-7) = 7
В кислой среде величина рН меньше 7, а в щелочной больше 7. В шкале рН удобно выражать кислотность или щелочность среды.
В табл. 5 приведены значения рН некоторых важнейших жидкостей, играющих значительную роль в жизни человека.
рН 1 2 3 4 5 6 7 8 9 10 11 12 13 14
 |
 CH+ 10-1 10-3 10-5 10-7 10-9 10-11 10-13
CH+ 10-1 10-3 10-5 10-7 10-9 10-11 10-13
кислая среда, рН< 7 щелочная среда, рН>7
|
Рис. 35. Шкала кислотности (рН) водной среды
Т а б л и ц а 5
Значения рН некоторых жидкостей
| Жидкость | рН |
| Раствор соляной кислоты НСl (1 моль/л) Чистый желудочный сок человека Лимонный сок Речная вода Морская вода Грудное молоко Сыворотка крови человека Раствор щелочи КОН (1 моль/л) | 0,0 0,9 - 1,1 2,3 5,6 7,8 – 8,3 6,6 – 6,9 7,4 14 |
Сильные электролиты полностью диссоциируют на ионы в воде. Слабые электролиты лишь частично распадаются на ионы, и мерой этого свойства являются два параметра: степень диссоциации a и константа диссоциации слабого электролита Кс. Последний параметр используется для оценки способности слабых электролитов диссоциировать.
Рассмотрим связь между константой диссоциации Кс и степенью диссоциации a такого слабого электролита, как бензойная кислота.
С6Н5СООН(р-р) ⇄ С6Н5СОО-(р-р) + Н+(р-р).
Константа диссоциации Кс определяется отношением произведения равновесных концентраций катионов и анионов к равновесной концентрации недиссоциированных молекул слабого электролита:
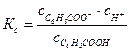 .
.
Начальная концентрация растворенной в воде бензойной кислоты с0. Равновесные концентрации ионов бензойной кислоты и водорода одинаковы и равны a×с0. Равновесная концентрация недиссоциированной бензойной кислоты равна:

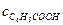 = (с0-a×с0) = с0(1-a).
= (с0-a×с0) = с0(1-a).
Подставим значения равновесных концентраций в выражение константы диссоциации Кс:
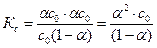 .
.
Для слабых кислот степень диссоциации существенно меньше единицы. При a << 1 величина (1-a) @ 1, и выражение константы диссоциации слабой кислоты имеет следующий вид:
Кс = a2 с0.
Константа диссоциации зависит только от температуры. Отметим важное свойство слабых электролитов: чем больше начальная концентрация электролита с0, тем меньше степень его диссоциации, что следует из нижеприведенного соотношения:
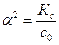 или a = (Кд/С0)1/2.
или a = (Кд/С0)1/2.
Пример. Определить степень диссоциации 0,1М водных растворов уксусной и бензойной кислот. Константы диссоциации кислот соответственно равны 1,8 .10-5 и 6,3.10-5 при 25 оС.
Решение
Для вычисления a воспользуемся уравнением
a = (Кд/С0)1/2.
Для 0,1М уксусной кислоты в воде:
a = (1,8 10-5 / 10-1)1/2 = (0,00018)1/2 = 0,0134.
Для 0,1М бензойной кислоты в воде:
a = (6,3 10-5 / 10-1)1/2 = (0,00063)1/2 = 0,025.
Следовательно, при 25 оС уксусная кислота диссоциирует на 1,34%, а бензойная кислота на 2,5%.
4.2. Реакции электролитов








