Насыщенный раствор - гомогенная смесь, содержащая наибольшее при данной температуре количество растворенного вещества.
Осмос – явление самопроизвольного перехода молекул растворителя из более разбавленного раствора в менее разбавленный, если оба раствора отделены друг от друга полупроницаемой перегородкой.
Осмотическим давлением ( p) называют избыточное гидростатическое давление, возникающее в результате осмоса.
Растворами называют однородные (гомогенные) системы, состоящие из двух или большего числа компонентов, имеющих молекулярную, ионную или атомную степень раздробленности.
Растворимость ( S ) определяется количеством вещества, которое способно раствориться в данном количестве растворителя с образованием насыщенного раствора при постоянной температуре и давлении.
Вопросы для проверки знаний
1. Какой раствор называют идеальным и чем реальный раствор отличается от идеального?
2. Какое различие существует между растворами и дисперсными системами?
3. Можно ли теоретически предсказать растворимость вещества?
4. Какие способы выражения концентрации вещества в растворе являются безразмерными?
5. Возрастает ли с увеличением температуры растворимость:
а) газов; б) жидкостей; в) твердых веществ в воде?
6. Связано ли кипение воды и образование пузырьков пара с местным перегревом жидкости?
7. Увеличивается ли температура кипения водного раствора нелетучего вещества по сравнению с чистой водой?
8. Увеличивается ли температура замерзания водного раствора нелетучего вещества по сравнению с чистой водой?
9. Какой физико-химический процесс лежит в основе осмотических явлений?
Упражнения
1. Экспериментально установлено, что в водах Мирового океана растворено углекислого газа в 60 раз больше, чем его содержится в атмосфере. Напишите химические превращения СО2 при растворении в морской воде.
2. В растворе содержится нелетучий компонент. Докажите, что уравнение 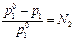 , где N2 – мольная доля нелетучего компонента, есть аналитическое выражение закона Рауля.
, где N2 – мольная доля нелетучего компонента, есть аналитическое выражение закона Рауля.
3. В закрытом сосуде находятся два стакана. Один содержит чистую воду, другой – раствор нелетучего компонента. Изменятся ли со временем уровни жидкости в стаканах?
4. Объясните, почему температуры замерзания растворов сахара (0.2 моль/л) и соли (0.2 моль/л) будут различаться.
5. В коленах U-образного сосуда, разделенных мембраной, содержится раствор соли (левое колено) и чистая вода (правое колено). Предложите способ получения чистой воды из солевого раствора, используя свойства мембраны.
6. Какая масса хлорида натрия (поваренная соль) и воды необходима для приготовления 400 г раствора с массовой долей соли 2%?
ТЕМА 4
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Обнаружение растворов, которые проводят электрический ток, послужило началом исследований электролитов. Электролиты – вещества, расплавы и растворы которых обладают ионной проводимостью электрического тока. Характерными структурными единицами электролитов являются ионы (рис. 33).
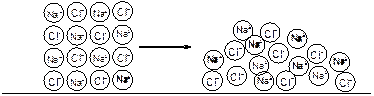 |
Рис. 33. Электролит NaCl: а) в твердом состоянии (кристалл соли); б) в жидком состоянии (в расплаве при Т >8010C)
Появление теории электролитической диссоциации, разработанной шведским физико-химиком С. Аррениусом (1859-1927), послужило мощным толчком быстрого развития электрохимии. Изучая свойства растворов различных соединений, Аррениус обратил внимание на свойства некоторых растворов проводить электрический ток.
На основании своих наблюдений он сформулировал положение о том, что при растворении некоторых веществ в воде они самопроизвольно распадаются на заряженные частицы - ионы. Такие растворы обладают ионной проводимостью.
4.1. Электролитическая диссоциация
Процесс распада соединения на положительно и отрицательно заряженные ионы при растворении называется электролитической диссоциацией. Например, концентрированная уксусная кислота не проводит электрический ток. При растворении уксусной кислоты в воде наблюдается заметная электропроводимость в результате диссоциации (распад, разъединение) молекул:
СН3СООН(р-р) ⇄ СН3СОО-(р-р) + Н+(р-р).
При растворении поваренной соли NaCl в воде наблюдаются два процесса: разрушение кристаллической решетки соли и гидратация ионов (рис. 34).
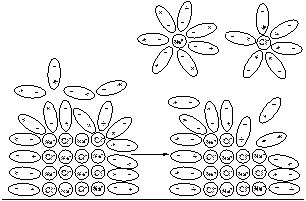 |
Рис. 34. Процесс разрушения кристаллической решетки NaCl при растворении в воде с образованием гидратированных ионов
Катионы Na+ и анионы Cl- не изменяют заряд раствора. Он остается электронейтральным, так как в нем содержится стехиометрическая смесь положительно и отрицательно заряженных частиц. Сумма положительных и отрицательных зарядов равна нулю.








