Осмотическое давление. Закон Вант-Гоффа
Осмос (др.-греч. wsmoV толчок, давление) есть явление самопроизвольного перехода молекул растворителя из более разбавленного в менее разбавленный раствор. Это явление наблюдается в том случае, когда оба раствора отделены друг от друга полупроницаемой перегородкой, пропускающей только растворитель (рис. 32).
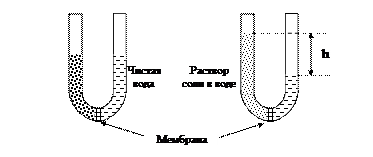
Рис. 32. Схема прибора, демонстрирующего явление осмоса
В левом сосуде (рис. 32) полупроницаемой перегородкой разделены раствор соли в воде и чистая вода. В термодинамически неравновесной системе происходит самопроизвольный процесс выравнивания концентраций путем проникновения молекул воды через полупроницаемую перегородку в концентрированный раствор соли. Преградой такому движению растворителя служит увеличивающееся давление столба жидкости, как показано в правом сосуде на рис. 32. Процесс выравнивания концентраций останавливается при достижении некоторого давления p. Перепад уровней между раствором и чистым растворителем в правом колене отражает осмотическое давление воды p.
К осмотическому давлению применимы законы газового состояния:
p V = nRT или p = с RT ,
где V – объем раствора, n – количество моль растворенного вещества, R – газовая постоянная, Т – абсолютная температура.
Последнее уравнение называется законом Вант-Гоффа.
Явление осмоса играет важную роль в жизни растений и живых организмов. У млекопитающих осмотическое давление большинства биологических жидкостей равно осмотическому давлению крови. Осмотическое давление, создаваемое в клетках животных растворами белков, полисахаридов и др., незначительно, но играет важную роль в обмене веществ.
Свойства, зависящие от количества составляющих раствора, а не от природы его частиц, называют коллигативными свойствами растворов.
Законы Рауля р1 = р10 N 1; Генри с = кг. р; Вант-Гоффа
p = с RT; а также повышение температуры кипения и понижение температуры замерзания водного раствора нелетучего вещества D Ткип. = Э × с m , и D Ткр. = Кс m отражают проявление растворами коллигативных свойств.
Краткий итог темы
1. Растворы это однородные (гомогенные) системы, состоящие из двух или большего числа компонентов, имеющих молекулярную, ионную или атомную степень раздробленности.
2. В гомогенных системах (растворах) существуют наиболее благоприятные условия для контакта реагентов (атомов, молекул или ионов) во всем объеме. Если необходимо увеличить скорость процесса, то гомогенные реакции предпочтительнее гетерогенных, так как в гетерогенных системах участие реагентов в реакции ограничено поверхностью раздела фаз.
3. Концентрацию вещества в растворе выражают различными способами.
Отношение количества n моль растворенного вещества, содержащегося в V л раствора, с = n/V моль/л выражает молярность раствора.
Отношение количества ni моль вещества данного компонента к суммарному количеству (Sni) моль всех веществ, составляющих раствор, N = ni / S nj выражает молярную долю соединения в растворе.
Отношение массы mi кг данного растворенного вещества к массе (Smj) кг раствора выражает массовую долю растворенного вещества. Массовая доля может быть выражена в долях единицы или в процентах: w = mi/S mj или w = 100 mi/S mj , %.
4. Свойства разбавленных растворов по своим характеристикам приближаются к свойствам идеальных растворов, в которых отсутствует взаимодействие между частицами.
Свойства, зависящие от количества, но не от природы частиц раствора, называют коллигативными свойствами растворов.
Законы Рауля р1 = р10 N1; Генри с = кг× р; Вант-Гоффа
p = с RT; эбулиоскопия D Ткип = Э × с m , и криоскопия DТкр = Кс m отражают проявление растворами коллигативных свойств.
Термины для запоминания








