Повышение температуры кипения и понижение температуры замерзания водных растворов по сравнению с чистым растворителем является прямым следствием действия закона Рауля.
Температура кипения отвечает такому состоянию системы, когда давление пузырьков пара кипящей жидкости становится равным внешнему (атмосферному) давлению. В открытом стакане температура кипения чистой воды равна 100 оС при атмосферном давлении р = 1 атм (1.013×105 Па). Температура замерзания (кристаллизации) воды при атмосферном давлении равна 0 оС.
Если в кипящую воду бросить кристаллы сахарозы, то давление пара над водным раствором нелетучего вещества (сахарозы) уменьшится в соответствии с законом Рауля. Следовательно, раствор при температуре 100 0С перестанет кипеть. Потребуется увеличить температуру, чтобы увеличить давление пара воды над раствором и довести раствор до кипения.
На фазовой диаграмме воды (рис. 31) линия О C отражает фазовое равновесие жидкость ⇄ пар для чистой воды, а линия FD - для водного раствора нелетучего вещества. В точках C и D давление пара над чистым растворителем и над раствором равно внешнему давлению, равному 1 атм. Чистая вода закипает при 100 оС (373.15 К), а температура кипения раствора возрастает на величину D Ткип..
Для разбавленных растворов нелетучих веществ повышение температуры кипения прямо пропорционально количеству растворенного нелетучего вещества:
D Ткип. = Э × с m ,
где Э [кг×К×моль-1] – эбулиоскопическая постоянная растворителя. Для воды она равна 0,51[кг×К×моль-1]; с m [моль/кг Н2О] – количество молей растворенного вещества в 1 кг воды.
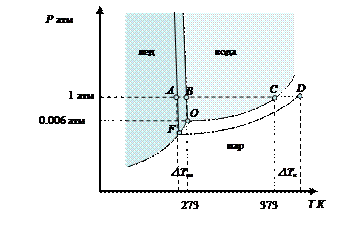 |
Рис. 31. Фазовая диаграмма воды и водного раствора нелетучего вещества
По аналогии с предыдущим температура замерзания раствора ниже температуры кристаллизации чистого растворителя при постоянном внешнем давлении, равном 1 атм (рис. 31). Точка B на фазовой диаграмме соответствует температуре кристаллизации чистой воды (или плавления льда) при внешнем давлении, равном 1 атм. Точка А соответствует температуре появления кристаллов льда в растворе при 1 атм.
Из диаграммы следует, что появление кристаллов льда в растворе происходит при более низкой температуре, чем в чистой воде на величину DТкр. Для разбавленных растворов нелетучих веществ понижение температуры кристаллизации растворителя прямо пропорционально количеству растворенного нелетучего вещества:
DТкр = Кс m,
где К [кг×К×моль-1] – криоскопическая постоянная растворителя, для воды она равна 1,86, с m[моль/кг Н2О] - количество молей растворенного вещества в 1 кг воды.
Криоскопия и эбулиоскопия используются для определения молекулярной массы растворенного вещества в предельно разбавленных растворах.
Пример. Для определения молекулярной массы кристаллического порошка, который предположительно должен быть либо сахарозой, либо глюкозой, растворили 0.349 г этого неизвестного соединения в 100 г воды. Понижение температуры кристаллизации раствора составляет DТкр = 0.036 К. Определить молекулярную массу соединения.
Решение. с m = 0,349 1000/100 = 3,49, DТкр = Кс m;
0.036 = 1.86×3.49/М М = 1.86×3.49/0.036 = 180.3 г/моль. Молекулярные массы сахарозы и глюкозы соответственно равны 342.31 и 180.17 г/моль. Исследуемый нами порошок – глюкоза.








