Растворимость газов в воде (мл/100 г Н2О) при парциальном давлении 1 атм и константе Генри (кг, моль × л-1атм-1)
| Т оС Газ | 10 | 25 | 30 | 40 | кГ 25 оС |
| N2 O2 СО2 | 1,86 3,8 119,4 | 1,43 2,83 75,9 | 1,34 2,61 66,5 | 1,18 2,31 53,0 | 6.48×10-4 1.28×10-3 3.38×10-2 |
Парциальное давление компонента есть доля давления данного компонента в общем давлении газовой смеси. В соответствии с законом Дальтона робщ. = Sр i. Если газовая смесь состоит из двух компонентов, то робщ. = р1 + р2, где р1 и р2 – парциальные давления компонентов 1 и 2 соответственно.
Высокая растворимость СО2 в воде по сравнению с кислородом и азотом имеет объяснение. Углекислый газ, растворяясь в воде, вступает с ней во взаимодействие с образованием угольной кислоты Н2СО3. Угольная кислота не существует вне водного раствора в качестве индивидуального соединения, а в растворе диссоциирует. В результате диссоциации угольной кислоты происходит смещение равновесия в сторону химически связанной углекислоты, и растворимость СО2 в воде увеличивается:
СО2(р-р) + Н2О(ж) ⇄ Н2СО3(р-р) ⇄ Н+(р-р) + НСО3-(р-р).
Другие газы (азот, кислород) не участвуют в подобных обратимых реакциях с водой.
Растворенного углекислого газа СО2 вместе с угольной кислотой Н2СО3 и ионами НСО3-, СО32- в природных водах (морях, океанах, подземных водах, озерах, реках) в несколько десятков раз больше, чем в атмосфере, в пересчете на свободный углекислый газ.
3.3. Физические свойства растворов. Закон Рауля
Исследования растворов, выполненные французским физиком и химиком Ф. Раулем, позволили установить следующий закон, носящий его имя: давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя.
р1 = р10 N1,
где р1 и р10– давление пара растворителя над раствором и чистым растворителем; N1 – мольная доля растворителя в растворе. Линейная зависимость давления пара растворителя над раствором в координатах р – N1 представлена на рис. 29.
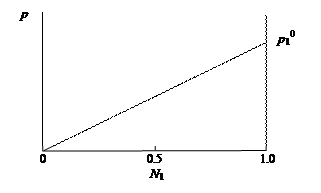 |
Рис. 29. Зависимость парциального давления пара р1 растворителя от мольной доли N1 растворителя в растворе
Закон Рауля выполняется лишь для идеальных растворов. Идеальный раствор состоит из компонентов, энергия взаимодействия между которыми одинаковая и не зависит от природы входящих в состав раствора веществ. Следствием идеальности раствора является характер зависимости между парциальным давлением пара компонента и его концентрацией в растворе. Изменение концентрации компонента в растворе приведет к пропорциональному изменению его парциального давления над раствором, т.е. давление пара растворителя (р1) над раствором, содержащим нелетучее вещество, линейно изменяется с ростом мольной доли растворителя (рис. 29).
В реальных растворах наблюдаются значительные отклонения от закона Рауля. Например, такие отклонения можно наблюдать для водного раствора тростникового сахара (рис. 30).
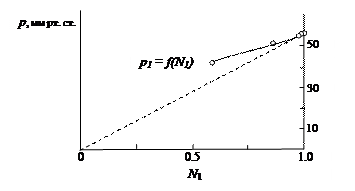
Рис. 30. Зависимость парциального давления водяного пара р1 над водным раствором сахарозы от мольной доли воды в растворе
Пунктирная прямая на рис. 30 относится к идеальному раствору, подчиняющемуся закону Рауля. Зависимость давления пара от мольной доли растворителя для неидеального раствора (в данном случае раствора тростникового сахара) представлена непрерывной кривой, и показывает отклонение от закона Рауля.








