Растворимость твердых веществ в воде
Растворимость твердых веществ в воде с увеличением температуры, как правило, увеличивается (рис. 28).
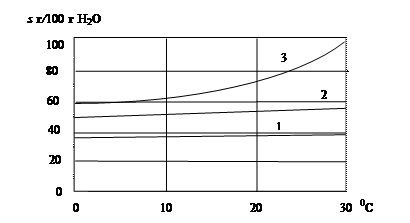 |
Рис. 28. Зависимость растворимости NaCl (кривая 1), MgCl2 (2) и CaCl2 (3) от температуры
Между твердым веществом и его насыщенным раствором устанавливается термодинамическое равновесие:
твердое вещество ⇄ насыщенный раствор; △Нраств.
Знак и величина энтальпии растворения твердого вещества определяется двумя процессами. Энергия в форме теплоты (Qкрист. = △Нкрист> 0) затрачивается на разрушение кристаллической решетки и выделяется (Qгидрат. = △Нгидрат< 0) в результате гидратации ионов или молекул.
△Нраств. = △Нкрист. + △Нгидрат.
В зависимости от соотношения эффектов гидратации и разрушения кристаллической решетки растворение может быть и экзотермическим, и эндотермическим процессом.
Энтропийный фактор связан, прежде всего, с увеличением беспорядка, вызванного разрушением кристаллической структуры (△Sраств.> 0). В конечном счете знак △ Gраств определяется энтальпийным и энтропийным факторами (табл. 2).
Т а б л и ц а 2
Термодинамические параметры растворения твердых веществ в воде (Т = 298.15 К, р = 101.3 кПа)
| Растворяемое вещество | △H ораств, кДж/моль | △S ораств, Дж/(К×моль) | △G ораств, кДж/моль |
| NaCl (т) KCl (т) KOH (т) CaCl2 (т) | +3.77 +17.2 -55.6 -76.8 | +43.5 +74.9 +31.5 +475.0 | -9.2 -5.0 -65.0 -218.3 |
Из уравнения (3.1) следует, что с ростом температуры, как правило, создаются благоприятные условия повышения растворимости твердых веществ.
Растворимость органических жидкостей в воде
Экспериментально установленное правило «подобное растворяется в подобном» свидетельствует о том, что в полярных средах растворяются полярные вещества, в неполярных – неполярные вещества. Вода – полярная среда, следовательно, неполярные органические соединения должны плохо растворяться в воде. В случае органических соединений, содержащих полярные группы, растворимость возрастает, а некоторые низкомолекулярные органические спирты и кислоты неограниченно смешиваются с водой. Например, такие спирты, как метанол CH3OH, этанол C2H5OH, этиленгликоль CH2(OH)CH2(OH), глицерин CH2(OH)CH(OH)CH2(OH) растворяются в воде в любых соотношениях. Низкомолекулярные органические кислоты, например уксусная кислота СН3COOH также неограниченно растворяются в воде. По мере увеличения длины углеводородной цепи в молекуле органической кислоты или спирта растворимость в воде уменьшается.
Неполярные органические соединения такие, как бензол, толуол, смесь органических соединений (бензин, дизельное топливо, мазут) практически не растворяются в воде.








