10. Какой физико-химический процесс лежит в основе действия ПАВ?
11. К какому типу дисперсных систем относится мыльная вода: а) по агрегатному состоянию; б) по степени раздробленности?
Упражнения
1. Расположите в ряд следующие дисперсные системы по степени возрастания размеров дисперсной фазы: мыльная вода, мыльная пена, титановые белила.
2. Условно примем, что на голове у человека 25000 волос. Средняя длина волоса 20 см. Диаметр цилиндрической формы волоса 0.08 мм. Рассчитайте площадь поверхности волосяного покрова головы, принимая во внимание только боковую поверхность цилиндрических волос.
ТЕМА 3
РАСТВОРЫ
Растворами называют гомогенные системы, состоящие из двух или большего числа компонентов.
Метаболические процессы, протекающие в живых организмах (растениях, животных, микробах), осуществляются при участии водных растворов органических и неорганических соединений и катализаторов. Например, в клетках растений под действием энергии солнечного излучения инициируется цепь последовательных химических реакций, позволяющая превратить водный раствор углекислого газа в глюкозу (фотосинтез):
h n
6СО2(р-р) + 6Н2О(ж) ® С6Н12О6(р-р) + 6О2(г).
глюкоза
Человек состоит примерно на 70 мас. % из воды, входящей в состав клеток и внеклеточной жидкости. Водные растворы неорганических ионов и органических соединений в составе клеток, плазмы крови, спинномозговой жидкости и лимфы обеспечивают нормальное функционирование человеческого организма.
В растворах химические реакции идут быстрее, чем в гетерогенной системе, в которой контакт между реагентами ограничен поверхностью раздела фаз (рис. 26, а). Молекулярная, ионная и атомная степень раздробленности соединений, составляющих раствор, позволяет вступать им в химические реакции во всем объеме раствора (рис. 26, б). Если требуется исключить взаимодействие реагентов, например защитить металл от коррозии, поверхность покрывают лаками, красками, разнообразными полимерными материалами, предотвращая непосредственный контакт металла с кислородом и влагой воздуха.
Наряду с жидкими растворами и газовыми смесями, в промышленности широко используются твердые растворы (рис. 27). Твердые растворы часто обладают более ценными механическими и физическими свойствами по сравнению с чистыми металлами. К твердым растворам относится бронза (Cu – Sn), латунь (Cu – Zn), сплавы серебра с золотом и медью (Au – Ag, Ag – Cu), мельхиор – сплавы меди с никелем (Cu – Ni). Последние обладают высокой коррозионной стойкостью, используются в морском судостроении, для изготовления медицинских инструментов, столовых приборов, посуды, монет, оболочек пуль.
 | |||||||
 | |||||||
| |||||||
| |||||||
Рис. 26. Модель взаимодействия реагентов: а) в гетерогенной системе молекулы реагентов сталкиваются между собой только на поверхности раздела фаз; б) в растворе (гомогенной системе) молекулы реагентов находятся в одной фазе, поэтому число столкновений между реагентами увеличилось.

Рис. 27. Различные типы растворов: а) жидкий раствор CuSO4 с молекулярной и ионной степенью раздробленности: Н2О, Cu2+, SO42-; б) твердый раствор (сплав металлов Au в Ag,) с атомной степенью раздробленности; в) газообразный раствор (смесь газов)
Деление раствора на растворитель и растворенное вещество – условный прием. Компонент раствора, присутствующий в большем количестве, принято называть растворителем. Вода всегда является растворителем независимо от количества растворенных веществ: соли, кислоты, щелочи.
Сталь – важнейший материал современной техники представляет собой твердый раствор углерода (~ 2 %) в железе. Для газов используется термин газовая смесь и не акцентируется внимание на том, «что в чем» растворено.
3.1. Способы выражения концентрации раствора
Количественный состав раствора определяется концентрацией, т.е. относительным содержанием компонентов, составляющих систему. Наиболее употребительными являются следующие концентрации растворов:
Молярность с – отношение количества n моль растворенного вещества, содержащегося в V л раствора:
с = n / V , моль/л.
Молярная доля N (безразмерная величина) – отношение количества ni моль вещества данного компонента к суммарному количеству моль всех веществ (Snj), составляющих раствор:
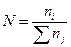 .
.
Массовая доля w (безразмерная величина) – отношение mi кг массы данного растворенного вещества к массе раствора (Smj) кг. Массовая доля может быть выражена в долях единицы или в процентах:
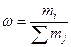 ,
,
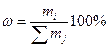 .
.
Между молярной концентрацией (с), массовой долей растворенного вещества (w), плотностью раствора (r) и молярной массой (М) существуют следующие соотношения:
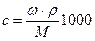 ,
,
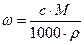 .
.
Ниже приведены некоторые примеры вычисления концентрации растворов.
Пример 1. В мерную колбу на 1 литр поместили m = 34.23 г сахарозы С12Н22О11 (М = 342.3 г/моль), растворили в воде и добавили воды до метки, соответствующей объему, равному 1 л. Вычислить молярную концентрацию раствора сахарозы.
Решение
 | |||
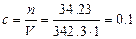 | |||
моль/л
 Пример 2 . 34.23 г сахарозы С12Н22О11 (М = 342.3 г/моль), растворили в 180 г воды. Вычислить мольную долю сахарозы и воды в растворе.
Пример 2 . 34.23 г сахарозы С12Н22О11 (М = 342.3 г/моль), растворили в 180 г воды. Вычислить мольную долю сахарозы и воды в растворе.
Решение
n(сах.) = mсах г / Мсах. г/моль = 34,23 г / 342,2 г/моль = 0.1 моль
n(вода) = mвода г / Мвода г/моль =180 г /18 г/моль = 10 моль
Nсах. = nсах. / (nсах + nвода) = 0,1 / (0.1 + 10) = 0.0099
Nвода = nвода / (nсах.+ nвода) = 10 / (0.1 + 10) = 0.9901
Следует помнить, что сумма мольных долей всех компонентов раствора равна 1:
Nсах + Nвода = 0,0099 + 0,9901 = 1,0
Пример 3. 34.23 г сахарозы С12Н22О11 (М = 342.3 г/моль), растворили в 180 г воды. Вычислить массовую и процентную долю сахарозы и воды в растворе.
Решение
 |
wсах. = mсах. г / (mсах+mвода) г = 34,23 / (34,23 + 180) = 0,16
или 16% сахарозы в водном растворе.
wвода = mвода г / (mсах+mвода) г = 180 / (34,23 + 180) = 0,84
или 84% воды в водном растворе.
Растворимость
Растворимость ( s ) определяется количеством вещества, способного раствориться в данном количестве растворителя при постоянной температуре и давлении (p , T = const). Для индивидуального соединения давление и температура являются определяющими факторами, влияющими на растворимость. Существует предел растворимости соединения при p , T = const. Раствор, содержащий наибольшее количество растворенного вещества в данных условиях, называется насыщенным раствором.
Используют различные единицы выражения растворимости. Для твердых веществ растворимость s имеет размерность г/100 г растворителя, или г/л растворителя.
Для газов растворимость выражается мл/100 г растворителя, мл/л раствора, или моль/л раствора.
3.2. Термодинамика процесса растворения
Растворение – самопроизвольный процесс. Кристалл сахара или поваренной соли в стакане с водой медленно разрушается, а молекулы (сахароза) или ионы (Na+, Cl-) равномерно распределяются по всему объему жидкости. Хотя растворение – самопроизвольный процесс, но это не означает, что все вещества растворяются. Одни вещества хорошо растворяются в воде, другие – в органических растворителях, а некоторые соединения не растворяются ни в тех, ни в других.
Объяснение самопроизвольного растворения вещества опирается на положение: процесс растворения термодинамически разрешен, если он сопровождается уменьшением функции Гиббса:
△Gраств. = △Hраств. – T△Sраств. < 0 (3.1)
Знак и величина △Gраств определяются энтальпийным (△Hраств.) и энтропийным (△Sраств) факторами.








